ANÁLISIS DEL ESTRÉS OXIDATIVO EN EL EYACULADO MEDIANTE LA DETERMINACIÓN DEL ANIÓN SUPERÓXIDO
Araceli Nicolich1, Rafael Lafuente2, Gemma López2, Agustín García-Peiró3,4, Mario Brassesco2
1Departamento de Biología Celular. Facultad de Biología. Universidad de Barcelona. Av. Diagonal 643. Barcelona
2CIRH. Clínica Corachán. ANACER. Pza. Eguilaz, 14. Barcelona
3Centro de Infertilidad Masculina y Análisis de Barcelona (Cimab), Edificio Eureka, Parc de Recerca de la UAB, Campus de la UAB, Bellaterra (Cerdanyola del Vallés), Barcelona
4Departament de Biologia Cel·lular, Fisiologia i Immunologia, Universitat Autònoma de Barcelona, Bellaterra
e-mail: aracelinv@gmail.com
Fecha recepción: 29 Marzo 2013
Fecha aceptación: 27 Abril 2013
El estrés oxidativo ejerce un papel importante sobre el daño producido en la célula espermática. Pero hay que tener en cuenta que para mantener el correcto funcionamiento del espermatozoide son necesarios niveles fisiológicos de especies reactivas de oxígeno (ROS). Es el desequilibrio entre antioxidantes y ROS el causante de alteraciones en el espermatozoide. En este estudio se hablará de la innovadora técnica del OxiSperm para medir el nivel de estrés oxidativo presente en el eyaculado del paciente. Se correlacionará los valores de estrés oxidativo con la edad del paciente y con diferentes parámetros seminales. Aunque no hemos podido observar correlación alguna con las variables estudiadas, este test puede ayudar a tomar decisiones diagnósticas y da una idea al laboratorio del modo en que se debe procesar. Un valor alto de estrés oxidativo aconsejaría un manejo rápido de la muestra, a poder ser con swim-up y evitando usar muestras congeladas para no inducir más daño. Rev Asoc Est Biol Rep 2013; 18(1):15-19.
Introducción
Tradicionalmente el diagnóstico de la infertilidad masculina se ha basado en la observación tanto macroscópica como microscópica del eyaculado, analizando el volumen, color, pH, licuefacción, viscosidad, concentración, motilidad o morfología. Pero estas características son insuficientes para el correcto diagnóstico de la infertilidad masculina. Estudios recientes hablan de la asociación que hay entre la integridad u organización del DNA y la fertilidad, ya que parece evidente que interfiere en la funcionalidad del espermatozoide, además de ser necesaria para la correcta transmisión del material genético (Atig et al., 2013). Si el material genético se encuentra dañado puede causar resultados clínicos adversos como la interrupción del desarrollo preimplantacional, incrementando la posibilidad de aborto espontáneo y morbilidad en la descendencia (Mitchell et al., 2011). Por eso cada vez más se investiga el desarrollo de diferentes técnicas diagnósticas capaces de brindar información sobre la naturaleza de la infertilidad masculina analizando otras características espermáticas.
Parece que las especies reactivas de oxígeno (ROS) producidas por la mitocondria de los espermatozoides y la estimulación de la peroxidación lipídica (LPO) son uno de los mayores causantes del daño al DNA del espermatozoide, afectando a la modificación de las bases nucleotídicas e incrementando los niveles de fragmentación del DNA (Atig et al., 2013; Venkatesh et al., 2011; Zini et al., 2011). En comparación con otras células los espermatozoides son más vulnerables al estrés oxidativo, debido a que su membrana es muy rica en ácidos grasos poliinsaturados (PUFA’s) (Atig et al., 2013; Cambi et al., 2013; Lewis and Simon, 2010).
Los ROS son producidos constitutivamente por el metabolismo celular. La mayor parte de ellos provienen de la reacción enzimática controlada del oxígeno con el hidrógeno en la fosforilación oxidativa que se lleva a cabo en la mitocondria durante el metabolismo oxidativo (Tremellen, 2008). El estrés oxidativo se produce si hay un desequilibrio entre los ROS y las defensas antioxidantes del organismo (Doshi et al., 2012). Éstos son metabolitos de oxígeno entre los cuales incluyen el anión superóxido (O2–), el peróxido de hidrógeno (H2O2) y los radicales hidroxil (considerados como los más perjudiciales), y especies reactivas de nitrógeno (RNS) como el óxido nítrico (NO–) y el anión peroxinitrito (ONOO–) entre otros (Doshi et al., 2012; Zini et al., 2011).
La LPO producida por los ROS produce reacciones catalíticas autopropagables, asociadas a la pérdida de función e integración de la membrana, llevando a una clara disminución de la capacidad fecundante del espermatozoide (Atig et al., 2013). La LPO en concreto afecta a la fluidez, a los gradientes iónicos, receptores de transducción de señales, procesos de transporte y enzimas de la membrana, aspectos que interfieren tanto en la motilidad del espermatozoide como en la fusión ovocito-esperma, además de causar daño en el DNA, producido por la modificación de bases y rotura de las cadenas (Jackson et al., 2005; Kothari et al., 2010).
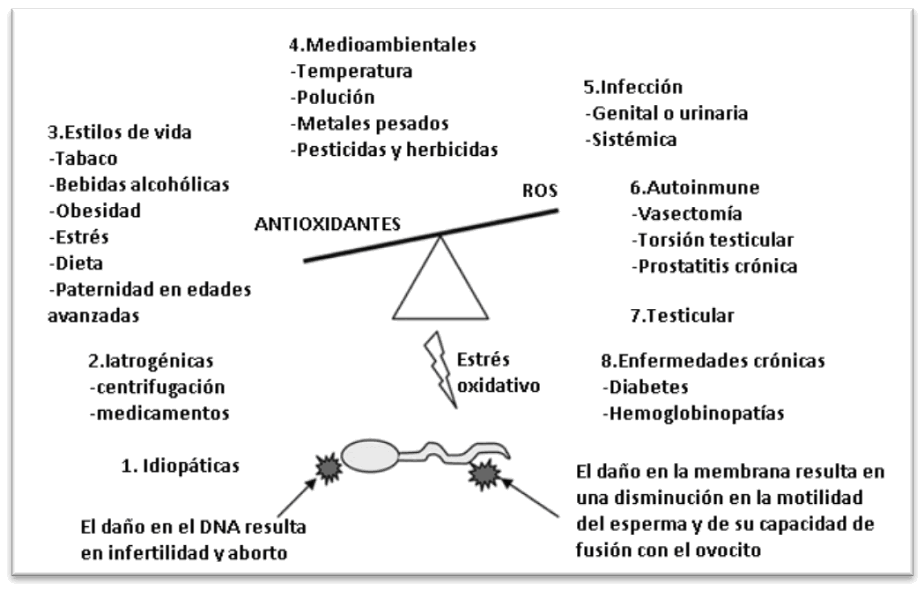
Los ROS pueden verse aumentados por causas medioambientales como el tabaquismo, exposición a radiación, agentes alquilantes, alcoholismo, drogadicción, calor, etc. Pero también pueden incrementarse por causas clínicas como la torsión testicular, infecciones genitales, varicocele, diabetes u obesidad (Figura 1). Un factor relevante en la síntesis de ROS es la edad masculina, ya que cada vez existe una mayor tendencia en posponer la paternidad (Pérez, 2007; Robinson et al., 2012; Zini, 2009; Zini et al., 2011).
Dado que los ROS pueden afectar la calidad espermática y el resultado de las técnicas de Reproducción Asistida, se han desarrollado recientemente métodos para detectar el nivel de estrés oxidativo en el eyaculado. Este estudio pretende evaluar la utilidad del test OxiSperm (Halotech©), empleada para el análisis del estrés oxidativo.
Figura 1. Causas del estrés oxidativo (Tremellen, 2008)
Material y Métodos
Se han incluido un total de 69 pacientes que acuden al centro por infertilidad. Se analiza una muestra seminal de cada paciente valorando la edad y los siguientes parámetros seminales: volumen, concentración, porcentaje de movilidad progresiva, vacuolización celular medida mediante alta magnificación (microscopio Leica AM6000), y determinación cualitativa del anión superóxido mediante el kit OxiSperm (Halotech©).
El seminograma se realiza mediante el sistema CASA con el analizador digital MEII (WHO, 2010). La clasificación vacuolar utilizada en la magnificación de los espermatozoides corresponde a la publicada por Van der Zwalmen et al. (2008), donde se consideran a los grupos con mayor grado de vacuolización (grado III+IV) y por tanto con peor pronóstico.
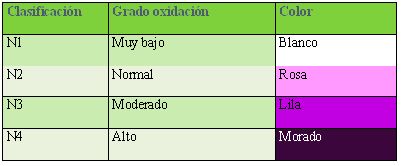
El kit OxiSperm se basa en la utilización de un Gel Reactivo (GR) que reacciona con el anión superóxido responsable del estrés oxidativo presente en el semen humano. En función de la concentración de anión superóxido, se forma un precipitado de color variable desde el rosa al morado o negro, que define el grado de estrés oxidativo de la muestra (Tabla I). El test ha de realizarse exclusivamente en muestras frescas.
Tabla I. Clasificación del estrés oxidativo según el rango de colores de la prueba Oxisperm (Halotech©).
Resumidamente, el protocolo consiste en calentar la agarosa del gel y mantenerla a 37ºC. Se debe mezclar en un tubo eppendorf un volumen determinado de la muestra de semen con un volumen igual del gel. Para calcular el volumen de muestra necesario se ha de dividir 1000 entre la concentración espermática del eyaculado. Homogenizar y dejar 45 minutos a 37ºC, hasta que se obtiene el color que nos dará el valor cualitativo de la presencia del anión superóxido.
Para llevar a cabo el estudio estadístico se utiliza el programa UNStat2 y el BoxPlot PRO (Universidad de Navarra). Se comprueba si las variables siguen una distribución normal mediante el test de Shapiro Wilks. Los datos experimentales siguen un modelo estadístico no paramétrico, y los cálculos han sido realizados mediante el test de Kruskal Wallis.
Resultados
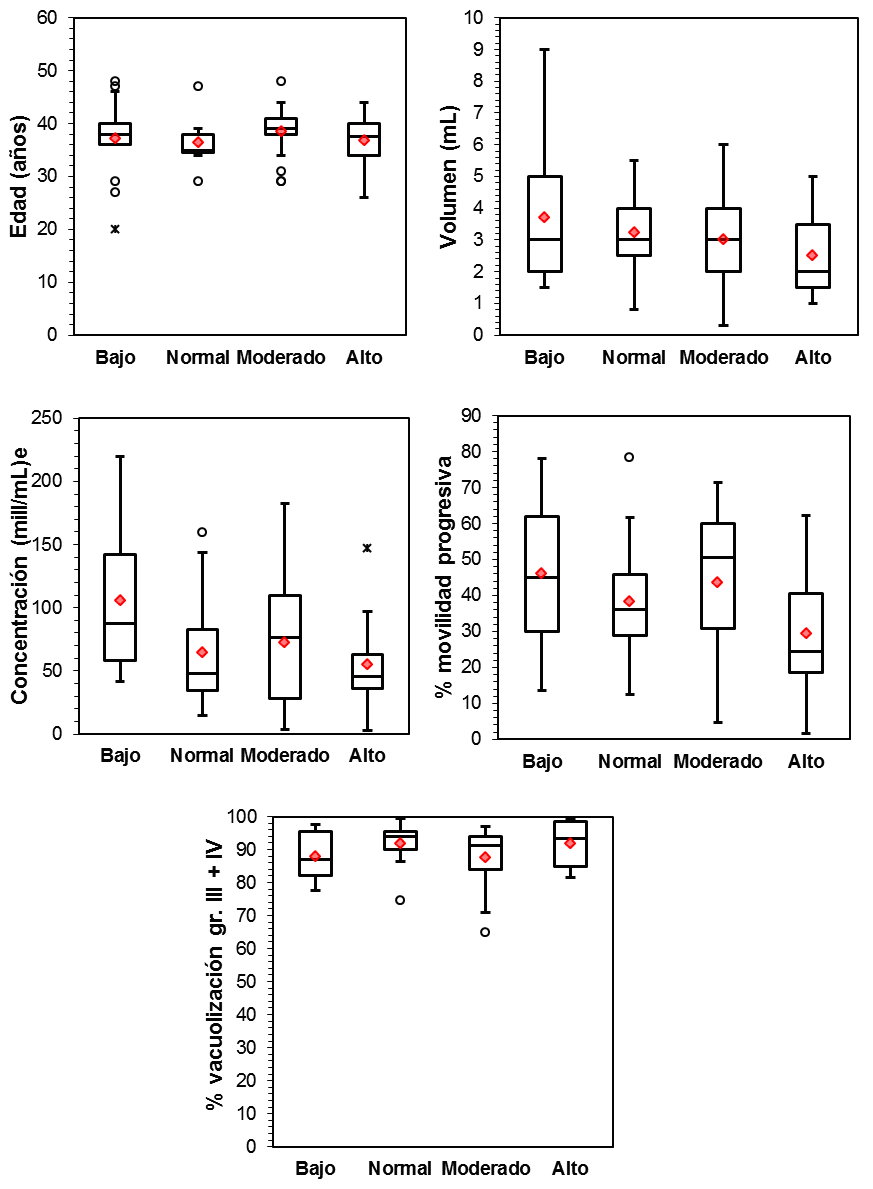
De los 69 pacientes analizados: 15 pacientes mostraron un grado de oxidación bajo (N1), 15 presentaron un nivel normal (N2), 25 presentaron un nivel moderado (N3) y 14 mostraron un nivel alto (N4).
Los resultados se muestran en la Tabla II y Figura2. El test de Kruskal Wallis indica que no hay asociación entre los niveles de estrés oxidativo con la edad ni con ninguno de los parámetros seminales analizados, sugiriendo que la presencia de estrés oxidativo en el eyaculado constituye un marcador de calidad espermática independientemente de estos factores.
Discusión
Estudios recientes confirman la asociación entre el estrés oxidativo y la infertilidad masculina. Los ROS ejercen un papel importante en la fisiología de los espermatozoides y, por lo tanto, son imprescindibles para su correcta funcionalidad. Fisiológicamente hablando, los ROS controlan la maduración, capacitación e hiperactivación del esperma, además de intervenir en la reacción acrosómica y fusión del espermatozoide al óvulo. Pero si el equilibrio entre ROS y antioxidantes se rompe, afectará tanto a las características que regula ya comentadas anteriormente, como a la concentración, morfología y motilidad, induciendo LPO, daño al DNA y apoptosis (Aktan et al., 2013; Kothari et al., 2010).
Figura 2. Gráficas del estadístico: edad y diferentes parámetros seminales vs grado de estrés oxidativo según el test OxiSperm.
*Con un nivel de significación α=0,05 obtenemos una Hχ2=7,815. Las H obtenidas a partir del test de Kruskal-Wallis de las diferentes variables experimentales son más pequeñas que la Hχ2 por lo tanto consideramos que no es significativo.
Tabla II. Resultado del estadístico
A los ROS se les refiere como radicales libres porque son moléculas que contienen uno o más electrones desemparejados, los cuales poseen una gran cantidad de energía. Éstos buscan emparejarse con otros electrones proporcionándoles la capacidad de reaccionar con otras moléculas como proteínas, lípidos o ácidos nucleicos, modificando así su estructura e incrementando el daño celular (Zini et al., 2011).
En el eyaculado humano, los ROS son producidos tanto por los espermatozoides inmaduros como por los leucocitos. Los leucocitos, especialmente los neutrófilos, activan el sistema mitocondrial y la vía de la NADPH incrementando así la producción de los ROS en caso de padecer una infección. Cuando se trata de los espermatozoides inmaduros, el exceso de citoplasma que presentan en la pieza intermedia también causa un incremento en la actividad mitocondrial aumentando la producción de los ROS; durante la espermatogénesis hay una pérdida de citoplasma para así conseguir su forma condensada y alargada característica de los espermatozoides maduros (Kothari et al., 2010; Tremellen, 2008), de esta manera parece que éstos tienen menos riesgo a sufrir estrés oxidativo. El plasma seminal contiene moléculas y enzimas antioxidantes, pero si estos sistemas se encuentran reprimidos se verá afectada gravemente la funcionalidad del espermatozoide (Zini et al., 2011; Zini et al., 2009). Los espermatozoides y muchas otras células están equipadas con sistemas enzimáticos antioxidantes como la superóxidodismutasa (SOD), glutatión peroxidasa (GPX) y catalasa (CAT), o bien moléculas antioxidantes naturales (ácido úrico, ácido ascórbico, α-tocoferol, albúmina, vitaminas A, C y E) (Atig et al., 2013; Smith et al. 1996; Tremellen, 2008; Zini et al., 2011). Durante la capacitación de la muestra seminal para la posterior inseminación, se retira el plasma seminal, aspecto que suele provocar una mayor susceptibilidad de las células para ser oxidadas, ya que las moléculas antioxidantes presentes en el plasma son retiradas junto con el plasma seminal después de la capacitación (Kothari et al., 2010; Smith et. al, 1996).
La técnica del OxiSperm puede ser relevante para analizar correctamente aquellas muestras que presenten un grado de estrés oxidativo moderado/alto, en cuanto a la elección de la técnica y el tiempo que se tarda en procesarla. Este aspecto debe ser considerado en aquellas muestras con un elevado grado de oxidación; además es aconsejable la utilización de muestra en fresco. El test no se recomienda realizar en muestras de semen congelado, ya que la criopreservación espermática puede inducir un incremento en los niveles de estrés oxidativo modificando así el resultado del análisis. El mismo proceso de congelación/descongelación provoca muerte celular disminuyendo la calidad espermática. Dado que los espermatozoides (mayoritariamente los más inmaduros) son los principales productores de estrés oxidativo en muestras no leucocitospérmicas, (en condiciones normales se estima una producción de ion superóxido equivalente al 5% del oxígeno consumido), si mueren por el proceso de la criopreservación obtendremos como consecuencia una medida sesgada del estrés oxidativo.
Se ha observado que las muestras capacitadas por gradientes de densidad presentan niveles de oxidación más elevados que las capacitadas por Swim-up. Esto podría ser debido a la ausencia total de plasma seminal que ejercería un papel protector contra el estrés oxidativo (Tremellen, 2008).
Asimismo, las terapias y dietas ricas o enriquecidas con antioxidantes parecen prevenir o al menos disminuir el deterioro funcional espermático originado por un exceso de estrés oxidativo. Hay numerosos estudios que avalan el uso de antioxidantes en pacientes con infertilidad masculina, demostrando la mejoría en diferentes parámetros seminales e incluso en la tasa de embarazos (López et al., 2011; Ross et al., 2010; Showell et al., 2011). Los antioxidantes más empleados para el tratamiento de la infertilidad masculina son: L-carnitina, coenzima Q10, zinc, selenio, ácido docosahexaenoico (DHA), ácido fólico, acetil-cisteína, aspartato, y vitaminas B, C y E. Esperamos en un futuro próximo poder aportar más información acerca del valor pronóstico del test OxiSperm y poder evaluar el nivel de estrés oxidativo.
Agradecimientos
Agradecemos a la Dra. Mercè Durfort del Departamento de Biología Celular de la Facultad de Biología en la Universidad de Barcelona, por su revisión del manuscrito. A Jennifer Pérez Carrasco de la Universidad de Barcelona por su colaboración con la estadística y sus sugerencias para el desarrollo del manuscrito.
Referencias
Aktan G, Doğru-Abbasoğlu S, Küçükgergin C, Kadıoğlu A, Ozdemirler-Erata G, Koçak-Toker N. (2013). Mystery of idiopathic male infertility: is oxidative stress an actual risk. Fertil Steril; 99(5):1211-1215.
Atig F, Kerkeni A, Saad A, Ajina M. (2013). Effects of reduced seminal enzymatic antioxidants on sperm DNA fragmentation and semen quality of Tunisian infertile men. J Assist Reprod Genet; [Epub ahead of print] PubMed PMID: 23354588.
Cambi M, Tamburrino L, Marchiani S, Olivito B, Azzari C, Forti G, et al. (2013). Development of a specific method to evaluate 8-hydroxy, 2-deoxyguanosine in sperm nuclei: relationship with semen quality in a cohort of 94 subjects. Reprod; 145:227–235.
Doshi SB, Khullar K, Sharma RK, Agarwal A. (2012). Role of reactive nitrogen species in male infertility. Reprod Biol Endocrinol; 10:109.
Jackson LW, Schistermann EF, Dey-Rao R, Browne R and Armstrong D. (2005). Oxidative stress and endometriosis. Hum Reprod; 20(7):2014-2020.
Kothari S, Thompson A, Agarwal A, Plessis SS. (2010). Free radicals: Their beneficial and detrimental effects on sperm function. Indian J Exp Biol; 48(5):425-435.
Lewis SE & Simon L. (2010). Clinical implications of sperm DNA damage. Hum Fertil; 13(4):201–207.
López G, Lafuente R, Checa MA, Monqaut A y Brassesco M. (2011). Efecto del tratamiento con vitaminas, L-carnitina y coenzima Q10 en el índice de vacuolización y la fragmentación espermática en pacientes de fecundación in vitro. Rev Int Androl.;9(4):154-159.
Mitchell LA, De Iuliis GN and John AR. (2011). The TUNEL assay consistently underestimates DNA damage in human spermatozoa and is influenced by DNA compaction and cell vitality: development of an improved methodology. Int J Androl ; 34(1):2-13.
Pérez E. (2007). Atención integral de la infertilidad: endocrinología, cirugía y reproducción asistida, 2n edición, México D. F.: McGraw Hill/Interamericana.
Robinson L, Gallos ID, Conner SJ, Rajkhowa M, Miller D, Lewis S, et al. (2012). The effect of sperm DNA fragmentation on miscarriage rates: a systematic review and meta-analysis. Hum Reprod; 27(10):2908-2917.
Ross C, Morriss A, Khairy M, Khalaf Y, Braude P, Coomarasamy A, et al. (2010). A systematic review of the effect of oral antioxidants on male infertility. Reprod Biomed Online; 20(6): 711-723.
Showell MG, Brown J, Yazdani A, Stankiewicz MT, Hart RJ. (2011). Antioxidants for male subfertility. Cochrane Database of Systematic Reviews, Issue 1. Art. No.: CD007411. DOI: 10.1002/14651858.CD007411.pub2.
Smith R, Vantman D, Ponce J, Escobar J and Lissi E. (1996). Total antioxidant capacity of human seminal plasma. Hum Reprod; 11(8):1655-1660.
Tremellen K. (2008). Oxidative stress and male infertility, a clinical perspective. Hum Reprod Update; 14(3):243-258.
Van der Zwalmen P, Hiemer A, Rubner P, Bach M, Neyer A, Stecher A, et al. (2008). Blastocyst development after sperm selection at high magnification is associated with size and number of nuclear vacuoles. Reprod Biomed online; 17(5):617–627.
Venkatesh S, Shamsi MB, Deka D, Saxena V, Kumar R & Dada R. (2011). Clinical implications of oxidative stress & sperm DNA damage in normozoospermic infertile men. Indian J Med Res; 134:396-398.
World Health Organization (2010). WHO laboratory manual for the Examination and processing of human semen, 5th edition.
Zini A and Agarwal A. (2011). Sperm Chromatin: Biological and Clinical Application in Male Infertility and Assisted Reproduction, 1st edition, New York: Springer Science.
Zini A and Sigman M. (2009). Are Tests of Sperm DNA Damage Review Clinically Useful? Pros and Cons. J Androl; 30(3):219-229.