CAMBIOS DE EXPRESIÓN DEL RECEPTOR DE ANDRÓGENOS EN RELACIÓN CON LA SUBFERTILIDAD DEL VARÓN
Elia Dina Galo1, Pilar González-Peramato2, Roald Gómez-Pérez3, Manuel Nistal4, Javier Regadera5
1Departamento de Morfología Universidad Nacional Autónoma de Nicaragua-León. 2Servicio de Anatomía Patológica. Hospital Universitario de Guadalajara. Universidad de Alcalá. 3Unidad de Endocrinología, Hospital Universitario de Los Andes, Mérida, Venezuela. 4Departamento de Anatomía Patológica. Hospital Universitario La Paz. Madrid. 5Departamento de Anatomía, Histología y Neurociencia, Facultad de Medicina. Universidad Autónoma de Madrid.
Resumen: La producción de testosterona en los humanos se inicia alrededor de las semanas 8a y 9a de gestación. Este es un evento crucial para el desarrollo sexual primario en un embrión 46,XY (masculinización), y para el normal desarrollo sexual secundario en la pubertad (virilización). La testosterona además es esencial para mantener los caracteres sexuales secundarios en la vida adulta y para iniciar y preservar la espermatogénesis. Las acciones de los andrógenos se cumplen por medio del receptor de andrógenos (RA). La unión de los andrógenos a su receptor induce un cambio estructural en el RA, convirtiéndolo de un estado inactivo a su forma activa. En el testículo humano la inmunoexpresión del RA se ha detectado exclusivamente en el núcleo de células de Sertoli, en las células de Leydig y en las células mioides peritubulares. La función de estas células está estrechamente relacionada a la concentración y expresión del RA. Mutaciones en el RA ocasionan alteraciones en la acción de los andrógenos, afectando la función endocrina a nivel testicular y de otros órganos diana, comprometiendo además la función reproductiva. El significado de la expresión del RA en la patología testicular funcional congénita y adquirida del testículo humano no está aún bien establecido. En la presente revisión se evalúan los diferentes patrones de expresión inmunohistoquímica del RA reportados en el testículo de hombres normales y en pacientes con patología testicular, y se valora el significado funcional de las alteraciones histológicas y moleculares del RA en relación con la disfunción de la fertilidad en estos pacientes.
Palabras clave: Receptor de andrógenos. Testículo, Infertilidad.
FUNCTION OF ANDROGEN RECEPTOR, IMMUNOEXPRESSION IN NORMAL AND INFERTIL MEN
Abstract: Testosterone production begins at weeks 8 to 9 of gestation in the human. It is a critical event for primary male sexual development in a 46,XY embryo (masculinization), and for normal secondary sexual development at puberty (virilization). Testosterone also is essential to maintain the secondary sexual characters during adulthood, and for the initiation and preservation of spermatogenesis. The androgen actions are mediated by the androgen receptor (AR). Upon binding of androgens to its receptor, the AR undergoes a conformational change that converts it from an inactive state to its active DNA-binding state. In the human testis, the AR immunoexpression has been detected exclusively in the Sertoli cells nuclei, in the Leydig cells, and in the peritubular myoid cells. These cells function have a strong relation with the AR concentration and expression. Mutations of the AR results in alteration of androgens actions, affecting the endocrine function at the testicular level and in other target organs, affecting also the reproductive function. The meaningful of the AR expression in the congenital and acquired functional testicular pathology, has not been established yet. In this review different immunohistochemical expression patterns of the AR, reported in the testis from normal men, and from patients with testicular pathology are evaluated; also the functional significance from the histological and molecular alterations of the AR are evaluated, in relation with the fertility dysfunction of these patients.
Key words: Androgen receptor, Testis, Infertility.
INTRODUCCIÓN
Los andrógenos son hormonas esteroideas importantes para el desarrollo fenotípico masculino; tienen un papel muy importante durante la diferenciación masculina, el desarrollo y mantenimiento de los caracteres sexuales secundarios. Los andrógenos son imprescindibles para la iniciación y mantenimiento de la espermatogénesis. Las acciones de los andrógenos están mediadas por el receptor de andrógenos (RA) (Brinkmann, 2001). En el testículo humano, la inmunoexpresión del RA se observa en las células de Sertoli, células mioides peritubulares, células de Leydig, y células periarteriolares; pero no existe inmunomarcaje para el RA en los diferentes tipos de células germinales (Van Roijen et al., 1995; Suárez-Quian et al., 1999). El RA de los núcleos de las células de Sertoli participa activamente en los mecanismos de regulación paracrina entre la espermatogénesis y la esteroidogénesis (Vornberg et al., 1994; van Roijen et al., 1995; Zhou et al., 1996).
Recientemente, el estudio del RA ha adquirido singular importancia, sobre todo en pacientes con cáncer de próstata, ya que se han detectado algunas mutaciones en una proporción pequeña de estos pacientes (Newmark et al., 1992; Gaddipati et al., 1994). Sin embargo, niveles de inmunoexpresión de proteínas del RA son similares en tumores prostáticos dependientes de andrógenos (Bonaccorsi et al., 2003; Denmeade et al., 2003), además, algunos genes que regulan el RA se expresan anómalamente en el cáncer de próstata (Denmeade et al., 2003), lo que sugiere que el RA puede participar en el crecimiento del cáncer de próstata en la ausencia de andrógenos testiculares (Gaddipati et al., 1994; Bonaccorsi et al., 2003; Denmeade et al., 2003).
Mutaciones del RA también se han asociado con defectos en la virilización. En este sentido, diferentes tipos de mutaciones se han detectado en el gen del RA en individuos con síndrome de insensibilidad a los andrógenos (Brinkmann, 2001; Quingley 1995) (Androgen Insensitivity Síndrome, AIS). Sin embargo, el significado de la expresión del RA en la patología testicular funcional congénita y adquirida del testículo humano no esta aún bien establecido.
En la presente revisión se evalúan los diferentes patrones de expresión inmunohistoquímica del RA reportados en el testículo de hombres normales y en pacientes con patología testicular, y se valora el significado funcional de las alteraciones histológicas y moleculares del RA en relación con la disfunción de la fertilidad en estos pacientes.
BIOLOGÍA MOLECULAR DEL RA
El RA pertenece a una subfamilia de la gran familia de factores de transcripción nuclear que incluyen el receptor de estrógenos (RE alfa y RE beta), el receptor de hormonas tiroideas (RT), el receptor de la vitamina D y el receptor del ácido retinoico (Quingley 1995). La unión de los andrógenos a su receptor induce un cambio estructural en el RA que convierte al receptor de un estado inactivo a su forma activa, favoreciendo su unión al ADN (Grino, Griffin & Wilson,1987). Por analogía con otras hormonas esteroideas, la unión de la hormona al receptor -ésto es de los andrógenos al RA- ocasiona cambios de varias proteínas asociadas al receptor, como la proteína de shock térmico de 90 Kda (Housley et al., 1990). Hay evidencia que la unión de los andrógenos a su receptor es importante para mantener los niveles del RA, ya que esta unión produce una estabilización protectora del receptor que impide su degradación (Kemppainen et al., 1992).
El gen para la síntesis del RA fue secuenciado en el brazo largo del cromosoma X (Xq 11-12) (Brown et al., 1989). El sexo masculino solo tiene una copia del gen, el cual esta constituido por 8 exones y codifica a una proteína con una longitud de 910 a 919 aminoácidos (Lubahn et al., 1989). El exon 1 es el más largo (1.613 pares de bases) y codifica la porción amino terminal de la proteína. La función de esta porción del receptor es iniciar la trascripción génica. Los exones 2 y 3 codifican el dominio de unión al ADN, estructuralmente constituyen los dos dedos de zinc. Las mutaciones en esta región condicionan un RA no funcional, debido a su incapacidad para la unión al ADN y por ende el no inicio de la actividad de trascripción génica. Los exones del 5 al 8 codifican la porción del receptor requerida para la unión de los andrógenos al receptor, en este dominio es donde se han detectado el mayor número de mutaciones en el RA (Quigley et al., 1995). Las mutaciones en esta región pueden alterar la afinidad para la unión de los andrógenos y/o la especificidad de unión (Wiener et al, 1997). Aproximadamente el 20% de todas las mutaciones del gen del RA ocurren en los codones con residuos de arginina (Quigley et al., 1995).
Junto al extremo 5’ del exon 1, en el dominio amino terminal, se encuentra una región repetida de la tripleta CAG, variable en extensión, con un promedio de 9-38 repeticiones en la población normal. Esta región repetida dentro del gen constituye un polimorfismo, dado que existe variabilidad alélica. Se ha observado que la expansión de la tripleta CAG (repeticiones) está asociada con una leve modulación de la actividad del receptor androgénico. En la atrofia muscular espino bulbar (enfermedad de Kennedy) la repetición de la tripleta CAG se ha encontrado expandida en la mayoría de los pacientes y varía entre 38 y 75 unidades de repetición (Nance, 1997).
DETECCIÓN INMUNOHISTOQUÍMICA DEL RA
En el tracto reproductivo masculino, la inmunolocalización del RA ha sido observada constantemente en el núcleo de las siguientes células: 1) en el testículo: células de Sertoli, células de Leydig, células mioides peritubulares, epitelio de la rete testis y epitelio de los conductos rectos; 2) en el epidídimo: células ciliadas y principales de los conductos eferentes, en las células principales, basales y apicales del conducto epididimario; 3) en el conducto deferente: células oscuras y apicales estrechas; 4) en la próstata y vesículas germinales: células basales (de reserva) y principales (secretoras). El RA se ha observado también en todas las células musculares lisas, células endoteliales, y fibroblastos presentes en el testículo y en la vía espermática. El RA se expresa, aunque en grado variable, en una amplia variedad de tejidos, incluyendo glándulas sudoríparas, folículos pilosos, músculo cardíaco, células musculares lisas gastrointestinales, células foliculares de la tiroides, y células de la corteza adrenal (van Roijen et al., 1995; Suárez-Quina et al., 1999; Quingley et al., 1995; Sar et al., 1990; Regadera et al, 2001; Janssen et al., 1994). Solo se han inmunolocalizado vestigios del RA en el núcleo de las células del músculo liso vasculares (van Roijen et al., 1995; Iwamura et al., 1994; Skinner, 1991). La inmunocoloración del RA citoplasmática no se ha observado en estructuras testiculares humanas (Regadera et al., 2001).
EXPRESIÓN DEL RA EN EL TESTÍCULO NORMAL HUMANO
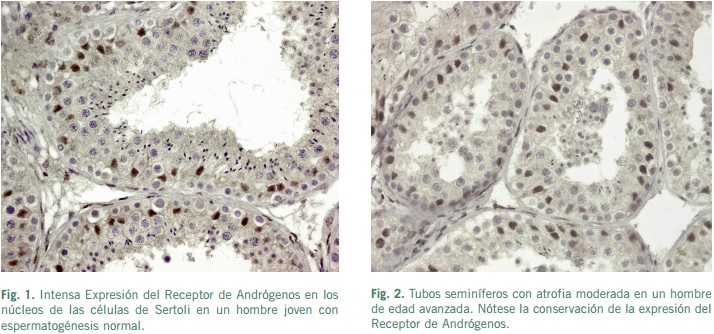
La intensidad de la inmunocoloración del RA es más fuerte en el núcleo de las células de Sertoli que en el núcleo de las células peritubulares, aunque en estas últimas la inmunotinción positiva parece ser más constante que en la célula de Sertoli (Regadera et al., 2001). En un estudio preliminar usando pequeñas biopsias testiculares humanas, no se observaron cambios en la inmunoexpresión del RA de las células de Sertoli en relación con los diferentes estadios de la maduración de la espermatogénesis (van Roijen et al., 1995). Sin embargo, recientemente en un estudio mucho más amplio empleando piezas completas de testículo humano, obtenidas quirúrgicamente en pacientes con cáncer de próstata, o durante la autopsia, se han demostrado cambios en la intensidad de la inmunocoloración del RA de células de Sertoli humanas. Estos hallazgos sugieren que la función del epitelio seminífero muy probablemente se relacione directamente con la intensidad de la tinción nuclear del RA. Además, existen ciertas evidencias acerca de que la secreción de determinadas proteínas de la célula de Sertoli humana que controlan la función del ciclo del epitelio seminífero están reguladas por el RA (SuárezQuian et al., 1999). Estos hallazgos son consistentes con la hipótesis que sugiere que la regulación de andrógenos en la espermatogénesis ocurre exclusivamente a través de las células de Sertoli -células somáticas testiculares-, ya que no se ha demostrado inmunohistoquímicamente la expresión de RA en las células germinales (Suárez-Quian et al., 1999).
Las células mioides peritubulares participan, en parte, en la regulación androgénica de la espermatogénesis a través de un mecanismo paracrino (Skinner, 1991), mediante la estimulación del RA, constantemente presente en el núcleo de las células mioides. Paradójicamente, las células de Leydig de testículos humanos exhiben una inmunolocalización de RA de intensidad tenue, y asimismo, un número apreciable de estas células intersticiales parecen ser negativas para RA (Regadera et al., 2001).
ALTERACIONES DE LA EXPRESIÓN DEL RA EN PATOLOGÍA TESTICULAR
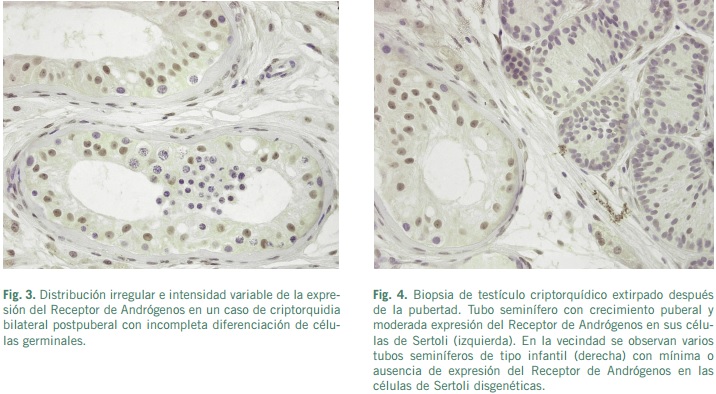
Algunas mutaciones del RA se pueden encontrar en casos con criptorquidia bilateral asociadas a AIS. Sin embargo, la relación criptorquidia unilateral con las alteraciones del RA constituyen en la actualidad motivo de controversia, debido a que mutaciones del gen de RA no son observadas en la mayoría de los pacientes con criptorquidia unilateral (Wienner et al., 1998). En un estudio reciente se ha encontrado que el 63% de los pacientes con testículos localizados en el escroto tenían niveles altos del RA, mientras que el 85% de los pacientes con “mal descenso” testicular los niveles de RA estaban disminuidos y además en los pacientes con testículos intraabdominales los RA eran muy bajos (Hosie, Wessel and Waag, 1999). Sin embargo, otros autores en pacientes con criptorquidia unilateral no encontraron anomalías del gen de RA, por lo que no lo consideran como responsable directo del desarrollo de una criptorquidia aislada (Wienner et al., 1998).
En los testículos criptorquídicos estudiados después de la pubertad, las células de Sertoli tipo adultas mostraban una inmunotinción para el RA de intensidad moderada. En contraste, la intensidad del inmunomarcaje del RA fue menor en células de Sertoli inmaduras y disgenéticas (Regadera et al., 2001). Estos hallazgos pudieran sugerir que los segmentos del tubo seminífero con atrofia de células germinales muestran una disminución o ausencia de la expresión del RA en las células de Sertoli disgenéticas (Regadera et al., 2001).
En el AIS, las mutaciones del gen para el RA condicionan diferentes manifestaciones clínicas (Quigley et al., 1995). El AIS sigue un patrón de herencia ligado al cromosoma X, por cada madre portadora, hay 1:2 niños con cariotipo 46 XY que está afectado y 1:2 niñas portadoras. La incidencia de este síndrome es de 1:20.400 recién nacidos (Bangsboll et al., 1992). En la mayoría de los pacientes con AIS, los testículos se encuentran alojados en la cavidad abdominal y menos frecuentemente en el conducto inguinal (Barthold et al., 2000); además, en la infancia el AIS suele descubrirse durante la exploración de una hernia inguinal (Bnagsboll et al., 1992). En pacientes postpuberales y fenotípicamente niñas la causa más frecuente de consulta es la amenorrea primaria. Adicionalmente, en algunos individuos con AIS y criptorquidia, la persistencia parcial del conducto de Müller revela una relación estrecha entre la actividad del RA y la acción de la hormona antimülleriana (AMH). El efecto de la AMH en mediar la regresión del conducto de Müller puede requerir interacción sinérgica con el RA (Quigley et al., 1995).
La mayoría de los cariotipos de estos pacientes son 46,XY, aunque también se han publicado casos de mosaicismo cromosómico (Griffin and Wilson, 1980). Mutaciones en el gen del RA que afectan al desarrollo del fenotipo masculino se expresan en individuos con carga cromosómica 46 XY (Brinkmann, 2001; Quigley et al., 1995). Se han realizado revisiones amplias de la biología molecular del AIS y, aunque en los pacientes con AIS se han descrito mas de 150 mutaciones diferentes (Brinkmann, 2001), son cuatro los tipos fundamentales de mutaciones del RA: 1) mutación puntual sencilla consistente en la sustitución de un solo aminoácido o en un prematuro paro de la expresión de su codón; 2) inserción o deleción de nucleótidos; 3) una deleción completa o parcial del gen, y 4) mutación intrónica que afecta a la secuenciación del ARN del receptor de andrógenos (Brinkmann, 2001).
Se han descrito dos formas clínicas de AIS: síndrome de sensibilidad a los andrógenos completo (CAIS) y el síndrome de insensibilidad a los andrógenos incompleto (IAIS) (Brinkmann, 2001; Quigley et al., 1995).
En el CAIS, el fenotipo característico consiste en la presencia de genitales externos femeninos, una vagina corta y frecuentemente hendida, ausencia o hipoplasia de estructuras derivadas del conducto mülleriano (útero y trompas) y del conducto de Wolf (vía espermática), ausencia de próstata, desarrollo de tejido mamario y ausencia de pelos axilares y pubianos (Brinkmann, 2001). El estudio histológico de las gónadas de estos pacientes con CAIS demuestran cambios semejantes en testículos criptorquídicos, aunque en algunos casos las lesiones suelen ser menores (Álvarez-Nava et al., 1997). Sin embargo, los cambios histológicos en el testículo extirpado de pacientes adultos con AIS es similar al de algunas criptorquidias aunque también pueden semejar testículo inmaduro e incluso testículo infantil normal (Morris and Mahesh, 1963; Nistal and Paniagua, 1996). Los adenomas de células de Sertoli son frecuentes en los testículos de estos pacientes, aunque se consideraron en publicaciones clásicas algunas diferencias histológicas testiculares entre las formas completa e incompleta de AIS (Teter and Boczkowski, 1966; Damjanov, Drobnjak and Grizelj, 1971), trabajos posteriores de amplias series de pacientes concluyeron que no existían diferencias histológicas relevantes en los testículos entre los dos tipos de AIS (Rutgers and Scully, 1991). En los pacientes con CAIS, los niveles de testosterona basal y después de la estimulación con HCG (GalliTsinopoulou et al., 2003) están elevados en la edad puberal (Brinkmann, 2001); mientras que, los niveles basales de gonadotropinas pueden ser normales (Galli-Tsinopoulou et al, 2003) aunque también pueden encontrarse niveles elevados de la LH (GalliTsinopoulou et al., 2003). Los niveles séricos de testosterona estuvieron ligeramente disminuidos en los pacientes adultos y ligeramente elevados en los pacientes prepuberales. El nivel de estradiol sérico estuvo ligeramente aumentado en todos los pacientes (Regadera et al., 1999).
Histopatológicamente, en los pacientes adultos con AIS se ha encontrado una disminución del volumen testicular y una alternancia de áreas modulares con áreas difusas. El diámetro tubular estaba significativamente disminuido y la densidad del volumen de los túbulos seminíferos estaba aún más reducida (Jockenhovel et al., 1993). Característicamente, en los testículos de los pacientes con AIS no se encontraron células germinales ni tampoco células de carcinoma in situ.
En el IAIS, los cambios fenotípicos son muy diversos, aunque en la mayoría de estos pacientes predomina la apariencia femenina con genitales ambiguos, mientras que en otros casos existe un predominio del fenotipo masculino y cuando llega la pubertad a estos pacientes se produce también una elevación de los niveles séricos de testosterona, LH y estradiol (Brinkmann, 2001). Por otro lado, existe una variante clínica peculiar de AIS denominada enfermedad de Kennedy en la que se asocia alteraciones del desarrollo neurológico -caracterizadas por atrofia bulbar y espinal asociada a atrofia muscular- y anomalías cuantitativas del RA que se relacionan con la severidad de los síntomas del AIS (MacLean HE, 1995). En todos estos casos de síndrome de Kennedy existe una correlación entre la longitud repetida de CAG y el desarrollo temprano de enfermedad neurológica, por lo que se demuestra que esta enfermedad tiene una relación directa con alteración de la secuencia del RA (Dejager et al., 2002). Por último, se ha descrito todo un espectro de individuos con síntomas intermedios de AIS en los que el diagnóstico se descubre en la evaluación de una infertilidad de causa desconocida (Brinkmann, 2001). Dentro de estas variantes clínicas cabe destacar varios estudios de pacientes con hipospadias severas y criptorquidia bilateral en los que puede existir alteraciones del RA (Holmes, Miller & Baskin, 2004), incluidas la mutación puntual en el exón 8 (Hiort et al., 1994). Sin embargo, en la mayoría de los casos de hipospadia no se centraron en mutaciones específicas, por lo que es necesario establecer criterios genéticos que permitan clasificar y tratar correctamente estos casos (Hiort et al., 1994). Todo este espectro de enfermedades permiten concluir que las variaciones fenotípicas en los defectos moderados del RA pudieran no detectarse en individuos adultos con AIS durante la exploración clínica (Galli-Tsinopoulou et al., 2003). Pero los datos aún no son claros, ya que numerosos estudios han demostrados una considerable heterogeneidad en la expresión del RA, dependiendo de si se trata de pacientes con CAIS o con IAIS; esta diferente inmunoexpresión también ocurre cuando se estudian biopsias de cáncer de próstata y en biopsias testiculares (Ávila, Zoppi and McPhaul, 2001). En los pacientes con IAIS, el estudio de la secuenciación directa de los exones que codifican el gen de RA generalmente no revelan anomalías de este gen (Isurugi et al., 1996). Es más, defectos parciales en la función del RA están causados por sustituciones de aminoácidos del dominio hormonal activo del RA en la cadena del ADN. Estos defectos parciales funcionales del gen del RA pueden determinar claramente cambios funcionales pero también alteraciones cuantitativas en la abundancia del receptor (Ávila, Zoppi and McPhaul, 2001). De hecho, mutaciones en el gen del RA son las causas de alteraciones de la función del receptor, por lo que mutaciones diversas pueden asociarse con signos clínicos heterogéneos de AIS (Hiort et al., 1994; Brown, 1995).
En pacientes subfértiles con oligozoospermia y niveles de gonadotropinas séricas normales, la intensidad de la inmunoexpresión del RA variaba sustancialmente entre las biopsias de los diferentes pacientes (van Roijen et al., 1995), no encontrándose una correlación entre la intensidad de la inmunoexpresión del RA en las células de Sertoli y en células mioides con respecto al grado de maduración de la espermatogénesis. Además, los niveles de inmunoexpresión del RA en las células de Sertoli y las células mioides peritubulares no están regulados directamente por los niveles séricos de gonadotropinas. Estos resultados indican que la inmunodetección del RA no se relaciona con la calidad del epitelio espermático en pacientes con oligozoospermia (van Roijen et al., 1995; Singh et al., 2006). Asimismo, en otro estudio no se han encontrado cambios evidentes de inmunoexpresión del RA como un marcador de función testicular o con el grado de hipospermatogénesis, ni tampoco con el grado de diferenciación de las células de Sertoli (Saunders et al., 1996; Jarow and Zirkin, 2005; Aiman and Griffin, 1982). Pero los datos aún no son concluyentes ya que otros autores han medido la inmunoexpresión del RA en fibroblastos de piel genital, observando que la resistencia a los andrógenos puede ser la causa de una fracción importante (40% o más) de infertilidad idiopática, debida a azoospermia o severa oligozoospermia (Saunders et al., 1996); por lo que en la actualidad se están diseñando modelos de ratones con mutaciones CAG del RA con el fin de evaluar el grado de diferenciación de las células de Sertoli en relación a alteraciones de la espermatogénesis (Yu et al., 2006).
CONCLUSIONES
El RA pertenece a la superfamilia de receptores intranucleares, cuya respuesta final se lleva a cabo a través de su unión con el ADN. Está estrechamente relacionado con la diferenciación sexual del varón. La activación normal del RA permite un buen desarrollo y diferenciación de los órganos internos y externos masculinos.
En el testículo del hombre adulto, la inmunoexpresión del RA es detectada exclusivamente en el núcleo de células de Sertoli, células de Leydig y células mioides peritubulares. La función de estas células está estrechamente relacionada a la concentración y expresión del RA. La inmunolocalización del RA citoplasmática no se ha observado en estructuras testiculares humanas.
Mutaciones en el RA condicionan alteraciones en la acción de los andrógenos, afectando la función endocrina a nivel testicular y de otros órganos diana, comprometiendo además la función reproductiva. Algunas mutaciones del RA están implicadas en casos con testículos criptorquídicos. La relación de las alteraciones del RA con el desarrollo de un testículo no descendido unilateralmente es aún motivo de controversia, debido a que mutaciones del gen de RA no son observadas en la mayoría de los pacientes con criptorquidia unilateral. El AIS es la manifestación clínica más evidente de mutaciones en el RA. Las mutaciones más frecuentemente observadas consisten en lesiones puntuales en cambios de secuencias de aminoácidos, deleción de nucleótidos o deleción parcial o completa del gen. Su forma completa (CAIS) se presenta fenotípicamente como sexo femenino. En el AIS existe una considerable heterogeneidad en la expresión del RA que depende de la penetrancia de la mutación.
En hombres infértiles no se han encontrado cambios evidentes de inmunoexpresión del RA que lo conviertan en un marcador de función testicular, y todavía es prematuro en patología reproductiva humana predecir el grado de hipospermatogénesis o el grado de desdiferenciación de las células de Sertoli solo teniendo en cuenta las alteraciones de expresión génica e histopatológica del RA, dado que hasta la actualidad el grado de expresión del RA no se relaciona con las alteraciones de diferenciación del epitelio espermático presentes en los pacientes subfértiles.
Referencias
Aiman J, Griffin JE. The frequency of androgen receptor deficiency in infertile men. J Clin Endocrinol Metab, 1982; 54:725-32.
Álvarez-Nava F, González S, Soto M, Martínez C, Prieto M. Complete androgen insensitivity syndrome: clinical and anatomopathological findings in 23 patients. Genet Couns, 1997; 8:7-12.
Ávila DM, Zoppi S, McPhaul MJ. The androgen receptor (AR) in syndromes of androgen insensitivity and in prostate cancer. J Steroid Biochem Mol Biol, 2001; 76:135-42.
Bangsboll S, Qvist I, Lebech PE, Lewinsky M. Testicular feminization syndrome and associated gonadal tumors in Denmark. Acta Obstet Gynecol Scand, 1992; 71:63-6.
Barthold JS, Kumasi-Rivers K, Upadhyay J, Shekarriz B, ImperatoMcginley J. Testicular position in the androgen insensitivity syndrome: implications for the role of androgens in testicular descent. J Urol, 2000; 164:497-501.
Bonaccorsi L, Muratori M, Carloni V, Zecchi S, Formigli L, Forti G, Baldi E. Androgen receptor and prostate cancer invasion. Int J Androl, 2003; 26:21-5.
Brinkmann AO. Molecular basis of androgen insensitivity. Mol Cell Endocrinol, 2001; 179:105-9.
Brown CJ, Goss SJ, Lubahn DB, Joseph DR, Wilson EM, French FS, Willard HH. Androgen receptor locus on the human X chromosome: regional localization to Xq11-12 and description of a DNA polymorphism. Am J Hum Genet. 1989; 44:264-9.
Brown TR. Human androgen insensitivity syndrome. J Androl, 1995; 16:299-303.
Damjanov I, Drobnjak P, Grizelj V. Testicular Feminization with immature Leydig cells. An ultrastructural demonstration. Am J Obstet Gynecol, 1971; 110:594-6.
Dejager S, Bry-Gauillard H, Bruckert E, Eymard B, Salachas F, LeGuern E, Tardieu S, Chadarevian R, Giral P, Turpin G. A comprehensive endocrine description of Kennedy’s disease revealing androgen insensitivity linked to CAG repeat length. J Clin Endocrinol Metab, 2002; 87:3893-901.
Denmeade SR, Sokoll LJ, Dalrymple S, Rosen DM, Gady AM, Bruzek D, Ricklis RM, Isaacs JT. Dissociation between androgen responsiveness for malignant growth vs expression of prostate specific differentiation markers PSA, hK2, and PSMA in human prostate cancer models. Prostate, 2003; 54:249-57.
Gaddipati JP, McLeod DG, Heidenberg HB, Sesterhenn IA, Finger MJ, Moul JW, Srivastava S. Frequent detection of codon 877 mutation in the androgen receptor gene in advanced prostate cancers. Cancer Res, 1994; 54:2861-4.
Galli-Tsinopoulou A, Hiort O, Schuster T, Messer G, Kuhnle U. A novel point mutation in the hormone binding domain of the androgen receptor associated with partial and minimal androgen insensitivity syndrome. J Pediatr Endocrinol Metab, 2003; 16:149-54.
Griffin JE; Wilson JD. The syndromes of androgen resistance. New Engl J Med, 1980; 302:198-209.
Grino PB, Griffin JE, Wilson JD. Transformation of the androgen receptor to the deoxyribonucleic acid-binding state: studies in homogenates and intact cells. Endocrinology, 1987; 120:1914-20.
Hiort O, Klauber G, Cendron M, Sinnecker GH, Keim L, Schwinger E, Wolfe HJ, Yandell DW. Molecular characterization of the androgen receptor gene in boys with hypospadias. Eur J Pediatr, 1994; 153:317-21.
Holmes NM, Miller WL, Baskin LS. Lack of defects in androgen production in children with hypospadias. J Clin Endocrinol Metab, 2004;89:2811-6.
Hosie S, Wessel L, Waag KL. Could testicular descent in humans be promoted by direct androgen stimulation of the gubernaculum testis? Eur J Pediatr Surg, 1999; 9:37-41.
Housley PR, Sanchez ER, Danielsen M, Ringold GM, Pratt WB. Evidence that the conserved region in the steroid binding domain of the glucocorticoid receptor is required for both optimal binding of hsp90 and protection from proteolytic cleavage. A two-site model for hsp90 binding tothe steroid binding domain. J Biol Chem, 1990; 265:12778-81.
Isurugi K, Hasegawa F, Shibahara N, Mori H, Shima H, Harada N, Hasegawa T, Honma S, Imasaki K, Nawata H. Incomplete testicular feminization syndrome: studies on androgen receptor (AR) function, AR gene analysis, and aromatase activities at puberty and long-term observations of clinical and hormonal features from infancy to puberty.Endocr J, 1996; 43:557-640.
Iwamura M, Abrahamsson PA, Benning M, Cockett AT, di Sant´Agnese PA. Androgen receptor immunostaining and its tissue distribution in formalin-fixed, paraffinembedded sections after microwave treatment. J Histochem Cytochem,1994; 42:783-8.
Janssen P, Brinkman AO, Boersma WJ, van der Kwast Th. Immunohistochemical detection of the androgen receptor with monoclonal antibody F39.4 in routinely processed, paraffin-embedded human tissues after microwave pretreatment. J Histochem Cytochem,1994; 42:1169-75.
Jarow JP, Zirkin BR. The androgen microenvironment of the human testis and hormonal control of spermatogenesis. Ann Y Acad Sci, 2005; 1061:208-20.
Jockenhovel, Rutgers JK, Mason JS, Griffin JE, Swerdloff RS. Leydig cell neoplasia in a patient with Reifenstein syndrome. Exp Clin Endocrinol, 1993; 101:365-70.
Kemppainen JA, Lane MV, Sar M, Wilson EM. Androgen receptor phosphorylation, turnover, nuclear transport, and transcriptional activation. Specificity for steroids and antihormones. J Biol Chem, 1992; 267:968-74.
Lubahn DB, Brown TR, Simental JA, Higgs HN, Migeon CJ, Wilson EM, French FS. Sequence of the intron/exon junctions of the coding region of the human androgen receptor gene and identification of a point mutation in a family with complete androgen insensitivity. Proc Nat Acad Sci USA, 1989; 86:9534-8.
MacLean HE, Choi WT, Rekaris G, Warne GL, Zajac JD. Abnormal androgen receptor binding affinity in subjects with Kennedy’s disease (spinal and bulbar muscular atrophy). J Clin Endocrinol Metab, 1995; 80:508-16.
Morris JM, Mahesh VB. Further observations on the syndrome “Testicular Feminization”. Am J Obstet Gynecol, 1963; 87:731-48.
Nance MA. Clinical aspects of CAG repeat diseases. Brain Pathology, 1997; 7:881-900.
Newmark JR, Hardy DO, Tonb DC, Carter BS, Epstein JI, Isaacs WB, Brown TR, Barrack ER. Androgen receptor gene mutations in human prostate cancer. Proc Natl Acad Sci USA, 1992; 89:6319-23.
Nistal M, Paniagua R. Non-neoplastic diseases of the testis. In: Bostwick DG, Eble JN, eds. Urologic Surgical Pathology. St Louis: Mosby Inc; 1996: 496-5132.
Quigley CA, De Bellis A, Marschke KB, El-Awady MK, Wilson EM, French FS. Androgen receptor defects: historical, clinical, and molecular perspective. Endocrine Rev, 1995;16:271-321.
Regadera J, Martínez-García F, González-Peramato P, Serrano A, Nistal M, Suárez-Quian C. Androgen receptor expression in sertoli cells as a function of seminiferous tubule maturation in the human cryptorchid testis. J Clin Endocrinol Metab, 2001; 86:413-21.
Regadera J, Martínez-García F, Paniagua R, Nistal M. Androgen insensitivity syndrome. Arch Pathol Lab Med, 1999; 123:225-34.
Ruizeveld de Winter JA, Trapman J, Vermey M, Mulder E, Zegers ND, van der Kwast ThH. Androgen receptor expression in human tissues: an immunohistochemical study. J Histochem. Cytochem, 1991; 39:927-36.
Rutgers, JL; Scully, RE. The androgen insensitivity syndrome (testicular feminization): a clinocopathologic study of 43 cases. Int J Gynecol Pathol, 1991; 10:126-44.
Sar M, Lubahn DB, French FS, Wilson EM. Immunohistochemical localization of the androgen receptor in rat and human tissues. Endocrinology, 1990; 127:3180-6.
Saunders, PTK, Millar, MR, Madjdic G, Bremmer WT, McLaren TT, Grigor KM, Sharpe RM. Cellular and Molecular Regulation of Testicular Cells. In: C. Desjardins Ed. Proceedings of the XIIIth Testis Workshop on Cellular and Molecular Regulation of Testicular Cells sponsored Serono Symposia USA, New York: Springer; 1996: 213-220.
Singh R, Deepa SR, Madhave S, Gupta NJ, Chakravarty B, Singh L, Thangaraj K. Male infertility: no evidence of involvement of androgen receptor gene among Indian men. J Androl, 2006; 27:102-5.
Skinner MK. Cell-cell interactions in the testis. Endocr Rev, 1991; 12:45-77.
Suárez-Quian C, Martínez-García F, Nistal M, Regadera J. Androgen receptor distribution in adult human testis. J Clin Endocrinol Metab, 1999; 84:350-8.
Teter J, Boczkowski, K. Testicular feminization with and without clitoral enlargement. Am J Obstet Gynecol, 1966; 94:813-9.
Van Roijen JH, Van Assen S, vander Kwast Th H, de Rooij DG, Boersma W, Vreeburg J, Weber R. Androgen receptor immunoexpression in the testes of subfertile men. J Androl, 1995; 16:510-6.
Vornberger W, Prins G, Musto NA, Suárez-Quian C. Androgen receptor distribution in rat testis: new implications for androgen regulation of spermatogenesis. Endocrinology, 1994; 134:2307-16.
Wiener JS, Marcelli M. Gonzales ET Jr, Roth DR, Lamb DJ. Androgen receptor gene alterations are not associated with isolated cryptorchidism. J Urol, 1998; 160:863-5.
Wiener JS, Teague JL, Roth DR, Gonzales ET Jr, Lamb DJ. Molecular biology and function of the androgen receptor in genital development. J Urol, 1997; 157:1377-86.
Yu Z, Dadgar N, Albertelli, Scheller A, Albin RL, Robins DM, Lieberman AP. Abnormalities of germ cell maturation and Sertoli cell cytoskeleton in androgen receptor 113 CAG knock-in mice reveal toxic effects of the mutant protein. Am J Pathol, 2006; 168:195-204.
Zhou X, Kudo A, Kawakami H, Hirano H. Immunohistochemical localization of androgen receptor in mouse testicular germ cells during fetal and postnatal development.Anat Rec, 1996; 245:509-18.