CONTROL DE CALIDAD EXTERNO EN EL LABORATORIO DE REPRODUCCIÓN HUMANA ASISTIDA
Luis Martínez-Granados1, Ana Clavero1, María Carmen Gonzalvo1, María Serrano2, María Luisa López-Regalado1, Antonio González-Utor3, Nereyda Ortíz4, Vicente Badajoz5, Jose Antonio Castilla1,6,7
1 Unidad de reproducción. UGC laboratorio clínico, UGC Obstetricia y Ginecología, Hospital Universitario Virgen de las Nieves, Instituto de investigación biosanitaria de Granada (ibs.GRANADA), Granada, 2 Clínica IFEM, Córdoba, 3 Clínica MasVida reproducción, Sevilla, 4 Instituto Europeo de Fertilidad, Madrid, 5 Ginefiv, Madrid, 6CEIFER Biobanco, Granada, 7 Dpt. Anatomía y embriología humana. Facultad de Medicina. Universidad de Granada, Granada.
El laboratorio de reproducción humana asistida debe estar orientado a satisfacer las necesidades de sus usuarios mediante procesos de probada seguridad y eficiencia. Para ello es clave la implantación de sistemas de calidad y programas de control de calidad internos (CCInt) y control de calidad externos (CCExt).
Concretamente, los CCExt permiten conocer la exactitud en los procedimientos controlados, aumentar la eficiencia de estos y conocer la variabilidad en los procesos llevados a cabo por los distintos laboratorios, además de ser la base de la transferibilidad de resultados entre laboratorios.
Hoy en día, existen 3 procedimientos con programas de CCExt consolidados para el laboratorio de reproducción (análisis de semen, evaluación embrionaria y citotoxicidad). En estos programas, diferentes laboratorios analizan alícuotas de una misma muestra (tipo I).
En el futuro, sería conveniente la generalización de los programas existentes a más centros y el desarrollo e implantación de estos programas de CCExt en otros procedimientos que se llevan a cabo en el laboratorio de reproducción.
CONTROL DE CALIDAD EXTERNO
La variabilidad analítica es un fenómeno propio de los procesos de medida, que ocasiona que los resultados obtenidos al medir repetidamente una magnitud en un mismo espécimen puedan ser ligeramente diferentes entre sí (Haeckel, 1993). Este concepto, aplicado al manejo de gametos o al cultivo embrionario en el laboratorio de reproducción humana asistida (LRHA), es el que hace que los resultados obtenidos al analizar, procesar o crioconservar alícuotas de un mismo espécimen sean ligeramente diferentes entre sí. Todo esto nos obliga a realizar un conjunto de acciones internas o externas conocido como “control de la calidad”. Estas acciones deben estar planificadas, realizarse sistemáticamente y ser demostrables.
Los programas de control de calidad externos (CCExt) más conocidos en los laboratorios clínicos son los basados en la participación de diversos laboratorios que miden, con los mismos o diferentes procedimientos de medida, una o más magnitudes en los mismos materiales de control, y en el que los resultados obtenidos por un laboratorio son comparados con los resultados obtenidos por el resto de los laboratorios participantes o por expertos. Por tanto, permite conocer cómo están funcionando los procedimientos de un determinado laboratorio en relación con cómo funcionan en otros laboratorios o en relación a los resultados de expertos (Organización Mundial de la Salud, 2010). Por otra parte, los programas de CCExt constituyen la base de la transferibilidad de resultados entre laboratorios.
Además, en la norma UNE 179007, norma que especifica los requisitos para un sistema de gestión de la calidad para centros de reproducción humana asistida, recoge que “La organización debe participar en controles de calidad externos sobre preembriones y gametos y en Registros de Actividad Multicéntricos, con una periodicidad mínima anual”.
Los programas de CCExt suelen estar organizados por fabricantes de materiales de control, organismos oficiales u organizaciones científicas. La participación suele ser voluntaria, aunque en algunos países la ley obliga a los laboratorios a participar en programas de CCExt, y sus resultados pueden ser inspeccionados oficialmente.
Cada programa de CCExt establece el número de materiales de control, su frecuencia de distribución y los valores de las magnitudes cuyos procedimientos de medida se desea evaluar, dependiendo todo ello de la finalidad concreta para la que haya sido diseñado.
Debemos recordar en este punto que la manera de participar en los programas de CCExt según la Organización Mundial de la Salud (OMS) (2010) es mediante un miembro del personal de laboratorio que tenga un aceptable nivel en el programa de control de calidad interno (CCInt).
Además de las características generales sobre la estructura del programa de CCExt, los participantes reciben información sobre el origen de los materiales de control e instrucciones claras sobre su manipulación, estabilidad, condiciones de almacenamiento y fecha límite de entrega de los resultados (Thompson et al., 2006).
Para que un programa de CCExt sea fiable deben cumplirse los siguientes puntos (ISO 15189:2012; Thompson et al., 2006):
- Los distintos materiales de control de un mismo lote deben ser totalmente homogéneos entre sí y su estabilidad debe mantenerse a lo largo de todo el periodo de control.
- El número de laboratorios participantes debe ser el mayor posible y la diversidad de los métodos de medida de una misma magnitud también debe ser la mayor posible, con lo que la estimación de los valores consensuados, tanto por método como global, será fiable y permitirá la comparación entre laboratorios que utilizan el mismo método, y una buena estimación del error sistemático.
- Deben utilizarse materiales de control con diferentes valores de las magnitudes en estudio, intentando abarcar todo el intervalo de medición, o al menos, con valores cercanos a las decisiones clínicas.
Existen dos tipos principales de programas de CCExt analítica: tipo I y tipo II. Las diferencias principales entre ambos tipos son la frecuencia con que se realizan las mediciones en los materiales de control y el hecho de que los valores de esos materiales sean conocidos por los laboratorios participantes o no lo sean.
Tipo I: En estos programas se utilizan los resultados obtenidos de forma esporádica, aunque periódica, por los laboratorios participantes. Se utilizan diversos materiales de control cuyos valores no son conocidos por los laboratorios participantes. Durante los 6 ó 12 meses que suele durar cada ciclo de control, cada laboratorio mide en cada material de control con una cadencia quincenal, mensual o trimestral las magnitudes correspondientes a los procedimientos que se desea controlar y, finalmente, envía los resultados al organizador. Poco tiempo después, el organizador envía a cada laboratorio participante, para cada procedimiento de medida sometido a control, un informe en el que se comparan los resultados obtenidos por el participante con los obtenidos por los laboratorios que utilizan el mismo método de medida y con los obtenidos por todos los laboratorios participantes, sea cual sea el método con el que miden una misma magnitud. Finalizado el periodo de control, el organizador elabora un informe global en el que evalúa la calidad analítica obtenida por el participante para cada procedimiento y la compara con la obtenida por el resto de los laboratorios participantes. En algunos programas, en el informe correspondiente al final del periodo de control, se indica la clasificación basada en la imprecisión interdiaria y el error sistemático, de cada uno de los procedimientos utilizados por el participante en relación con el resto de los participantes (Ferré y Fuentes, 1998).
Tipo II: En estos programas se utilizan los resultados obtenidos cotidianamente en el CCInt. En estos programas, cuya duración suele ser de un año o más, los materiales de control pueden estar valorados o no, aunque si no lo están, cada laboratorio participante les asigna sus propios valores. Así pues, los materiales de control se usan cada vez que se realiza una serie de mediciones para controlar los resultados observados en los pacientes. Los resultados de control obtenidos en el CCInt se envían mensualmente al organizador del programa. A continuación, el organizador envía a cada laboratorio participante un informe en el que consta, para cada procedimiento de medida sometido a control, las medidas y los coeficientes de variación (imprecisión interdiaria) correspondientes a los resultados enviados el mes anterior y los enviados hasta el momento desde el inicio del periodo de control (datos acumulados), así como la media y la desviación típica correspondiente a los resultados de los laboratorios que utilizan el mismo método (valor consensual por método) y la media correspondiente a los resultados de todos los laboratorios, prescindiendo del método empleado (valor consensual global) (Ferré y Fuentes, 1998).
Los resultados obtenidos de un programa de CCExt nunca deben utilizarse como base para disminuir el error sistemático calculando un factor de corrección para aplicarlo a los resultados observados en las muestras de los pacientes, ya que los materiales de control, frecuentemente no se comportan igual que ellos, porque no son de origen humano, porque contienen sustancias conservantes o porque no son equiparables a los procedimientos habituales.
Valores aberrantes: A veces el resultado enviado por un participante es calificado de aberrante por el organizador. En estos casos debe comprobarse que no se ha cometido ninguna equivocación en la transcripción de los resultados, que se han efectuado correctamente los cálculos y que se ha utilizado el material de control adecuado.
Valores incoherentes: En los programas en que se miden dos materiales de control simultáneamente, puede no existir coherencia entre los dos resultados. En este caso, en primer lugar, se debe considerar un posible cruce de los dos materiales de control. Si no existe tal confusión, se debe consultar el diagrama de Youden (Ferré y Fuentes, 1998), que se suele incluir en estos programas, para deducir el tipo de error.
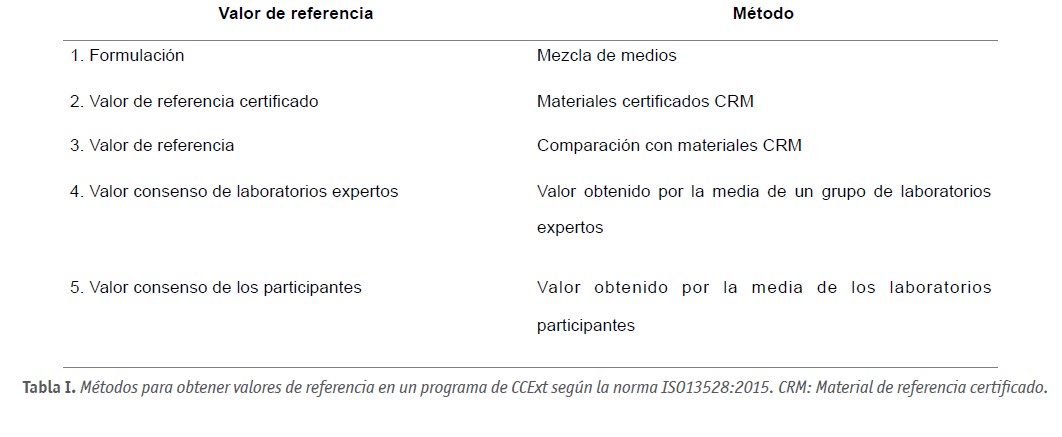
Un punto clave en los programas de CCExt es el establecimiento de los intervalos de aceptación de los resultados. La Organización Internacional para la Estandarización (ISO) propone cinco métodos para asignar valores de referencia (ISO13528:2015) (Tabla I).
PROGRAMAS DE CONTROL DE CALIDAD EXTERNO EN EL LABORATORIO DE REPRODUCCIÓN HUMANA ASISTIDA
Los esquemas de CCExt propuestos para el LRHA y más utilizados en diferentes países son: análisis de semen (concentración de espermatozoides, movilidad, vitalidad, morfología espermática y medición de anticuerpos antiespermatozoide), realización de bioensayos para detectar la toxicidad y las condiciones de cultivo subóptimas, y análisis de imágenes para la evaluación de la calidad y destino clínico de los embriones (Elder y Kastrop, 2003; De Jonge et al., 2003; Castilla et al., 2010). En la Tabla II se muestran otros ejemplos de CCExt en el laboratorio de reproducción humana asistida.
CONTROL DE CALIDAD EXTERNO DE ANÁLISIS DE SEMEN
La implantación de programas de CCExt de análisis de semen es amplia en muchos países, pues desde la tercera edición del manual de análisis de semen humano de la OMS (Organización Mundial de la Salud, 1992) hasta la última edición de este mismo manual, se insiste en la participación en estos programas y se facilita un listado de programas de este tipo, nacionales e internacionales (Organización Mundial de la Salud, 2010).
En España, tras una experiencia piloto con 18 laboratorios, se instauró en 1999 el primer programa de CCExt auspiciado por la Asociación para el Estudio de la Biología de la Reproducción (ASEBIR), dicho programa estuvo coordinado con el Comité de control de calidad del Grupo de Interés Especial en Andrología de la Sociedad Europea de Reproducción Humana y Embriología (ESHRE) y organizado por el laboratorio CEIFER de Granada. Actualmente el material de dicho programa es también distribuido al programa de CCExt de Asociación Española de Farmacéuticos Analistas y de la Asociación Española de Biopatología Médica y sus resultados procesados en conjunto (Castilla et al., 2005). El procesamiento de los resultados se realiza de forma anónima, introduciendo los datos por duplicado con verificación de estos en la aplicación informática encargada de su análisis estadístico. Todos los resultados se analizan por técnica y método utilizado, calculándose media, desviación estándar (DS), coeficiente de variación, máximo, mínimo y rango intercuartílico. Se descartan todos los valores que sean ± 3DS (Álvarez et al., 2005).
El valor de referencia utilizado es el valor obtenido por la media de laboratorios participantes.
Se han descrito diferencias entre programas de CCExt de análisis de semen (Cooper et al., 2002). Estas podrían estar debidos a los distintos métodos utilizados para definir los valores de referencia en cada programa de CCExt de análisis de semen (Palacios et al., 2002)
CONTROL DE CALIDAD EXTERNO DE EVALUACIÓN EMBRIONARIA.
La evaluación de la calidad embrionaria es clave en el laboratorio, ya que afecta a la decisión de cuántos y qué embriones transferir, lo cual está directamente relacionado con la eficacia de un ciclo de FIV/ICSI y con la probabilidad de embarazo múltiple.
En España entre 2003 y 2007 existía un programa nacional de CCExt de evaluación embrionaria, organizado por CEIFER y auspiciado por ASEBIR, donde los centros participantes debían catalogar embriones en tres categorías (bueno, regular o malo) y decidir el destino clínico de los embriones (transferir, crioconservar o descartar). El análisis de los resultados de estos años permitió demostrar las discrepancias existentes en evaluación embrionaria entre centros y un panel de expertos (Castilla et al., 2010). A partir de 2011, el programa pasa a ser organizado en su totalidad por ASEBIR y en 2012 se incorpora la clasificación estandarizada publicada por ASEBIR en 2008, pasando los laboratorios a analizar de forma individualizada distintos tipos de variables como número de células del embrión, porcentaje de fragmentación, vacuolización, nucleación y otras características que permiten categorizar al embrión mediante la clasificación embrionaria de ASEBIR (Ardoy et al., 2008). Los laboratorios, al igual que en la etapa inicial, deben tomar una decisión clínica (transferir, crioconservar o descartar) sobre cada embrión.
Nuestro grupo demostró, que la participación en este tipo de programas aumenta el grado de acuerdo entre laboratorios en la evaluación morfológica embrionaria (Castilla et al., 2010).
Tras cinco años de la incorporación, en 2012, de la catalogación estandarizada de ASEBIR al programa de CCExt de evaluación embrionaria, nuestro grupo ha demostrado que pese al alto grado de acuerdo existente entre laboratorios y expertos en la evaluación de embriones de buena calidad siguen existiendo discrepancias a la hora de catalogar los embriones de peor calidad (Martínez- Granados et al., 2018).
En un programa de CCExt para la evaluación de imágenes de embriones, las alternativas posibles para establecer el valor de referencia, dentro de las normas ISO 13528:2015, son los puntos 4 (valor consenso de laboratorios expertos) y 5 (valor consenso de los participantes) expuestos en la Tabla I.
Tanto Arce et al. (2006), que compara los resultados de la evaluación de tres laboratorios de expertos entre ellos y a su vez con los resultados de varios laboratorios locales, como Ruiz de Assin et al., (2009) que compara los resultados entre un grupo de laboratorios y un grupo de expertos, demostraron que la variabilidad entre expertos era inferior a la observada entre laboratorios. Se demostraba la importancia de utilizar valores verdaderos, basados en la opinión de expertos en lugar de basarse los valores de referencia en las opiniones mayoritarias de los centros participantes.
Actualmente, existen programas similares a los descritos para España, en Reino Unido, Estados Unidos y Suiza.
CONTROL DE CALIDAD EXTERNO DE EVALUACIÓN EMBRIONARIA CON EQUIPOS TIME-LAPSE
El Grupo de Interés de Calidad de ASEBIR llevó a cabo un ensayo piloto de un CCExt de este tipo en el año 2014.
Aunque los métodos time-lapse proporcionan una gran cantidad de información sobre el desarrollo del embrión, su análisis no está automatizado (Molder et al., 2015). Además, en cuanto a la medición de tiempos en los equipos time-lapse, sólo dos estudios han evaluado la variabilidad interobservador, reportando poca variabilidad a este respecto (Sundvall et al., 2013, Martínez-Granados et al., 2017). Actualmente, la mayoría de los estudios que buscan desarrollar algoritmos de clasificación usando equipos de time-lapse sólo tienen en cuenta el momento del desarrollo embrionario (Meseguer et al., 2011; Conaghan et al., 2013; VerMilyea et al., 2014; Basile et al., 2015; Milewski et al., 2015; Petersen et al., 2016). Sin embargo, estas plataformas también permiten evaluar embriones mediante la evaluación de características morfológicas clásicas, tales como aspecto de los pronúcleos, simetría, fragmentación y/o multinucleación (Gardner et al., 2016). Ahlstrom et al. (2016) demostraron que esta estrategia es clínicamente más útil que un método de selección de embriones en el que sólo se analicen los tiempos del desarrollo. Otros autores, utilizando diversas estrategias, han incorporado las características morfológicas clásicas a los algoritmos basados en morfocinética (Conaghan et al., 2013; Diamond et al., 2015; Liu et al., 2016).
Sin embargo, según Lundin y Ahlstrom (2015), el hecho de que los eventos del desarrollo embrionario puedan ser definidos en diferentes momentos (inicial, medio o final), podría dificultar la comparación de los resultados obtenidos por diferentes laboratorios. Nuestros resultados, tras analizar los datos del ensayo piloto de CCExt de evaluación morfológica embrionaria (EME) mediante time-lapse, parecen confirmar esta hipótesis, observándose un pico de variabilidad entre laboratorios al analizar eventos que tardan más tiempo en producirse como la aparición de los pronúcleos o la compactación. Por el contrario, en eventos que se producen casi instantáneamente, como la división celular o la desaparición de los pronúcleos, la variabilidad observada entre laboratorios fue significativamente menor (Martínez- Granados et al., 2018).
Tras comparar los resultados del ensayo piloto de EME mediante time-lapse con los obtenidos en el programa de CCExt de evaluación morfológica embrionaria clásica (EMEC), no se observó una disminución en la variabilidad entre laboratorios usuarios de equipos time-lapse frente a los usuarios de EMEC, en la evaluación de ninguna característica morfológica ni en clasificación de embriones según los criterios ASEBIR (Martínez-Granados et al., 2018). Este resultado es contrario a lo que habría cabido esperar de una menor variabilidad en usuarios de equipos time-lapse, y podría deberse en parte, a que muchas características morfológicas embrionaria son transitorias y los criterios para evaluar dichas características no están bien definidos actualmente para los equipos time-lapse (Hardarson et al., 2002; Chávez et al., 2012).
A nivel internacional sólo la External Quality Assurance Schemes for Reproductive Medicine propone un CCExt para equipos time-lapse (External Quality Assurance Schemes for Reproductive Medicine, 2018).
CONTROL DE CALIDAD EXTERNO PARA LA REALIZACIÓN DE ENSAYOS DE CITOTOXICIDAD
El material de laboratorio utilizado en los LRHA no debe tener un efecto negativo en la viabilidad de los gametos y embriones. Con el objetivo de identificar aquellos fungibles tóxicos, diferentes guías recomiendan que el material sea testado previo a su uso (Organización Mundial de la Salud, 2010; ESHRE Guideline Group on Good Practice in IVF Labs et al., 2016). Existen diferentes bioensayos para este fin (Chan et al., 2001; Elder y Kastrop, 2003; Gardner et al., 2005, Kim et al., 2005), siendo el más utilizado por su facilidad y disponibilidad, el test de supervivencia espermática (TSE) (Lemmolo et al., 2005).
La validez del TSE es crucial para la calidad del laboratorio de andrología y embriología, ya que una mala realización de estos bioensayos podría llevar a utilizar materiales y/o medios embriotóxicos, lo que implicaría una disminución de los resultados, o a desechar materiales y/o medios no tóxicos, lo que provocaría costes extras. En cualquier caso, un buen sistema de bioensayo de materiales y medios llevaría consigo una mejora de resultados con un menor coste.
Con objeto de estandarizar los sistemas de bioensayo, diferentes sociedades científicas han implantado programas de CCExt de toxicidad (American Association of Bioanalyst, Fertility Society of Australia, Asociación para el Estudio de la Biología de la Reproducción) (Castilla et al., 2010). En estos programas, los centros participantes reciben diversos fungibles tratados o no con sustancias tóxicas y deben responder si el fungible es tóxico o no. Los laboratorios participantes desconocen totalmente si los materiales han sido tratados o el número de fungibles tratados.
Actualmente, no existe una estandarización de estos programas de CCExt, y los fungibles enviados a los centros para su evaluación son muy diferentes, desde materiales (puntas de pipeta, catéteres de transferencia, pipetas pasteur, placas petri) hasta medios de cultivo. Se han observado diferencias en los resultados de estos programas de CCExt, no pudiéndose descartar que se deba a la gran heterogeneidad de productos utilizados. Recientemente, nuestro grupo, analizando los datos del CCExt realizado por ASEBIR, ha observado una mayor estabilidad en los resultados obtenidos por los laboratorios al analizar puntas de pipeta que en los resultados obtenidos al analizar medios de cultivo. Esta mayor estabilidad de resultados al utilizar puntas de pipeta, unido a que este tipo de fungible es más cómodo logísticamente, lo hace un fungible ideal para este tipo de programas. Sin embargo, el uso de medios de cultivo permitiría analizar pH y osmolaridad, variables que también pueden afectar a la viabilidad de gametos y embriones, por lo que deberían seguir siendo un fungible complementario en este tipo de programas.
CONCLUSIONES
En conclusión, son muchos los procedimientos del laboratorio de reproducción humana asistida susceptibles de ser monitorizados en los programas de CCExt. siendo tres de estos, los que cuentan con programas consolidados. La participación en estos programas debe complementarse con acciones planificadas de mejorar, en caso de resultados no conformes a las especificaciones establecidas en los sistemas de calidad. Sería deseable, en un futuro, aumentar la cartera de programas de CCExt disponibles para el laboratorio de embriología.
Referencias
Ahlstrom A, Park H, Bergh C, Selleskog U, Lundin K. Conventional morphological assessment performs better than morphokinetics for prediction of live birth after day 2 transfer. Reprod Biomed Online. 2016;33:61-70.
Álvarez C, Castilla JA, Ramírez JP, Vergara F, Yoldi A, Fernández A, et al. External quality control program for semen analysis: Spanish experience. J Assist Reprod Genet. 2005;22:379-387.
Arce JC, Ziebe S, Lundin K, Janssens R, Helmgaard L, Sørensen P. Interobserver agreement and intraobserver reproducibility of embryo quality assessments. Hum Reprod. 2006;21:2141-2148.
Ardoy M, Calderón G, Cuadros J, Figueroa MJ, Herrer R, Moreno JM, et al. Cuadernos de Embriología Clínica. Criterios ASEBIR de valoración morfológica de oocitos, embriones tempranos y blastocistos humanos. 2ª edición. Madrid: ASEBIR; 2008.
Basile N, Vime P, Florensa M, Aparicio Ruiz B, García Velasco JA, Remohí J, et al. The use of morphokinetics as a predictor of implantation: a multicentric study to define and validate an algorithm for embryo selection. Hum Reprod. 2015;30:276-283.
Castilla JA, Mantilla A. Cuadernos de Embriología Clínica. Indicadores de calidad del laboratorio de embriología: definición y especificaciones. 1ªEdición. Madrid: ASEBIR; 2016
Castilla JA, Moracho-Zaragoza J, Aguilar J, Prats-Giménez R, Gonzalvo MC, Fernández-Prado E, et al. Quality specifications for seminal parameters based on the state of the art. Hum Reprod. 2005;20:2573-2578.
Castilla JA, Ruiz de Assin R, Gonzalvo MC, Clavero A, Ramírez JP, Vergara F, et al. External quality control for embryology laboratory. Reprod Biomed Online. 2010;20:68-74.
Chan PJ, Calinisan JH, Corselli JU, Patton WC, King A. Updating quality control assays in the assisted reproductive technologies laboratory with a cryopreserved hamster oocyte DNA cytogenotoxic assay. J Assist Reprod Genet. 2001;18:129-134.
Chávez SL, Loewke KE, Han J, Moussavi F, Colls P, Munne S, et al. Dynamic blastomere behaviour reflects human embryo ploidy by the four-cell stage. Nat Commun. 2012;13:1251.
Conaghan J, Chen AA, Willman SP, Ivani K, Chenette PE, Boostanfar R, et al. Improving embryo selection using a computer-automated time-lapse image analysis test plus day 3 morphology: results from a prospective multicenter trial. Fertil Steril. 2013;100:412-419.
Cooper TG, Bjorndahl L, Vreeburg J, Nieschlag E. Semen analysis and external quality control schemes for semen analysis need global standardization. Int J Androl 2002;25:306–311.
De Jonge CJ, Centola GC, Reed ML, Shabanowitz RB, Simon SD, Quinn P. Human sperm survival assay as a bioassay for the assisted reproductive technologies laboratory. J Androl. 2003;24:16-18.
Diamond MP, Suraj V, Behnke EJ, Yang X, Angle MJ, Lambe-Steinmiller JC, et al. Using the Eeva Test™ adjunctively to traditional day 3 morphology is informative for consistent embryo assessment within a panel of embryologists with diverse experience. J Assist Reprod Genet. 2015;32:61-68.
Elder KT, Kastrop P. Control de calidad en laboratorios de fertilización in vitro. Reproducción Humana [Internet] 2003; 3 Vol 1: 13-20. [Consultado el 20 de diciembre de 2017] Disponible en: http://www.flasef.org/textos/revista/2003/1/13_20.pdf
ESHRE Guideline Group on Good Practice in IVF Labs, De los Santos MJ, Apter, S., Coticchio, G., Debrock, S., Lundin, K., et al. Revised guidelines for good practice in IVF laboratories (2015). Hum Reprod. 2016;31,685–686.
External Quality Assurance Schemes for Reproductive Medicine. [Consultado el 26 de marzo de 2018] Disponible en: http://www.eqasrm.com.au/schemes#embryo-timelapse
Ferré M, Fuentes X. Control interno de la calidad. En: Fuentes X, Castiñeiras MJ, Queraltó JM. Bioquímica clínica y patología molecular. Volumen I. 2ª edición. Barcelona: Editorial Reverte; 1998.
Gardner DK, Balaban B. Assessment of human embryo development using morphological criteria in an era of time-lapse, algorithms and 'OMICS': is looking good still important? Mol. Hum Reprod. 2016;22:704-718.
Gardner DK, Reed L, Linck D, Sheehan C, Lane M. Quality control in human in vitro fertilization. Semin Reprod Med. 2005;23:319-324.
Haeckel R. Evaluation methods in laboratory medicine. Weinheim, Germany: VCH; 1993.
Hardarson T, Löfman C, Coull G, Sjögren A, Hamberger L, Edwards RG. Internalization of cellular fragments in a human embryo: Time-lapse recordings. Reprod Biomed Online. 2002;5:36-38.
Lemmolo M, Simmons L, Matson P. The rapid detection of cytotoxicity using a modified human sperm survival assay. J Assist Reprod Genet. 2005;22:177-180.
ISO 13528. Statistical methods for use in proficiency testing by interlaboratory comparisons. Geneva: International Organization for Standardization; 2015.
ISO 15189. Medical laboratories – Particular requirements for quality and competence. Geneva: International Organization for Standardization; 2012.
Kim JJ, Patton WC, Corselli J, Jacobson JD, King A, Chan PJ. Mouse embryonic stem cells for quality control testing in assisted reproductive technology programs. J Reprod Med. 2005;50:533-538.
Liu Y, Chapple V, Feenan K, Roberts P, Matosn P. Time-lapse deselection model for human day 3 in vitro fertilization embryos: the combination of qualitative and quantitative measures of embryo growth. Fertil Steril. 2016;105:656–662
Lundin K, Ahlstrom A. Quality control and standardization of embryo morphology scoring and viability markers. Reprod Biomed Online. 2015;31:459-471.
Martínez-Granados L, Serrano M, González-Utor A, Ortiz N, Badajoz V, López-Regalado ML, Boada M, Castilla JA; Special Interest Group in Quality of ASEBIR (Society for the Study of Reproductive Biology). Reliability and agreement on embryo assessment: 5 years of an external quality control programme. Reprod Biomed Online. 2018;36:259-268.
Martínez-Granados L, Serrano M, González-Utor A, Ortíz N, Badajoz V, Olaya E, Prados N, Boada M, Castilla JA; Special Interest Group in Quality of ASEBIR (Spanish Society for the Study of Reproductive Biology). Inter-laboratory agreement on embryo classification and clinical decision: Conventional morphological assessment vs. time lapse. PLoS One. 2017;12:e0183328.
Meseguer M, Herrero J, Tejera A, Hilligsoe KM, Ramsing N, Remohí J. The use of morphokinetics as a predictor of embryo implantation. Hum Reprod. 2011;26:2658-2671.
Milewski R, Kuć P, Kuczyńska A, Stankiewicz B, Łukaszuk K, Kuczyński W. A predictive model for blastocyst formation based on morphokinetic parameters in time-lapse monitoring of embryo development. J Assist Reprod Genet. 2015;32:571-579.
Molder A, Drury S, Costen N, Hartshorne GM, Czanner S. Semiautomated analysis of embryoscope images: Using localized variance of image intensity to detect embryo developmental stages. Cytometry A. 2015;87:119–128.
Organización Mundial de la Salud. WHO laboratory manual for the Examination and processing of human semen. 5ª edición. Geneva: OMS; 2010.
Organización Mundial de la Salud. WHO laboratory manual for the examination and processing of human semen and sperm-cervical mucus interaction. 3ª edición. Geneva: OMS; 1992.
Palacios ER, Clavero A, Gonzalvo MC, Rosales A, Mozas J, Martínez L, Ramírez JP, Björndahl L, Morancho-Zaragoza J, Fernández-Pardo E, Castilla JA. Acceptable variability in external quality assessment programmes for basic semen analysis. Hum Reprod. 2012;27:314-322.
Petersen BM, Boel M, Montag M, Gardner DK. Development of a generally applicable morphokinetic algorithm capable of predicting the implantation potential of embryos transferred on day 3. Hum Reprod. 2016;31:2231-2244.
Ruiz de Assin R, Clavero A, Gonzalvo MC, Ramirez JP, Zamora S, Fernández A, et al. Comparison of methods to determine the assigned value in an external quality control programme for embryo evaluation. Reprod Biomed Online. 2009;19:824–829.
Sundvall L, Ingerslev HJ, Knudsen UB, Kirkegaard K Inter- and intraobserver variability of time-lapse annotations. Hum Reprod. 2013;28:3215-21.
Thompson M, Ellison SLR, Wood R. The international harmonized protocol for the proficiency testing of analytical chemistry laboratories (IUPAC Technical Report). Pure Appl Chem. 2006;78:145-196.
UNE 179007. Health services. Systems of quality management for assisted reproduction laboratories. 2013.
VerMilyea MD, Tan L, Anthony JT, Conaghan J, Ivani, K, Gvakharia M, et al. Computer-automated time-lapse analysis results correlate with embryo implantation and clinical pregnancy: a blinded, multi-centre study. Reprod Biomed Online. 2014;29:729-736.