CULTIVO A BLASTOCISTO EN LA REPRODUCCIÓN ASISTIDA
Adrián Guillermo Socas
El uso de blastocistos en los tratamientos de reproducción asistida muestra multitud de ventajas con respecto al empleo de embriones en etapa de división. Tales ventajas son; menores tasas de embarazos múltiples, de abortos tempranos y del número de embriones que se criopreservan sin posibilidad posterior de desarrollo e implantación, así como un aumento de la tasa de implantación, embarazo y de nacimientos vivos. Actualmente muchas clínicas de reproducción asistida siguen sin ver el cultivo prolongado de embriones como una solución definitiva y de trabajo diario ante todo tipo de pacientes por tanto, el propósito de esta revisión fue el de proporcionar las evidencias existentes acerca de las ventajas, inconvenientes y necesidades del uso de blastocistos en los tratamientos de reproducción asistida.
INTRODUCCIÓN
La Organización Mundial de la Salud (OMS) define la salud como «…estado de completo bienestar físico, mental y social, y no solamente la ausencia de afecciones o enfermedades», por ello, aquellos problemas relacionados con la infertilidad deben ser tratados desde el punto de vista psicológico y médico para intentar solventarlos y conseguir así, una salud reproductiva plena.
Actualmente los tratamientos de Reproducción Asistida (RA) tienen una importancia tal, que en el año 2012 aproximadamente el 1,5% de los recién nacidos vivos en Estados Unidos fueron gracias a la utilización de estas técnicas. Esta creciente necesidad del uso de tratamientos de RA en nuestros días es debida principalmente al ritmo y estilo de vida al que estamos sometidos, sobre todo en los países más industrializados, donde las personas se ven obligadas a posponer su maternidad o paternidad hasta edades cada vez más avanzadas lo que conlleva una disminución de la fertilidad, sobre todo en el caso de la mujer. Varios trabajos han demostrado que el aumento de edad en la mujer no solo afecta a la calidad morfológica de sus óvulos, sino que también aumenta la probabilidad de presentar aneuploidías en estos (Gardner y Schoolcraft, 1998). Pero la edad también pasa factura en el caso del hombre, donde podemos ver como su fertilidad se ve reducida con el paso de los años (Belloc et al., 2014).
La infertilidad en ambos sexos depende de varios factores. En el caso de la infertilidad femenina, son muchos los estudios que han demostrado la existencia de varios factores ambientales que tienen repercusión sobre la fertilidad como son, la ansiedad y depresión (Smeenk et al., 2001), el tabaquismo (Boomsma y Macklon, 2006), la obesidad (Dessolle et al., 2011), etc. En la actualidad, estos factores son muy comunes en nuestra sociedad, lo que provoca que la tasa de infertilidad aumente con el paso de los años.
Para intentar incrementar la tasa de embarazo de las pacientes sometidas a tratamientos de RA muchos profesionales han propuesto la transferencia de blastocistos, los cuales mejoran la tasa de implantación y embarazo, reduciendo al mismo tiempo la tasa de embarazo múltiple debido a que se transfiere menor cantidad de embriones pero, ¿es la transferencia de blastocistos realmente tan efectiva como se ha dicho? A lo largo de este estudio se abordarán diferentes aspectos de los blastocistos, con el fin de proporcionar las evidencias existentes acerca de las ventajas, inconvenientes y necesidades del uso de blastocistos en los tratamientos de RA.
2. BLASTOCISTOS
Cuando hablamos de blastocisto se debe pensar en un embrión en D+5 o D+6, dependiendo de las condiciones in vitro, del sistema de cultivo utilizado y de las características del mismo. Los blastocistos son el resultado de una ordenación espacial de las blastómeras del embrión, caracterizándose por presentar un estrato envolvente de células o trofoectodermo (TE), una cavidad interna o blastocele y un cúmulo de células en uno de sus polos denominada masa celular interna (MCI).
2.1. Sistemas de clasificación de blastocistos
Existen diversos sistemas de clasificación para los blastocistos, pero el método más usado es el de su evaluación de acuerdo a su morfología. Gardner y Schoolcraft (1999) propusieron un sistema de clasificación que tiene en cuenta tres parámetros morfológicos; la expansión del blastocele y la forma tanto de la MCI como la cohesión del TE.
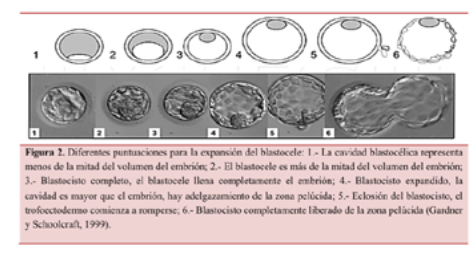
Para esta clasificación, Gardner y Schoolcraft (1999) dieron una puntuación numérica (1-6) a los blastocistos según su expansión blastocélica y su estado de eclosión (Figura 2).
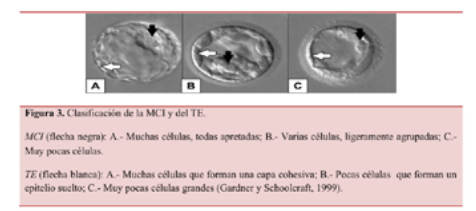
En el caso de la MCI y del TE, la clasificación se hace con el uso de tres letras (A, B o C), donde la MCI solo se puede evaluar en aquellos blastocistos con un desarrollo completo (los que tienen una clasificación del 3 al 6) (Figura 3).
Por lo tanto, el código para la clasificación de los blastocistos incluirá un número que hace referencia a la expansión blastocélica y dos letras, donde la primera hace referencia a la MCI y la segunda al TE.
El método de clasificación propuesto por Gardner y Schoolcraft (1999) no es el único, ya que existen otros menos extendidos, como el propuesto por Kovačič et al. (2004), donde se describen cuatro parámetros morfológicos; expansión blastocélica, morfología de la MCI, cohesión del TE y presencia de blastómeras o fragmentos excluidos de la formación de blastocistos.
A pesar del interés mostrado hace tiempo por la morfología tanto de la MCI como del TE, Ahlström et al. (2011) encontraron que la morfología del TE es un parámetro mucho más predictivo del potencial implantatorio del embrión. Además, Ebner et al. (2004) vieron diferencias significativas en las tasas de implantación de blastocistos cuando la localización de la zona de eclosión se posiciona en la región próxima a la MCI o sobre la región del TE (67% vs. 41%), siendo mayor la tasa de implantación cuando la zona de eclosión se posiciona cerca de la MCI.
2.2. Desarrollo de los medios de cultivo y su importancia para obtener blastocistos
Para que se pueda pensar en una transferencia de blastocisto en la actualidad, tenemos que recordar que los medios de cultivo han evolucionado enormemente desde los comienzos de las Técnicas de Reproducción Asistida (TRA).
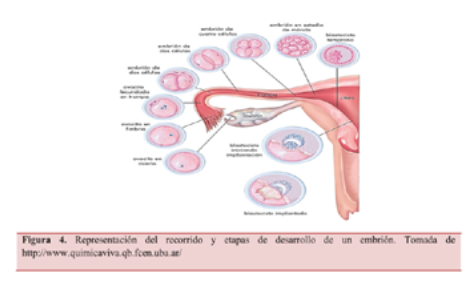
Actualmente disponemos de dos tipos de medios de cultivo, los secuenciales y los únicos. El cultivo secuencial consiste en la utilización de dos medios de cultivo con composiciones químicas distintas. Un primer medio trata de imitar las condiciones bioquímicas a las que sería sometido el embrión de forma natural hasta el D+3, el cual se encontraría recorriendo las trompas de Falopio para posteriormente, trasladarlo al segundo medio, hasta el D+5 o D+6 de desarrollo, días en los cuales el embrión ya se encontraría en el útero (Figura 4). Es por ello que dependiendo de la etapa en la que se encuentre el embrión, este requerirá diferentes nutrientes (Tabla I) (Artini et al., 2004).
Por tanto, el uso de los medios secuenciales aportan a los embriones todas las demandas dependiendo de sus diferentes fases de desarrollo, tratando de imitar así, el medio natural en lo posible.
Por otro lado, en la actualidad disponemos de los medios de cultivo únicos modernos, los cuáles se están usando cada vez más. Este tipo de medios no requiere de una renovación a los embriones en D+3, sino que pueden soportar el cultivo prolongado de embriones en ellos hasta la etapa de blastocisto. Algunos autores como Hardarson et al. (2015) han reportado tasas similares de formación de blastocistos con el uso de los medios de cultivo únicos en comparación con los embriones cultivados en medios secuenciales. Además los medios únicos tienen la ventaja de que son más económicos ya que solo se requiere un tipo de medio, repercutiendo asimismo en una reducción del tiempo de trabajo por paciente (VerMilyea et al., en prensa).
Lo que es evidente es que las condiciones y medios de cultivo no mejoran el potencial inherente de desarrollo de los embriones pero si pueden reducir su viabilidad, por lo que es importante que un medio de cultivo sea capaz de reducir en lo posible el estrés al que los embriones son expuestos en condiciones in vitro (Gardner y Schoolcraft, 1998; Lane y Gardner, 2007).
2.3. Requisitos e indicaciones para un cultivo hasta la etapa de blastocisto
Para realizar una valoración de la calidad embrionaria existen criterios como el consumo metabólico, el estudio de aneuploidías, además de otros parámetros que están demostrando su eficacia y potencialidad futura (ASEBIR). Sin embargo la valoración morfológica continúa siendo el sistema más extendido y eficiente (Scott, 2003; ASEBIR).
Hay que tener en cuenta que para una correcta catalogación embrionaria según su morfología se necesita de un seguimiento diario a lo largo del desarrollo del embrión para posteriormente decidir cómo ponderarlos. Para poder clasificar adecuadamente al embrión disponemos de varias opciones; realizar una valoración por puntuación (Fisch et al., 2001; Fisch et al., 2003), por categorías o recurrir al uso del time-lapse. Debido a la mayor dificultad para consensuar una ponderación adecuada de cada uno de los parámetros, y a que no todos los laboratorios disponen de la tecnología time-lapse, la segunda opción es el método más usado y fácil de comprender.
Se debe tener en cuenta que, a pesar de la mejor clasificación que se pueda hacer de los embriones, si no nos encontramos ante un endometrio receptivo, esta selección para realizar una transferencia puede ser inútil y provocar la pérdida de este embrión con alto potencial implantatorio (Shapiro et al., 2011).
2.3.1. Embriones de buena calidad para prolongar el cultivo hasta la etapa de blastocisto
Uno de los problemas más importantes del cultivo de embriones hasta la etapa de blastocisto, es la incapacidad de predecir con seguridad si los embriones en cultivo llegarán a desarrollarse hasta esta etapa a pesar de ser embriones de buena calidad. Thomas et al. (2010) publicaron en su trabajo que solo el 35% de los cigotos alcanzaran la fase de blastocisto en el quinto día. La relación entre la calidad del embrión en la etapa de división y la calidad del blastocisto fue estudiada por Rjinders y Jansen (1998), llegando a la conclusión de que el valor predictivo de la morfología del embrión en D+3 respecto a la formación de blastocisto posterior es limitada, porque sólo el 51% de los embriones que hubiesen sido preseleccionados para la transferencia en el D+3 podrían llegar a blastocistos en el D+5 (Balaban et al., 2001).
Existen dos parámetros para la toma de decisión acerca de la realización de un cultivo prolongado hasta el D+5, o por el contrario, realizar la transferencia o vitrificación el D+3. Uno de estos parámetros es la cantidad de embriones disponibles, y otro, es el número y calidad de las blastómeras de los embriones en el D+3. Con respecto a la cantidad de embriones disponibles no hay un claro consenso, pero algunos autores como Milki et al. (1999) proponen que se debe disponer de al menos 4 embriones de buena calidad (con 8 blastómeras y una fragmentación reducida en D+3) para realizar un cultivo prolongado hasta el D+5. En cambio, Racowsky et al. (2000) propone que el número mínimo de embriones de buena calidad para prolongar el cultivo hasta la etapa de blastocisto sea de 3.
Como ya se comentó anteriormente, para prolongar el cultivo de embriones hasta la etapa de blastocistos no solo debemos fijarnos en el número de embriones disponibles y en el número de sus blastómeras, sino también en la calidad de estas. Para ello, ASEBIR ha propuesto una gradación donde, embriones de buena calidad son considerados aquellos clasificados con las letras A y B.
2.3.2. Embriones con un desarrollo temporal anormal
Los embriones con un desarrollo temporal anormal son aquellos con un ritmo de división de sus blastómeras más rápido o lento de lo normal. Alrededor de este tipo de embriones hay una gran controversia y disparidad de opiniones acerca de su calidad. Mesut et al. (2011) encontraron que los embriones con desarrollo tardío tenían una tasa de implantación más baja que los embriones con desarrollo normal, por lo que se especuló acerca de si estos poseen defectos inherentes que provoquen un retraso en las divisiones posteriores de sus blastómeras, siendo indetectables estos problemas si únicamente realizamos un seguimiento morfológico. Este tipo de errores en el genoma embrionario pueden explicar la alta incidencia de abortos tempranos observados en embriones criopreservados en D+6 y transferidos posteriormente en un nuevo ciclo de preparación endometrial. Debido a lo anteriormente expuesto, estos autores no aconsejan elegir embriones de desarrollo lento para realizar una transferencia.
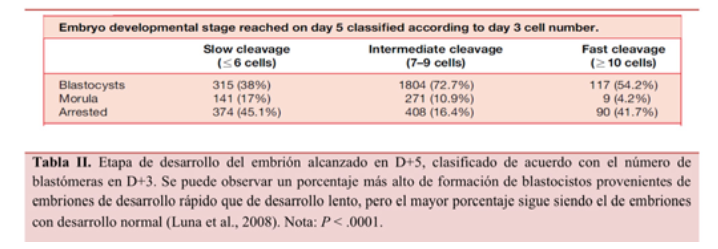
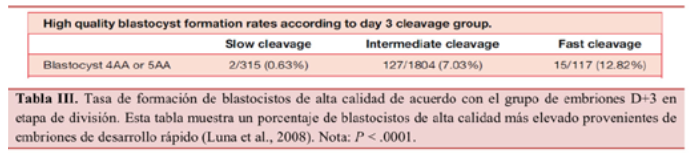
Por otro lado, los embriones con un desarrollo rápido no se suelen elegir para la transferencia si existen otros con características similares y de desarrollo normal, pero si un embrión se divide antes de tiempo no tiene por qué significar que este sea de mayor o menor calidad que otro embrión con un desarrollo normal. En el estudio de Luna et al. (2008) se demostró que la mayor tasa de formación de blastocistos provenía de embriones con una velocidad de desarrollo normal, seguido por los embriones con una velocidad de desarrollo rápida (Tabla II).
Puede que los embriones de desarrollo rápido tengan una mala reputación infundada ya que hay evidencias de la obtención de blastocistos de alta calidad (4AA y 5AA) que provienen en mayor proporción de embriones D+3 rápidos (Tabla III). Lo que parece más importante en estos casos, para determinar el mayor potencial implantatorio y de desarrollo de un embrión, es su seguimiento diario adecuado y no una única evaluación en D+3 (Fisch et al., 2003).
3. TRANSFERENCIA DE EMBRIONES EN D+5.
La superioridad de la transferencia de embriones en D+5 ha sido demostrada por multitud de publicaciones que muestran ventajas como; una tasa de implantación y de embarazo mayor que las transferencias en D+2 y D+3, una reducción de la incidencia de abortos tempranos, del número de embriones transferidos y de la tasa de embarazos múltiples (Tabla IV) (Gardner et al., 2004; Levitas et al., 2004; Papanikolaou et al., 2006).
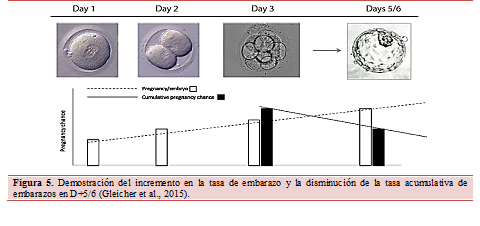
La figura 5 muestra el aumento progresivo de la tasa de embarazo tras una transferencia según evoluciona el embrión en el tiempo, hasta llegar a la etapa de blastocisto donde se encuentra la probabilidad máxima de embarazo. Esto es debido a que cuanto más avance el cultivo de embriones en el tiempo, mayor será el efecto discriminatorio de embriones de baja calidad. En cambio, desde el D+3 hasta el D+5 se pierde potencial acumulativo debido a que al seleccionar mejor los embriones se dispone de menor cantidad de embriones de la misma cohorte.
4. USO DE BLASTOCISTOS EN LAS TRA
El cultivo prolongado y uso de blastocistos en la RA tiene una serie de ventajas y desventajas que se nombraran a continuación.
4.1. Inconvenientes de los blastocistos en las TRA
El mayor problema con que se encuentran los embriólogos a la hora de prolongar el cultivo de embriones hasta la etapa de blastocistos es el riesgo de cancelación de la transferencia embrionaria a causa de la posibilidad de que ninguno de estos embriones, a priori de buena calidad, sean capaces de llegar a esta etapa (Levitas et al., 2004). Este inconveniente es debido posiblemente a que los medios y métodos de cultivo in vitro sean subóptimos para el correcto desarrollo de los embriones (Papanikolaou et al., 2008).
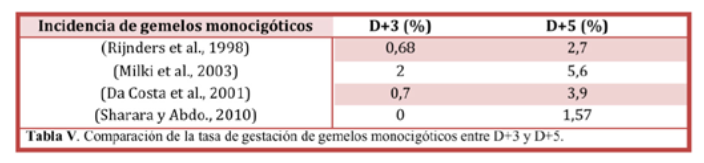
Otro de los principales problemas que presenta la transferencia de blastocistos es la incidencia de gemelos monocigóticos (Tabla V). Este hecho se cree que puede deberse a una serie de alteraciones que ocurren en la zona pelúcida de los embriones al ser sometidos a un cultivo prolongado (Behr et al., 2000; Tarlatzis et al., 2002).
A pesar de la aparente ventaja de seleccionar los mejores embriones mediante un cultivo prolongado, este método no nos asegura que los embriones que consigan llegar hasta la etapa de blastocisto sean realmente aptos para la formación de un feto, ya que puede que éstos presenten aneuploidias (Kolibianakis y Devroey, 2002), aunque claro está, en una menor proporción (Staessen et al., 2004).
El cultivo de blastocistos tiene el inconveniente de la necesidad de unos recursos de laboratorio adecuados, como es el caso de un número mínimo de incubadoras, ya que la capacidad de las incubadoras para mantener un microambiente estable influye significativamente en la formación de buenos embriones en etapas tempranas y la posterior tasa de formación de blastocistos (Fujiwara et al., 2007). Para evitar este problema existe la posibilidad de disponer de sistemas de monitorización que no impliquen la extracción de los embriones de su atmósfera controlada, como es el caso de la tecnología time-lapse (Neuber et al., 2003), acompañado del uso de medios de cultivo únicos. Este sistema incluye dentro de la incubadora una lente para la captura de imágenes, las cuales sirven para crear posteriormente un video con el desarrollo del embrión a alta velocidad que permite conocer por tanto, la evolución de los embriones a la vez que los protege de los cambios de temperatura, efectos nocivos de la luz y de las fluctuaciones de gases que provocaría su extracción de la incubadora para su visionado. Toda esta tecnología permitiría una mejora de las condiciones de cultivo, reduciendo el estrés al que es sometido el embrión durante su cultivo in vitro, pero esta instrumentación supone un presupuesto muy elevado para los centro de reproducción asistida (Rienzi et al., 2010).
Otro punto a tener en cuenta, es que la transferencia de blastocistos no siempre tiene los resultados esperados ya que, para obtener las mejores tasas de embarazo se deben seleccionar poblaciones de pacientes tales como receptoras de ovocitos donados, jóvenes, con fallos de implantación recurrentes, etc. (Prabhleen et al., 2013; Santos et al., 2003; Schoolcraft y Gardner, 2000).
Un dato curioso de la transferencia de blastocisto es el reporte de una mayor tasa de nacimiento de varones, dato que debe ser informado a los pacientes que se encuentran a la espera de una transferencia de blastocistos (Chang et al., 2009).
6.2. Ventajas de los blastocistos en las TRA
Una de las mayores ventajas de la transferencia de blastocistos, como ya se explicó con anterioridad, es la mejor coordinación entre el embrión y el endometrio, lo que provocaría un aumento en la tasa de embarazo y una reducción de la pérdida de embriones viables transferidos en D+3.
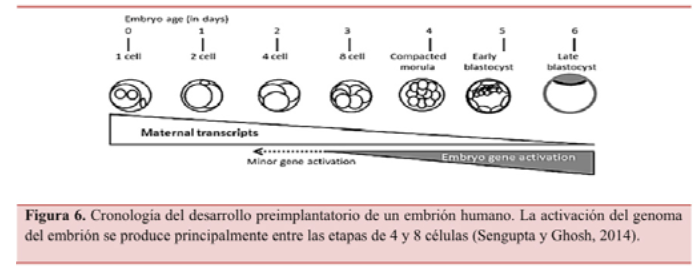
A partir del D+3 de desarrollo, el embrión activa su propio genoma (Figura 6), por lo que al seleccionar embriones en D+2 o D+3 para la transferencia existe una alta probabilidad de que estos no tengan posibilidad alguna de implantación debido a fallos relacionados con su genoma (Kolibianakis y Devroey, 2002). La realización de un cultivo prolongado hasta D+5 o D+6 aumenta por tanto la discriminación a favor de aquellos embriones con una menor cantidad de defectos deletéreos en su genoma (Graham et al., 2000), siendo más sensible y específica la predicción de viabilidad de un embrión en una etapa tardía de desarrollo antes que en una etapa temprana (Rehman et al., 2007).
Debido a los anterior, en el caso de pacientes con fallos de implantación recurrente, la transferencia de blastocistos parece ser la mejor opción (Levitas et al., 2004), puesto que la causa más común parece ser las aneuploidías en los embriones (Boomsma y Macklon., 2008; Goodman et al., 2008).
La transferencia de blastocisto tiene como principal objetivo la reducción del número de embriones que se transfieren en las TRA y así por tanto, de la tasa de embarazos múltiples (Papanikolaou et al., 2006; Yoon et al., 2001; Guerif et al., 2011), pero manteniendo al mismo tiempo una tasa de embarazo bastante alta (Gardner et al., 2000). Es importante reducir la incidencia de embarazos múltiples en pacientes sometidas a TRA, ya que este tipo de embarazo tienen numerosos riesgos como; parto prematuro, bajo peso del neonato, aumento de la mortalidad y morbilidad perinatal, etc. (Marsh et al., 2012).
En la tabla VI se puede observar la mayor tasa de embarazo y la disminución de la tasa de abortos tras la transferencia de un solo blastocisto en comparación con un embrión en etapa de división, independientemente de su calidad, lo que nos vuelve a indicar que la transferencia de blastocistos es el método más adecuado.
Thurin et al. (2004) en su estudio, también muestran la ventaja de la transferencia de blastocistos ya que, la tasa de embarazos acumulativa no fue significativamente diferente tras la transferencia de un blastocisto en fresco frente a la transferencia de dos embriones en etapa de división (38,8% vs 42,9%, P < 0,30), pero si tuvo lugar una importante disminución del número de nacimientos múltiples (0,8% vs 33,1%).
Otra de las ventajas de la transferencia de blastocistos es la disminución del número de embarazos ectópicos donde nos encontramos ante una incidencia del 2,1% cuando los embriones son transferidos en D+3 contra un 1,6% entre los embarazos con transferencia de embriones en D+5 (Smith et al., 2013). Esta disminución en el número de embarazos ectópicos al transferir blastocistos se cree que puede ser debido al mayor diámetro que presentan los blastocistos con respecto a los embriones en etapa de división, lo cual dificulta la entrada y alojamiento del embrión en las trompas de Falopio (Barrenetxea et al., 2005).
Ante el riesgo de hiperestimulación ovárica o simplemente para conservar los embriones sobrantes ante posibles futuras transferencias, el exceso de embriones se puede convertir en un problema debido a que la vitrificación de estos requiere de tiempo, material y espacio en bancos criogénicos que se traduce en pérdidas económicas, ya que muchos de estos embriones vitrificados antes de la etapa de blastocisto no tienen el potencial adecuado para llegar hasta esta etapa. Para solucionar este problema, se recomienda vitrificar solo blastocistos consiguiendo así, un ahorro de tiempo, medios y de espacio en los bancos criogénicos (Mesut et al., 2011; Cruz et al., 1999; Papanikolaou et al., 2008).
Lo que queda claro es que existen evidencias de la mejora en la implantación, embarazo y tasas de nacidos vivos después de la transferencia de blastocistos en comparación con la transferencia de embriones en etapa de división (Reh et al., 2010; Zech et al., 2007), especialmente en el caso de pacientes con buen pronóstico (Papanikolaou et al., 2005; Papanikolaou et al., 2006).
5. CONCLUSIONES
I. Un cultivo prolongado de embriones necesita de una instrumentación y condiciones de laboratorio específicas y adecuadas.
II. Para realizar un cultivo de blastocistos se debe disponer de una cohorte embrionaria mínima de buena calidad.
III. La transferencia de blastocistos aumenta significativamente la tasa de gestación.
IV. La tasa de abortos tempranos se ve reducida con la transferencia de blastocistos.
V. La transferencia de embriones en etapa de blastocisto reduce significativamente el número de embriones a criopreservar y disminuye la cantidad de embriones almacenados en los bancos de las clínicas de reproducción asistida.
VI. La tasa de embarazo múltiple se ve reducida con la utilización de la transferencia electiva de un solo embrión (TESE-1).
AGRADECIMIENTOS
A mi familia,
a Alexander Gómez, Idaira Martín y Verónica Almeida,
a mis tutoras, Dra. Delia Báez y Dra. Aixa Bello,
a la Unidad de Reproducción Asistida del Hospital Universitario de Canarias, en especial a la Dra. Raquel Blanes.
Referencias
1. Ahlström, A., Westin, C., Reismer, E., Wikland, M. y Hardarson, T. 2011. Trophectoderm morphology: an important parameter for predicting live birth after single blastocyst transfer. Hum Reprod. 26(12): 3289-3296.
2. Artini, P.G., Valentino, V., Cela, V., Cristello, F., Vitè, A. y Genazzani, A.R. 2004. A randomized control comparison study of cultura media (HTF versus P1) for human in vitro fertilization. Obstetrics & Gynecology. 2: 122-125.
3. Balaban, B., Urman, B., Alatas, C., Mercan, R., Aksoy, S. y Isiklar, A. 2001. Blastocyst-stage transfer of poor-quality cleavage-stage embryos results in higher implantation rates. Fertil Steril. 75(3): 514-518.
4. Barrenetxea, G., López de Larruzea, A., Ganzabal, T., Jiménez, R., Carbonero, K. y Mandiola, M. 2005. Blastocyst culture after repeated failure of cleavage-stage embryo transfers: a comparison of day 5 and day 6 transfers. Fertil Steril. 83(1): 49-53.
5. Behr, B., Fisch, J.D., Racowsky, C., Miller, K., Pool, T.B. y Milki, A.A. 2000. Blastocyst-ET and monozygotic twinning. J Assist Reprod Genet. 17: 349 –351.
6. Belloc, S., Hazout, A., Zini, A., Mervielc, P., Cabryc, R., Chahined, H., Copinc, H., Benkhalifac, M. 2014. How to overcome male infertility after 40: Influence of paternal age on fertility. Maturitas 78: 22 29.
7. Boomsma, C.M. y Macklon, N.S. 2006. What can the clinician do to improve implantation? Reproductive BioMedicine 13(6): 845-855.
8. Boomsma, C.M. y Macklon, N.S. 2008. Does glucocorticoid therapy in the peri-implantation period have an impact on IVF outcomes?. Curr Opin Obstet Gynecol. 20(3): 249–256.
9. Chang, H.J., Lee, J.R., Jee, B.C., Suh, C.S. y Kim, S.H. 2009. Impact of blastocyst transfer on offspring sex ratio and the monozygotic twinning rate: a systematic reviewand meta-analysis. Fertil Steril. 91: 2381–2390.
10. Cruz, J.R., Dubey, A.K., Patel, J., Peak, D., Hartog, B. y Gindoff, P.R. 1999. Is blastocyst transfer useful as an alternative treatment for patients with multiple in vitro fertilization failures? Fertil Steril. 72(2): 218-220.
11. da Costa, A.L., Abdelmassih, S., de Oliveira, F.G., Abdelmassih, V., Abdelmassih, R., Naggy, Z.P. y Balmaceda, J.P. 2001. Monozygotic twinning and transfer at the blastocyst stage after ICSI. Hum Reprod 16: 333–336.
12. Dessolle, L., Fréour, T., Ravel, C., Jean, M., Colombel, A., Daraï, E., y Barrière, P. 2011. Human Reproduction, 26(5): 1220–1226.
13. Ebner, T., Gruber, I. y Moser, M. 2004. Location of herniation predicts implantation behaviour of hatching blastocysts. Journal of the Turkish-German Gynecological Association. 8: 184-189.
14. Fisch, J.D., Rodriguez, H., Ross, R., Overby, G. y Sher, G. 2001. The Graduated Embryo Score (GES) predicts blastocyst formation and pregnancy rate from cleavage-stage embryos. Hum Reprod. 16(9): 1970-1975.
15. Fisch, J.D., Sher, G., Adamowicz, M. y Keskintepe, L. 2003. The graduated embryo score predicts the outcome of assisted reproductive technologies better than a single day 3 evaluation and achieves results associated with blastocyst transfer from day 3 embryo transfer. Fertil Steril. 80(6): 1352-1358.
16. Fujiwara, M., Takahashi, K., Izuno, M., Duan, Y.R., Kazono, M., Kimura, F. y Noda Y. 2007. Effect of micro-environment maintenance on embryo culture after in-vitro fertilization: comparison of top-load mini incubator and conventional front-load incubator. J Assist Reprod Genet. 24(1): 5-9.
17. Gardner, D. K. y Schoolcraft, W. B. 1998. Human Embryo Viability: What Determines Developmental Potential, and Can It Be Assessed? Journal of Assisted Reproduction and Genetics, 15(8)
18. Gardner, D.K. y Schoolcraft, WB. 1999. In vitro culture of human blastocysts. In: Jansen R, Mortimer D (eds) Toward reproductive certainty: fertility and genetics beyond. Parthenon Publishing, Carnforth, UK. pp. 378-388
19. Gardner, D.K., Lane, M., Stevens, J., Schlenker, T. y Schoolcraft, W.B. 2000. Blastocyst score affects implantation and pregnancy outcome: towards a single blastocyst transfer. Fertil Steril. 73(6): 1155-1158.
20. Gardner, D.K., Surrey, E., Minjarez, D., Leitz, A., Stevens, J., Schoolcraft, W.B. 2004. Single blastocyst transfer: a prospective randomized trial. Fertil Steril. 81(3): 551–555.
21. Gleicher, N., Kushnir, V.A. y Barad, D.H. 2015. Is it time for a paradigm shift in understanding embryo selection? Reprod Biol Endocrinol. (en prensa).
22. Goodman, C., Jeyendran, R.S. y Coulam, C.B. 2008. Vascular endothelial growth factor gene polymorphism and implantation failure. Reprod Biomed Online. 16(5): 720–723.
23. Graham, J., Han, T., Porter, R., Levy, M., Stillman, R. y Tucker, M.J. 2000. Day 3 morphology is a poor predictor of blastocyst quality in extended culture. Fertil Steril. 74(3): 495-497.
24. Guerif, F., Frapsauce, C., Chavez, C., Cadoret, V. y Royere, D. 2011. Treating women under 36 years old without top-quality embryos on day 2: a prospective study comparing double embryo transfer with single blastocyst transfer. Hum Reprod. 26(4):775-781.
25. Hardarson, T., Bungum, M., Conaghan, J., Meintjes, M., Chantilis, S. J., Molnar, L., ... & Wikland, M. 2015. Noninferiority, randomized, controlled trial comparing embryo development using media developed for sequential or undisturbed culture in a time-lapse setup. Fertility and sterility, 104(6), 1452-1459.
26. Kolibianakis, E.M. y Devroey, P. 2002. Blastocyst culture: facts and fiction. Reprod Biomed Online. 5(3): 285-93.
27. Kovačič, B., Vlaisavljevic, V., Reljic, M. y Cizek-Sajko, M. 2004. Developmental capacity of different morphological types of day 5 human morulae and blastocysts. Reproduction Biomedicine Online. 8: 687-694.
28. Lane, M., y Gardner, D.K. 2007. Embryo culture medium: which is the best? Best Pract Res Clin Obstet Gynaecol. (1): 83-100.
29. Levitas, E., Lunenfeld, E., Har-Vardi, I., Albotiano, S., Sonin, Y., Hackmon-Ram, R. y Potashnik, G. 2004. Blastocyst-stage embryo transfer in patients who failed to conceive in three or more day 2-3 embryo transfer cycles: a prospective, randomized study. Fertil Steril. 81(3): 567-571.
30. Luna, M., Copperman, A.B., Duke, M., Ezcurra, D., Sandler, B. y Barritt, J. 2008. Human blastocyst morphological quality is significantly improved in embryos classified as fast on day 3 (>or=10 cells), bringing into question current embryological dogma. Fertil Steril. 89(2): 358-363.
31. Mangalraj, A.M., Muthukumar, K., Aleyamma, T., Kamath, M.S. y George, K. 2009. Blastocyst stage transfer vs cleavage stage embryo transfer. J Hum Reprod Sci. 2(1): 23-26.
32. Marsh, C.A., Farr, S.L., Chang, J., Kissin, D.M., Grainger, D.A., Posner, S.F., Macaluso, M. y Jamieson, D.J. 2012. Trends and factors associated with the Day 5 embryo transfer, assisted reproductive technology surveillance, USA, 2001-2009. Hum Reprod. 27(8): 2325-2331.
33. Mesut, N., Ciray, H.N., Mesut, A., Aksoy, T. y Bahceci, M. 2011. Cryopreservation of blastocysts is the most feasible strategy in good responder patients. Fertil Steril. 96(5): 1121-1125.
34. Milki, A.A., Fisch, J.D. y Behr, B. 1999. Two-blastocyst transfer has similar pregnancy rates and a decreased multiple gestation rate compared with three-blastocyst transfer. Fertil Steril. 72(2): 225-228.
35. Milki, A.A., Jun, S.H., Hinckley, M.D., Behr, B., Giudice, L.C. y Westphal, L.M. 2003. Incidence of monozygotic twinning with blastocyst transfer compared to cleavage-stage transfer. Fertil Steril 79: 503–506.
36. Neuber, E., Rinaudo, P., Trimarchi, JR. y Sakkas, D. 2003. Sequential assessment of individually cultured human embryos as an indicator of subsequent good quality blastocyst development. Hum Reprod. 18(6): 1307-12.
37. Papanikolaou, E.G., Camus, M., Kolibianakis, E., Van Landuyt, L., Van Steirteghem, A., Devroey, P., 2006. In vitro fertilization with single blastocyst-stage versus single cleavage-stage embryos. N. Engl. J. Med. 354: 1139–1146.
38. Papanikolaou, E.G., D’haeseleer, E., Verheyen, G., Van de Velde, H., Camus, M., Van Steirteghem, A., Devroey, P., Tounaye, H. 2005. Live birth rate is significantly higher after blastocyst transfer than after cleavage-stage embryo transfer when at least four embryos are available on day 3 of embryo culture. A randomized prospective study. Hum. Reprod. 20: 3198–3203.
39. Papanikolaou, E.G., Kolibianakis, E.M., Tournaye, H., Venetis, C.A., Fatemi, H., Tarlatzis, B. y Devroey P. 2008. Live birth rates after transfer of equal number of blastocysts or cleavage-stage embryos in IVF. A systematic review and meta-analysis. Hum Reprod. 23(1): 91-99.
40. Prabhleen, K, Swarankar, M.L., Manju, M. y Seema, S. 2013. Implantation Rates after Two and Five Days of Embryo Culture: A Comparative Study. JK Science. 15(4): 185-188.
41. Racowsky, C., Jackson, K.V., Cekleniak, N.A., Fox, J.H., Hornstein, M.D. y Ginsburg, E.S. 2000. The number of eight-cell embryos is a key determinant for selecting day 3 or day 5 transfer. Fertil Steril. 73(3): 558-564.
42. Reh, A., Fino, E., Krey, L., Berkeley, A., Noyes, N. y Grifo, J. 2010. Optimizing embryo selection with day 5 transfer. Fertil. Steril. 93: 609–615.
43. Rehman, K.S., Bukulmez, O., Langley, M., Carr, B.R., Nackley, A.C., Doody, K.M. y Doody, K.J. 2007. Late stages of embryo progression are a much better predictor of clinical pregnancy than early cleavage in intracytoplasmic sperm injection and in vitro fertilization cycles with blastocyst-stage transfer. Fertil Steril. 87(5): 1041-1052.
44. Rienzi, L., Vajta, G. y Ubaldi, F. 2010. Predictive value of oocyte morphology in human IVF: a systematic review of the literature. Hum Reprod Update. 17(1): 34–45
45. Rijnders, P.M., van Os, H.C. y Jansen, C.A.M. 1998. Increased incidence of monozygotic twinning following the transfer of blastocyst in human IVF/ICSI. Fertil Steril 70: (Suppl 1),S15.
46. Rjinders, P.M. y Jansen, C.A. 1998. The predictive value of day 3 embryo morphology regarding blastocyst formation, pregnancy and implantation rate after day 5 transfer following in vitro fertilization or intracytoplasmic sperm injection. Hum Reprod. 13: 2869 –2873.
47. Santos, M.J., Mercader, A., Galan, A., Albert, C., Romero, J.L. y Pellicer, A. 2003. Implantation rates after two, three, or five days of embryo culture. Placenta. 24: S13-S19.
48. Schoolcraft, W.B. y Gardner, D.K. 2000. Blastocyst culture and transfer increases the efficiency of oocyte donation. Fertil Steril. 74: 482-486.
49. Scott L. 2003. The biological basis of non-invasive strategies for selection of human oocytes and embryos. Hum. Reprod. Update. (9): 237-249.
50. Sengupta, J. y Ghosh, D. 2014. Multi-level and multi-scale integrative approach to the understanding of human blastocyst implantation. Prog Biophys Mol Biol. 114(1): 49-60.
51. Shapiro, B.S., Daneshmand, S.T., Garner, F.C., Aguirre, M., Hudson, C. y Thomas, S. 2011. Evidence of impaired endometrial receptivity after ovarian stimulation for in vitro fertilization: a prospective randomized trial comparing fresh and frozen–thawed embryo transfer in normal responders. Fertil Steril. 96(2): 344-348.
52. Sharara, F.I. y Abdo, G. 2010. Incidence of monozygotic twins in blastocyst and cleavage stage assisted reproductive technology cycles. Fertil Steril. 93(2): 642-645.
53. Smeenk, J.M.J., Verhaak, C.M., Eugster A., Minnen A. V., Zielhuis G.A. y Braat D.D.M. 2001. The effect of anxiety and depression on the outcome of in-vitro fertilization. Human Reproduction 16(7): 1420–1423.
54. Smith, L.P., Oskowitz, S.P., Dodge, L.E. y Hacker, M.R. 2013. Risk of ectopic pregnancy following day-5 embryo transfer compared with day-3 transfer. Reprod Biomed Online. 27(4): 407-413.
55. Staessen, C., Platteau, P., Van Assche, E., Michiels, A., Tournaye, H., Camus, M., Devroey, P., Liebaers, I. y Van Steirteghem, A. 2004. Comparison of blastocyst transfer with or without preimplantation genetic diagnosis for aneuploidy screening in couples with advanced maternal age: a prospective randomized controlled trial. Hum. Reprod. 19: 2849 –2858.
56. Tarlatzis, B.C., Qublan, H.S., Sanopoulou, T., Zepiridis, L., Grimbizis, G. y Bontis, J. 2002. Increase in the monozygotic twinning rate after intracytoplasmic sperm injection and blastocyst stage embryo transfer. Fertil Steril. 77:196–198.
57. Thomas, M.R., Sparks, A.E., Ryan, G.L. y Van-Voorhis, B.J. 2010. Clinical predictors of human blastocyst formation and pregnancy after extended embryo culture and transfer. Fertil Steril. 94(2): 543–458.
58. Thurin, A., Hausken, J., Hillensjö, T., Jablonowska, B., Pinborg, A., Strandell, A. y Bergh, C. 2004. Elective single-embryo transfer versus double-embryo transfer in in vitro fertilization. N. Engl. J. Med. 351(23): 2392-2402.
59. VerMilyea, M. D., Graham, J. R., Anthony, J. T., Ignaszewski, A. D., & Tucker, M. J. (En prensa) Continuous Single Culture™ Comparison of Clinical Outcomes using a Single-Step Uninterrupted Culture Medium Protocol Requiring No Medium Renewal vs. a Traditional Three-Step Sequential Medium System.
60. Yoon, H.G., Yoon, S.H., Son, W.Y., Kim, J.G., Im, K.S. y Lim, J.H. 2001. Alternative embryo transfer on day 3 or day 5 for reducing the risk of multiple gestations. J Assist Reprod Genet. 18(5): 262-267.
61. Zech, N.H., Lejeune, B., Puissant, F., Vanderzwalmen, S., Zech, H. y Vanderzwalmen, P. 2007. Prospective evaluation of the optimal time for selecting a single embryo for transfer: day 3 versus day 5. Fertil Steril. 88(1): 244-246.
Páginas web consultadas ordenadas según se citan en el texto:
1 http://www.sart.org/Society_for_Assisted_Reproductive_Technology_Releases_New_Annual_Report_on_In_ Vitro_Fertilization_Procedures/
2 http://asebir.com/cuadernos-asebir/criterios-asebir-de-valoracion-morfologica-de-oocitos-embriones- tempranos-y-blastocistos-humanos/
Páginas webs consultadas ordenadas según se citan en las figuras y tablas:
http://www.quimicaviva.qb.fcen.uba.ar/v7n2/Fontana/Figura%2042%20copy.jpg
Estas páginas webs se consultaron en varias ocasiones a lo largo de la realización del trabajo.