DESEQUILIBRIOS CROMOSÓMICOS EN ESPERMATOZOIDES DE INDIVIDUOS PORTADORES DE TRANSLOCACIONES RECÍPROCAS
Anna Godo, Francesca Vidal, Joan Blanco, Ester Anton*
*Unitat de Biologia Cel·lular, Departament de Biologia Cel·lular, Fisiologia i Immunologia. Facultat de Biociències. Universitat Autònoma de Barcelona.
08193 Bellaterra (Cerdanyola del Vallès).
e-mail: ester.anton@uab.cat
Fecha recepción: 14 Marzo 2012
Fecha aceptación: 4 Abril 2012
Los portadores de translocaciones recíprocas tienen asociado un riesgo genético reproductivo debido a la producción de gametos portadores de alteraciones cromosómicas. Estas alteraciones se pueden cuantificar en espermatozoides mediante estudios de hibridación in situ fluorescente. Normalmente se realizan estudios de segregación y de efecto intercromosómico en espermatozoides de un mismo individuo, pero siempre de forma independiente. En consecuencia, las anomalías resultantes de estos dos eventos no pueden relacionarse directamente. El objetivo de este trabajo es hallar la relación entre los modos de segregación del tetravalente y la producción de espermatozoides con anomalías numéricas. Se han estudiado espermatozoides de tres individuos portadores de translocaciones recíprocas, siguiendo un protocolo de análisis secuencial basado en la realización de dos rondas de hibridación consecutivas con un lavado intermedio: la primera para detectar las anomalías numéricas y la segunda para evaluar el resultado de la segregación en los gametos aneuploides/diploides.
Los resultados han demostrado que los espermatozoides portadores de anomalías numéricas presentan una clara desviación del patrón de segregación estándar. En concreto, los espermatozoides aneuploides/diploides presentan un incremento de modos de segregación que implican procesos de no disyunción en el tetravalente; así como una disminución de la segregación equilibrada. Este hecho podría explicarse por la existencia de errores en el punto de control que actúa durante la transición de las fases metafase I y anafase I que permitirían la progresión de espermatocitos con alteraciones cromosómicas. Rev Asoc Est Biol Rep 2012; 17(1):12-16.
INTRODUCCIÓN
La incidencia de portadores de translocaciones recíprocas en la población general es aproximadamente 1/700 (Nielsen and Wohlert, 1991), no obstante en la población de individuos infértiles esta cifra puede elevarse hasta seis veces (De Braekeleer and Dao, 1991). La fertilidad de estos individuos está condicionada por la presencia de bloqueos meióticos y/o por la producción de un cierto porcentaje de gametos portadores de anomalías cromosómicas. Estas anomalías se originan mayoritariamente como consecuencia de segregaciones desequilibradas de los cromosomas reorganizados, o bien como resultado de un fenómeno denominado efecto intercromosómico (ICE).
En relación a la segregación de los cromosomas reorganizados, durante la profase I de la meiosis los cuatro cromosomas que comparten segmentos homólogos en un individuo portador de una translocación recíproca adoptan una estructura llamada tetravalente. A lo largo de la anafase I, esta estructura puede resolverse según cinco modos de segregación: Alternante, adyacente I (los centrómeros homólogos migran a polos celulares opuestos), adyacente II, 3:1 y 4:0, (los centrómeros homólogos migran al mismo polo). El modo de segregación alternante es el único que puede dar lugar a gametos normales o equilibrados, mientras que el resto de segregaciones resultará en gametos desequilibrados para los cromosomas reorganizados.
En la literatura existen varios estudios realizados con FISH en espermatozoides sobre la frecuencia de gametos equilibrados y desequilibrados en portadores de translocaciones recíprocas. A pesar de que en algunos casos se describen valores extremos en la frecuencia de segregaciones desequilibradas, con rangos desde 19% hasta el 80% (revisado por Morel et al., 2004), la mayoría de individuos analizados presentan frecuencias que se ajustan al patrón estándar de segregación observado por Anton et al., 2008. Según éste, la segregación preferente es la alternante, con un porcentaje de 46,5% ± 6.5 (media ± DE), mientras que el resto de modos de segregación se distribuyen de la siguiente forma: Adyacente I (33.6% ± 4.4); adyacente II (11.7% ± 6.9); 3:1 (6.8% ± 3.5) y 4:0 (0.6% ± 0.6). Las diferencias observadas entre diferentes translocaciones han sido atribuidas clásicamente a las características citogenéticas particulares de los cromosomas reorganizados en cada caso.
El fenómeno de ICE consiste en la producción de gametos con anomalías cromosómicas numéricas no relacionadas con los cromosomas reorganizados. Aunque todavía no hay consenso sobre el origen y relevancia de este fenómeno, se cree que las aneuploidías o diploidías producidas son consecuencia de la existencia de heterosinapsis entre regiones desapareadas del tetravalente con otros bivalentes no implicados en la reorganización (Oliver-Bonet et al., 2005). Estas asociaciones ilegítimas favorecen alteraciones del proceso meiótico, afectando negativamente al apareamiento y disyunción de los cromosomas (Burgoyne et al., 2009). La presencia de gametos con incrementos de al menos un tipo de disomía o diploidía (ICE positivo) es un fenómeno habitual en portadores de translocaciones recíprocas (revisado en Anton et al., 2011).
Los estudios de segregación del tetravalente y de ICE se realizan de forma independiente en distintas fracciones de la muestra, y no es posible establecer relaciones entre los resultados obtenidos. El objetivo de este trabajo es realizar ambos estudios en los mismos espermatozoides mediante una FISH secuencial, y así poder determinar si existe una relación entre la ocurrencia de los diferentes modos de segregación del tetravalente y la producción de anomalías cromosómicas numéricas.
MATERIAL Y MÉTODOS
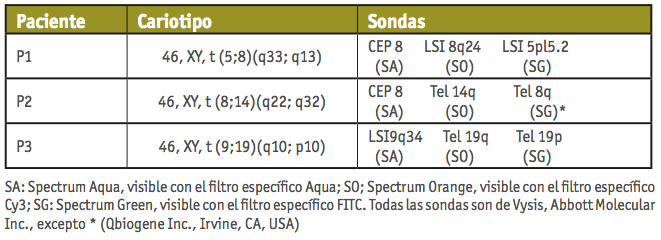
Seanalizaronmuestrasdesemenprocedentes de tres individuos infértiles portadores de translocaciones recíprocas que presentaban los siguientes cariotipos: 46,XY,t(5;8) (q33;q13) (P1); 46,XY,t(8;14)(q22;q32) (P2) y 46,XY,t(9;19)(q10;p10) (P3).
Los tres individuos fueron seleccionados por presentar ICE positivo en estudios previos (Anton et al., 2008). Las muestras se procesaron según el protocolo de FISH en espermatozoides estandarizado en nuestro laboratorio (Sarrate and Anton, 2009), que incluye la fijación, descondensación, desnaturalización y posterior hibridación de las muestras.
Se realizaron dos rondas de hibridación secuencial con un lavado de sondas intermedio:
1. Primera ronda: Se realizaron dos estudios paralelos de ICE, analizando las aneuploidías y diploidías de los cromosomas 18,X,Y por un lado y 13,21 por tro, mediante la utilización del AneuVysion Multicolor DNA Probe Kit (Abbott Molecular Inc., Des Plaines, IL, USA). El kit consta de dos combinaciones de sondas para realizar una FISH triple (sondas centroméricas para los cromosomas 18, X e Y) y una FISH dual (sondas locus específicas para los cromosomas 13 y 21).
2. Lavado de las sondas: Se eliminaron mediante una solución citrato-sódica salina en condiciones altamente astringentes(0,0625xSSC).
3. Segunda ronda de hibridación: Se utilizaron combinaciones específicas de sondas para los cromosomas implicados en cada reorganización, que permitieron identificar los diferentes productos de segregación del tetravalente. Las sondas utilizadas en cada paciente se detallan en la Tabla I.
Tabla I. Combinaciones de sondas utilizadas para los estudios de segregación.
Referente a los análisis de ICE, las muestras P1 y P3 se valoraron de forma automática con el sistema Spot- Counting (Spot AX software, Applied Imaging, Newcastle, U.K.) (Molina et al., 2009) acoplado al microscopio BX-61 (Olympus, Barcelona, España) equipado con filtros específicos para DAPI (4’,6-diamidino-2-phenylindole), Aqua, FITC (fluorescein isothiocyanate) y Cy3 (cytochrome 3). Este sistema permite almacenar información relativa a la localización y a los parámetros morfológicos de los núcleos, además del número e intensidad de las señales presentes en cada uno de los espermatozoides analizados. La muestra del individuo P2 se analizó de forma manual con el microscopio BX-60 (Olympus) con un filtro de triple banda y otros específicos para FITC, Cy3, Aqua. En cualquier caso (automático o manual) se capturaron imágenes y se anotó la localización de los espermatozoides aneuploides o diploides valorados en cada panel de cromosomas (Spot AX software; Sensor Control Display, Marzhauser Wetzlar; Isis Fluorescence Image System, Metasystems, Germany).
El análisis del patrón de segregación se realizó de forma diferencial en dos poblaciones de gametos para cada individuo: (i) fracción aleatoria de espermatozoides (no seleccionados), y (ii) espermatozoides portadores de anomalías numéricas (detectados en los análisis de ICE previos). En este último caso, los espermatozoides aneuploides y diploides se relocalizaron de forma automática o manual, según el método en que se inició el estudio.
Para la valoración de las muestras se siguieron los criterios estrictos de valoración, referentes a la intensidad, el tamaño y la localización de las señales de hibridación descritos en nuestro grupo (Blanco et al., 1996). Para cada individuo, las frecuencias encontradas se analizaron estadísticamente mediante el test χ2 (SSP v2.8, Claremont, California), considerando un intervalo de confianza del 95%.
RESULTADOS
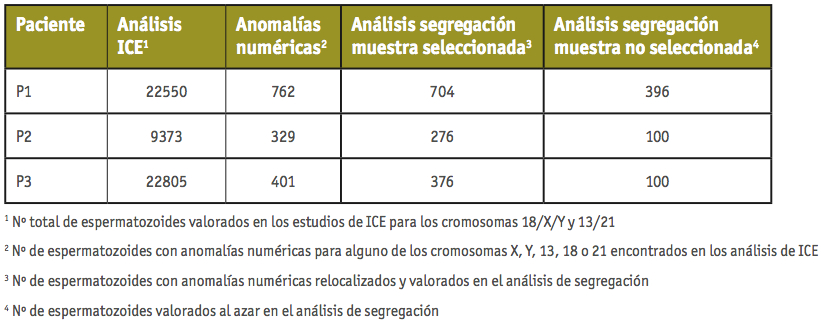
El número de espermatozoides analizados se resume en la Tabla II. En los estudios de ICE, se valoraron un total de 10706 (P1), 5181 (P2) y 12319 (P3) espermatozoides para los cromosomas X, Y, 18; y de 11844 (P1), 4192 (P2) y 10486 (P3) espermatozoides para los cromosomas 13 y 21. En conjunto, se clasificaron como diploides o aneuploides para alguno de los cromosomas analizados un total de 762 (P1), 329 (P2) y 401 (P3) espermatozoides. En la segunda ronda de hibridación (estudio de segregación) se relocalizaron y analizaron los siguientes porcentajes de espermatozoides aneuploides/diploides: 92.4% (704/762) (P1), 83.9% (276/329) (P2) y 94.5% (379/401) (P3). Los productos resultantes de la segregación también se valoraron en una fracción aleatoria de espermatozoides en cada individuo: 396 (P1), 100 (P2) y 100 (P3).
Tabla II. Número total de espermatozoides analizados en cada uno de los individuos
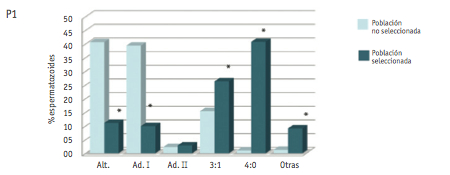
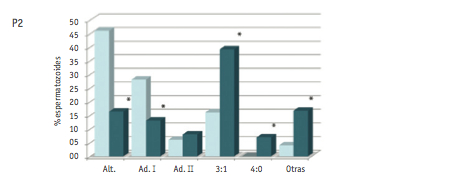
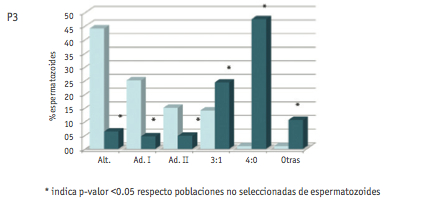
Los resultados referentes a la valoración de los diferentes modos de segregación en las dos poblaciones de espermatozoides analizadas se muestran en la Figura 1.
El análisis en la población no seleccionada muestra un porcentaje de gametos equilibrados de 43.5 ± 2.7% (media ± DE), siendo la segregación alternante el modo más representado. Del resto de segregaciones, la que se observó con mayor frecuencia (media ± DE) fue la adyacente I (30.8 ± 7.6), seguida de la 3:1 (15.1 ± 1), adyacente II (7.8 ± 6.5) y 4:0 (0.7 ± 0.6).
Figura 1. Frecuencias de espermatozoides obtenidas en los análisis de segregación realizados en la muestra seleccionada (portadores de anomalías numéricas) y no seleccionada de P1, P2 y P3
El análisis de los patrones de segregación en la población de espermatozoides portadores de anomalías numéricas mostró un cambio en los porcentajes de segregación. Los porcentajes de gametos equilibrados fueron tan sólo de 11.1% (P1); 16.3% (P2) y 6.3% (P3). En este caso, los productos de segregación mayoritarios fueron los desequilibrados, con valores medios de (media ± DE) 31.7 ± 28.1 (segregación 4:0), 29.9 ± 8.1 (segregación 3:1), 9.2 ± 4.3 (segregación adyacente I) y 5.2 ± 2.6 (segregación adyacente II). La categoría “otras” incluyó combinaciones de sondas no esperadas según los modos teóricos de segregación, y se encontró representada por una media de 12.1 ± 4% espermatozoides.
Los resultados de segregación obtenidos en la población de espermatozoides no seleccionados se ajustaron al patrón estándar observado en portadores de translocaciones recíprocas, en el que predominan los gametos equilibrados productos de la segregación alternante, seguida de la adyacente I (Anton et al., 2008). Por otro lado, los resultados de segregación en la población de gametos portadores de anomalías numéricas mostraron una clara desviación del patrón. Al comparar las frecuencias de cada modo de segregación hallado en las dos poblaciones de espermatozoides estudiadas, se evidenciaron diferencias estadísticamente significativas en la mayoría de los modos de segregación. En concreto, en las poblaciones de espermatozoides con anomalías numéricas, se detectó una reducción significativa de las segregaciones alternante y adyacente I. Por otro lado, en esta misma población, se detectaron incrementos significativos de las segregaciones 3:1, 4:0 y de la categoría “otras”.
DISCUSIÓN
La condición aneuploide/diploide se encuentra preferentemente asociada a la presencia de productos de segregación del tetravalente que implican una no disyunción (centrómeros homólogos en el mismo polo celular), especialmente las segregaciones 3:1 y 4:0. En cambio, las segregaciones alternante y adyacente I (los centrómeros homólogos migran a polos celulares opuestos) se encuentran reducidas significativamente. Estos resultados sugieren que el fenómeno de ICE y las segregaciones desequilibradas 3:1 y 4:0 son sucesos dependientes y que están condicionados por las interacciones cromosómicas que se establecen durante el proceso meiótico (heterosinapsis), y por el nivel de eficiencia de los puntos de control. En consecuencia, los portadores de translocaciones recíprocas producen espermatozoides que acumulan anomalías cromosómicas procedentes de dos orígenes distintos.
La heterosinapsis se produce en portadores de translocaciones recíprocas entre el tetravalente y regiones asinápticas de otros bivalentes (Oliver-Bonet et al., 2005). Este mecanismo se ha descrito como una estrategia que adopta el espermatocito para evitar la activación del punto de control de sinapsis y recombinación en la etapa de paquiteno (profase I) que conllevaría apoptosis (Sciurano et al., 2007). Los resultados obtenidos indican que la heterosinapsis podría tener un efecto recíproco, que condicionaría tanto la segregación del tetravalente como la de otros bivalentes implicados.
Por otro lado, durante la transición metafase I-anafase I, la presencia del tetravalente en la placa metafásica podría implicar una activación prolongada del punto de control de formación del huso meiótico (SAC) (Vogt et al., 2008). En esta situación, la formación de gametos desequilibrados y con anomalías numéricas se podría originar por dos vías. En primer lugar, la no reparación de las anomalías detectadas podría derivar en la ausencia de citocinesis y la consecuente producción de espermatozoides diploides (Egozcue et al., 2000). En segundo lugar, existen indicios de que el punto de control del SAC no es del todo eficiente en la detección y eliminación de espermatocitos con alteraciones en la disposición de los bivalentes en el huso meiótico (Eaker et al., 2001). En células portadoras de translocaciones recíprocas, el número de espermatocitos con este tipo de alteraciones es muy elevado. En esta situación, es plausible esperar una frecuencia de gametos con alteraciones cromosómicas que escapen al SAC proporcionalmente incrementada. Estos eventos explicarían por qué la célula presentaría errores derivados de una segregación anómala de los cromosomas reorganizados, además de errores en la disyunción de otros cromosomas.
AGRADECIMIENTOS
Este trabajo se ha realizado con la financiación de los proyectos SAF2010-22241, SGR2009-282 y UAB CF-180034. AG es beneficiaria de una beca predoctoral PIF 456-01-4/2011. Queremos agradecer el suministro de las muestras a los centros I.B.Q. Flor de Maig y CPC (Barcelona).
Referencias
Anton E, Vidal F, Blanco J. Reciprocal translocations: tracing their meiotic behaviour. Genet Med. 2008;10:730-8.
Blanco J, Egozcue J, Vidal F. Incidence of chromosome 21 disomy in human spermatozoa as determined by fluorescent in-situ hybridization. Hum Reprod. 1996;11:722-6.
Burgoyne PS, Mahadevaiah SK, Turner JMA. The consequences of asynapsis for mammalian meiosis. Nat Rev Genetics. 2009;10:207-16.
De Braekeleer M, Dao TN. Cytogenetic studies in male infertility: a review. Hum Reprod. 1991;6:245-250.
Eaker S, Pyle A, Cobb J, Handel MA. Evidence for meiotic spindle checkpoint from analysis of spermatocytes from Robertsonian- chromosome heterozygous mice. J Cell Sci. 2001;114:2953-2965.
Egozcue S, Blanco J, Vendrell JM, Garcia F, Veiga A, Aran B, et al. Human male infertility: chromosome anomalies, meiotic disorders, abnormal spermatozoa and recurrent abortion. Hum Reprod Update. 2000;6:93- 105.
Molina O, Sarrate Z, Vidal F, Blanco J. Fish on sperm:spot-conting to stop counting? Not yet. Fertil Steril. 2009;92:1474-1480.
Morel F, Douet-Guilbert N, Le Bris MJ, Herry A, Amice V, Amice J, et al. Meiotic segregation of translocations during male gametogenesis. IntJournalofAndrology.2004;27:200-212.
Nielsen J, Wohlert M. Chromosome abnormalities found among 34,910 newborn children: results from a 13-year incidence study in Arhus, Denmark. Hum Genet. 1991;87:81-83.
Oliver-Bonet M, Benet J, Sun F, Navarro J, Abad C, Liehr T, et al. Meiotic studies in two human reciprocal translocations and their association with spermatogenic failure. Hum Reprod. 2005; 20:683-688.
Sarrate Z, Anton E. Fluorescence in situ hybridization (FISH) Protocol in Human Sperm. J Vis Exp. 2009;31. pii:1405. doi: 10.3791/1405.
Sciurano R, Rahn M, Rey-Valzacchi G, Solari AJ. The asynaptic chromatin in spermatocytes of translocation carriers contains the histone variant gamma-H2AX and associates with the XY body. Hum Reprod. 2007;22:142-50.
Vogt E, Kirsch-Volders M, Parry J, Eichenlaub- Ritter U. Spindle formation, chromosome segregation and the spindle checkpoint in mammalian oocytes and susceptibility to meiotic error. Mutat Res. 2008;651:14-29.