EFECTO DE LA ECLOSIÓN ASISTIDA EN RELACIÓN AL PORCENTAJE DE GESTACIÓN EN EMBRIONES CRIOPRESERVADOS
Mónica Dorado*, Maria Hebles**, Beatriz Migueles*, Mercedes González*; Pascual Sánchez**, Fernando Sánchez** *Fundación Guadalquivir de Investigación Médica.**Clínica Ginemed, c/Farmacéutico Murillo Herrera, nº 3, 41010, Sevilla, España. ginemed@ginemed.com
Resumen: El objetivo del estudio es comprobar el efecto de la eclosión asistida con ácido Tyrode en embriones descongelados. Se estudiaron un total de 1224 parejas sometidas a ciclos de reproducción asistida. Observamos y evaluamos la calidad de los embriones descongelados en relación al número de embriones que sobreviven y el porcentaje de blastómeras lisadas de dichos embriones. Comparamos el porcentaje de embarazos en ciclos de descongelados con y sin eclosión asistida. Aparecen diferencias significativas en el porcentaje de embarazos en el grupo de embriones que han sido sometidos a eclosión asistida (P<0,05), y también observamos una mejor tasa de embarazos en transferencias con embriones de calidad inferior (supervivencia inferior al 60%) cuando son sometidos a eclosión asistida.
Palabras clave: eclosión asistida, Tyrode, criopreservación de embriones
Effects of Assisted Hatching on the rates of gestation in cryopreservation embryos
Summary: The objetive of this study is to evaluate the impact of embryos assisted hatching with Tyrode’s acid in thawed embryos. It was studied a total of 1124 couples undergoing infertility treatment. We observed and evaluate the quality of thawed embryo in relation to the number of that survived, and the rate of blastomeres death. We compared the rate of pregnancies on thawed embryos cycles with and without assisted hatching. There were some significant differences between two group, we also detect a better rate pregnancy using assisted hatching when the survival is badly (surviving rate is less than 60%).
Key words: Assisted hatching, Tyrode, cryopreservation embryos
INTRODUCCIÓN
La baja tasa de implantación del embrión humano es uno de los factores limitantes para las técnicas de reproducción asistida (Bernabeu et al., 2004).
La estimulación ovárica en los tratamientos de fecundación in vitro (FIV) pretende conseguir un desarrollo folicular múltiple para la obtención de varios óvulos y consecuentemente un número mayor de embriones. Esto permite una mayor selección de embriones para transferir. Con este aumento en el número de embriones respecto a un ciclo natural, buscamos en parte solucionar el menor poder implantatorio de los embriones cultivados in vitro ( Ernest Hung Yu Ng et al. 2005). Habitualmente se transfieren 2 ó 3 embriones, quedando embriones para congelar según criterios de calidad, como número de blastómeras, grado de fragmentación y ausencia de multinucleación. Los embriones criopreservados y posteriormente descongelados tienen una tasa de implantación y embarazo disminuida con respecto a los mismos en fresco (Turcker et al. 1991).
Una de las causas de la disminución de la implantación puede ser debida al endurecimiento de la zona pelúcida (ZP) (Gabrielsen et al 2004), producido durante el proceso de congelación – descongelación. Otra causa puede ser la presencia de blastómeros lisados e intactos en un embrión tras la descongelación, este hecho puede afectar la viabilidad de los intactos y comprometer el desarrollo
embrionario (Belil et al 2002).
Ernest Hung Yu Ng et al. 2005 han planteado la eficacia de la eclosión asistida sobre la implantación embrionaria, especialmente en embriones que han sufrido congelación- descongelación. Estudios in vitro con embriones humanos han mostrado que una abertura en la ZP mejora significativamente la capacidad del blastocisto para eclosionar (De Vos et al. 2000).
Dos recientes meta-análisis (Edi-Osagie et al. 2003 y Sallam HN et al. 2003) refieren que el hatching asistido (AH) incrementa el porcentaje de implantación y embarazos, especialmente en mujeres mayores o con valores aumentados de FSH. Tao y Tamis (1997) mostraron un aumento significativo en el porcentaje de embarazos con hatching asistido mediante acido de tyrode en pacientes con pobre pronóstico, en mujeres mayores de 38 años y embriones de mala calidad. Cohen et al. 1999 también documentaron un aumento significativo en ciclos de donación de óvulos.
El objetivo de este estudio es comparar el efecto del hatching asistido en la implantación y desarrollo de los embriones que han sido sometidos a procesos de congelación – descongelación.
MATERIAL Y MÉTODOS
Selección de pacientes
Se realizó un estudio observacional retrospectivo que incluye 1224 ciclos de transferencia de embriones descongelados procedentes de ciclos de ICSI y que fueron congelados en día +1 y/o día +2 en un único centro. Todas las parejas con embriones congelados fueron informadas para poder participar en el estudio.
Realizamos un estudio comparativo de las tasas de embarazo e implantación embrionaria obtenidas en ciclos de embriones congelados y descongelados de pacientes que han sido sometidos a hatching frente a los que no se les ha realizado hatching.
Programación del ciclo inicial de FIV-ICSI
Los ciclos de ICSI seleccionados fueron realizados en protocolo corto tras un mes de reposo ovárico con anticonceptivos. Para supresión se utilizó análogos de la GnRH (aGnRH, Decapeptyl diario®) comenzando en el Día 2º del ciclo menstrual a dosis de 1/2 vial al día. Según los niveles séricos de FSH, LH y estradiol, y en función de la edad de la paciente, se fijan las dosis de estimulación ovárica con hormona folículo estimulante (FSH, Gonal-F®) y Menotropina (Menopur®).
La administración de estos se individualiza de acuerdo al control ecográfico del ciclo. El criterio para la administración de la hormona gonadotrófica humana (10.000 UI de hCG, Lepori®) es la presencia de la mayoría de la cohorte de folículos con 16 o más mm. de diámetro. La administración de aGnRH y FSH se suspende el día de la administración de la hCG.
Las punciones se realizaron a las 36 horas de la administración de la hCG por vía vaginal ecoguiada. La microinyección se llevó a cabo entre las 3 y 6 horas de la captación ovocitaria. La fecundación se evaluó a las 16-20 horas y la selección de embriones a transferir a las 42-44 horas (día 2) o las 66-68 horas (día 3) catalogando los embriones según el número de blastómeras, simetría de tamaño y la cantidad de fragmentos citoplásmicos.
Procedimiento de congelación de embriones
Todos los embriones excedentes fueron crioconservados con Freezen kit 1™ (Vitrolife) en pajuelas de 0,5 mL (CryoBio System) en un congelador manual Nicool MS21 de Air Liquide. El congelador fue programado para bajar 2ºC/min desde una temperatura de 25ºC hasta -6,9ºC. Tras esperar 8 min a esta temperatura se realiza el seeding de forma manual. A continuación el congelador está programado para bajar 0,3ºC/min hasta llegar a -29,9ºC cuando la pajuela es depositada en el nitrógeno líquido a -196ºC y almacenadas en cántaras adecuadas hasta su utilización.
Preparación para las transferencias en ciclo de congelados
Tras comprobar por ecografías que el endometrio era delgado, el día 5º del ciclo se comienza con una sustitución de estrógenos en parches (ESTRADOT®) comenzando con parches de 50 y aumentando en función de la respuesta a nivel endometrial hasta obtener un endometrio que sea anecógeno, en triple línea y por encima de 7 mm de espesor entre ambas capas. Durante todo el tiempo de tratamiento con estrógenos se suplementa con AAS (AAS- 100®) y se valora el flujo sanguíneo al útero. Los ciclos en los que hay un SOPQ la paciente se encuentra en tratamiento con Metformina (Diamben 850®) con una o dos pastillas al día en función de tolerancia y de forma continua. En el caso de que en el Doppler que se hace de rutina en la arteria uterina el flujo sea discontinuo se añade un tratamiento con Pentoxifilina (HEMOVAS 400®)
Cuando el endometrio está listo (mayor de 7 mm en triple línea y anecógeno), se prepara para la transferencia de los embriones: se administran por vía vaginal dos comprimidos de progesterona (Utrogestan 200mg®) cada 12 horas con un total de 800 mg al día. Se comienzan a administrar 3 días antes de la transferencia. El tratamiento con estradiol y progesterona se mantiene igual hasta el día de la hCG (dos semanas) y si ésta es positiva se mantiene hasta la semana 12 de embarazo.
Todas las pacientes se suplementan con ácido fólico a partir de la transferencia de los embriones.
Procedimiento de descongelación
Se procede a la extracción de las pajuelas de congelación y se elimina el exceso de nitrógeno de la pajuela. Se deja unos 30 segundos a temperatura ambiente y se pasa al baño térmico a 30ºC otros 30 segundos. Después, pasamos los embriones por cada uno de los medios secuenciales de Thaw-kit 1™ (Vitrolife) preparados en placas Nunc™ para eliminar el crioprotector.
Una vez terminado el proceso de descongelación se pasan los embriones a la placa de cultivo hasta el momento de la transferencia.
El protocolo de descongelación se lleva a cabo en función del día en que se congelaron los embriones: Si la congelación se hizo en pronúcleos la descongelación se realiza dos días antes de la transferencia y si fue realizada en día +2, el día de antes de la descongelación.
Una vez descongelados se verifica la calidad de los embriones y de acuerdo con el protocolo se realiza hatching asistido.
La transferencia se realiza aproximadamente una hora después de haber realizado el hatching. El número de embriones transferidos varía de 1 a 3 en función de la calidad. Todas las transferencias fueron realizadas con medio G2™ version 3 de Vitrolife y catéter de Gynetics®.
Procedimiento de AH
Los embriones que iban a ser transferidos fueron colocados en microgotas de 25 μm de Oocyte Wash Buffer (Cook) de forma individual bajo aceite mineral de Cook® . Para llevar a cabo el procedimiento se utilizó una placa Falcon 1006 (Becton Dickinson, Dinamarca).
La pipeta Holding (20 μm) y la de hatching (9-10 μm) eran proporcionadas por Humagen. El control de salida del ácido de Tyrode (Medi-Cult) hacia la zona pelúcida era llevado a cabo con un microinyector (Narishige, Dinamarca).
Para la realización del hatching se realizó un orificio de 30 μm de diámetro. Una vez efectuado, el embrión se llevó al otro lado de la gota para liberarlo del ácido. A continuación fue pasado a la placa de doble pocillo (Falcon 353037) en medio Blastocyst (Cook) para la posterior transferencia. Se utilizaron 2 microinyectores Narishige en una placa calefactora a 37ºC en un microscopio de contraste de fase Nikon con óptica de Hoffman.
Análisis estadístico
La comparación estadística fue llevada a cabo mediante el test de Student, test de Chi-Cuadrado y test de ANOVA. Consideramos que existen diferencias significativas cuando se obtienen valores P<0,05.
La edad media de las pacientes entre el grupo control (grupo al que no se realizó el AH) y el grupo estudio (grupo con AH) fue comparada utilizando el test de Student.
El embarazo clínico fue definido por la presencia de 1 o más sacos de gestación. Para analizar la tasa de embarazo entre ambos grupos se utilizó el test de ANOVA y el test de Chi-cuadrado.
RESULTADOS
Los datos del presente trabajo fueron obtenidos en el periodo comprendido entre Abril del 2003 y Abril 2006. Durante este tiempo se realizaron un total de 1224 ciclos de descongelación, de los cuales a 590 ciclos se les practicó el hatching asistido (grupo estudio) y a 634 ciclos no les fue practicado (grupo control). Debido al proceso de descongelación 61 ciclos fueron excluidos por la no supervivencia de los embriones entre ambos grupos.
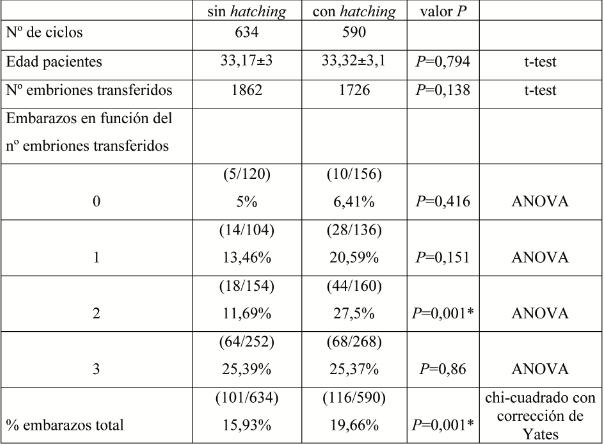
Nosotros comparamos 1726 embriones a los que se les realizó AH en 590 transferencias con el grupo control de 1862 embriones en 634 transferencias a los que no se les realizó. Los embriones no fueron dañados durante el procedimiento. La edad de las mujeres en el momento de la aspiración de los ovocitos fue similar (33,32 frente a 33,17 años). No existen diferencias en el número previo de ciclos, respuesta ovárica y número de ciclos de descongelados.
La media de embriones transferidos en el grupo estudio y grupo control fue de 2,92 y 2,93 respectivamente.
Consideramos embarazo cuando se observa en la ecografía latido fetal. Como muestra la tabla I existen diferencias significativas entre ambos grupos en el porcentaje de embarazo global 116 (19,66 %) frente a 101 (15,93 %). La tabla II compara el porcentaje de embarazos en relación a la tasa de supervivencia de la cohorte de embriones descongelados.
Tabla I: comparación de ciclos con y sin hatching
En esta tabla también observamos un mayor porcentaje de embarazos cuando realizamos hatching en embriones que tienen una tasa de supervivencia menor del 60%, en concreto 20 (15,38%) frente a 8 (6,35%).
DISCUSION
La transferencia de embriones que han sufrido un proceso de congelación-descongelación arroja una tasa de embarazo menor que con la transferencia de embriones en fresco, incluso tratándose de embriones de igual calidad (Gabrielsen et al., 2004).
Como se ha comentado anteriormente, esto puede ser debido, entre otras causas a una degeneración de blastómeras y a un endurecimiento de la zona pelúcida. Turcker et al. (1991) explicaron que la reducción de implantación en ciclos de FIV-ET puede ser debido al endurecimiento de la zona pelúcida.
Para embriones tanto frescos como descongelados el cultivo in vitro puede llevar a un endurecimiento de la zona pelúcida (Cohen et al., 1990).
En nuestro estudio hemos observado que con la transferencia de 2 embriones de calidad a los que se les practicó el hatching obtenemos tasas de embarazo equiparables a la transferencia de 3 embriones de calidad; por tanto, podríamos disminuir el número de embriones a transferir, bajando así la probabilidad de embarazo múltiple.
La tasa global de embarazo entre ambos grupos muestra diferencias significativas cuando realizamos el AH. Observamos que hay una tendencia a una tasa de embarazo mayor tras la transferencia de embriones a los que se les practicó el AH cuando no todos los embriones son de buena calidad, con lo cual estaría justificada su realización.
Gabrielsen et al. (2004) obtienen unos resultados que apoyan nuestro estudio. A pesar de ello, Al-Nuaim y Jenkins (2002) concluyeron que es inapropiada la realización por rutina por no existir evidencias del beneficio en embriones de buena calidad.
Cuando la tasa de supervivencia de los embriones descongelados es baja (<60%) es aconsejable la realización del AH, pues observamos una diferencia significativa entre ambos grupos, favorables al grupo al que se le practicó el AH.
En conclusión, el AH con ácido de Tyrode mejora considerablemente en embriones descongelados en transferencias en las que no todos los embriones son de buena calidad. Hemos paliado la mala calidad embrionaria con la aplicación del AH consiguiendo las mismas tasas de embarazo que embriones de buena calidad.
En descongelaciones en las que la tasa de supervivencia es menor del 60% también es recomendada su aplicación ya que mejora significativamente la tasa de embarazo.
Cuando la transferencia se lleva a cabo con embriones de buena calidad no se observa un incremento en la tasa de embarazo, por lo tanto no está justificada su realización por rutina. La realización del AH selectivo mejora la tasa de gestación respecto a realizarla a todos los embriones.
Referencias
Al-Nuaim LA, Jenkins JM. Assisted hatching in assisted reproduction. Br J Obstet. Gynaecol. 2002; 109:856-62.
Belil I, Vanrell I, Castelló C, et al. ¿Puede la eclosión asistida incrementar el rendimiento del ciclo de criotransferencia? Comunicación oral XXIV Congreso Nacional SEF 2002; 257.
Bernabeu R, Brotons A, Mendiola J, et al. Estado actual del conocimiento de la implantación embrionaria humana. RIF 2004; 21:167-73.
Cohen J, Elsner C, Kort H, et al. Impairment of the hatching process following IVF in the human and improvement of implantation by assisting hatching using micromanuipulation. Human Reprod 1990; 5:7-13.
Cohen MA, Lindheim SR, Sauer MV. Assisted hatching causes beneficial affects on the outcome of subsequent frozen embryo transfers of donor oocyte. Ferti. Steril 1999; 72:(Suppl 1), S5.
De Vos A, Van Steirteghem A. Zona hardening, zona drilling and assisted hatching: new achievements in assisted reproduction. Cells Tissues Organs 2000; 166:220-227.
Edi-Osagie E, Hooper L, Seif MW. The impact of assisted hatching on live birth rates and outcomes of assisted conception: a systematic review. Human Reprod 2003; 18:1828-35.
Gabrielsen A, Agerholm I, Toft B, et al. Assisted hatching improves implantation rates on cryopreserved-thawed embryos. A randomized prospective study. Hum Reprod 2004; 19:2258-62.
Ng EHY, Naveed F, Lau EYL, Yeung WSB, et al. A randomized doubleblind controlled study of the efficacy of laser-assisted hatching on implantation and pregnancy rates of frozenthawed embryo transfer at the cleavage stage. Hum Reprod 2005; 20:979- 85.
Sallam HN, Sadek SS, Agameya AF. Assisted hatching- a meta-analysis of randomized controlled trials. J Assist Reprod Genet 2003; 20:332-42.
Tao J, Tamis R. Application of assisted hatching for 2-day-old frozen-thawed embryo transfer in a poor-prognosis population. J Assist Reprod Genet 1997; 14,128-30.
Turcker MJ, Cohen J, Massey JB, Mayer, Wiker S, Wright G. Partial zona dissection of zona pellucida of frozen thawed human embryo may enhance blastocyt hatching, implantation, and pregnancy rate. Am J Obstet Gynecol 1991; 165,341-45.