EFECTO DEL PROCESO DE VITRIFICACIÓN SOBRE LA ESTRUCTURA DEL HUSO MEIÓTICO Y ORGANIZACIÓN CROMOSÓMICA EN OVOCITOS HUMANOS EN METAFASE II
Cristina Costana Duque*1, Javier Alfonso2 , Rita Cervera3, Ana Monzó1,2, Vicente Montañana1,2, Miodrag Stojkovic3 , Alberto Romeu1,2 1Unidad de Reproducción Humana (Servicio de Ginecología). Hospital Universitario la Fe, Valencia. 2Instituto de Medicina Reproductiva (IMER), Valencia. 3Laboratorio de Reprogramación Celular, Centro de Investigación Príncipe Felipe (CIPF), Valencia.
*Unidad de Reproducción Humana (Servicio de Ginecología). Hospital Universitario la Fe, Valencia. Av/ Campanar 21, 46009, Valencia.
email:cristinacostana@hotmail.com
Fecha recepción: 30 abril 2010 · Fecha aceptación: 3 mayo 2010
Resumen: El objetivo de este trabajo fue evaluar el efecto de la técnica de vitrificación utilizando el método del Cryotip™ sobre la integridad del huso meiótico y la organización cromosómica en ovocitos humanos en metafase II. La configuración del huso meiótico y de la placa metafásica de los ovocitos frescos (control) y vitrificados se evaluó mediante microscopía confocal. La tasa de supervivencia para los ovocitos desvitrificados fue del 91,6%. La proporción de ovocitos que mostró una configuración normal del huso meiótico y de la placa metafásica fue similar en ovocitos frescos y vitrificados, sugiriendo que la técnica de vitrificación con el Cryotip™ permite mantener el potencial de los ovocitos una vez desvitrificados. Rev Asoc Est Biol Rep 2010; 15(1):14-17.
Palabras clave: ovocitos metafase II, vitrificación, huso meiótico, organización cromosómica.
EFFECT OF VITRIFICATION PROCEDURE ON SPINDLE AND CHROMOSOME CONFIGURATION IN METAPHASE II HUMAN OOCYTES
Abstract: The aim of this study was to evaluate the effect of vitrification procedure using the Cryotip™ method on spindle and chromosome configurations in metaphase II human oocytes. The meiotic spindle and chromosome configurations in fresh (control) and vitrified oocytes were studied by confocal microscopy. Survival rate for vitrified oocytes was 91.6%. The proportion of oocytes showing normal spindle and chromosome configuration was similar for fresh and vitrified oocytes showing that vitrification with the Cryotip™ method supports oocyte potential after warming. Rev Asoc Est Biol Rep 2010; 15(1):14-17.
Keywords: metaphase II oocytes, vitrification, meiotic spindle, chromosome configuration
INTRODUCCIÓN
La criopreservación de ovocitos permite preservar la fertilidad en pacientes que por diversas etiologías pueden desarrollar un Fallo Ovárico Prematuro (FOP). Es el caso de exposición a agentes quimio/radioterápicos, enfermedades autoinmunes o hematológicas, o procesos quirúrgicos potencialmente esterilizantes. La criopreservación ovocitaria puede emplearse también para evitar la criopreservación de embriones, para rescatar ciclos complicados con un síndrome de hiperestimulación ovárica o con ausencia de muestra seminal el día de la punción-aspiración folicular, para evitar la sincronización donante-receptora en ciclos de donación de ovocitos o, simplemente, en mujeres fértiles que deseen posponer la maternidad.
La criopreservación ovocitaria utilizando la técnica de congelación convencional se considera un procedimiento experimental, debido a las bajas tasas de supervivencia y gestación y al limitado número de recién nacidos logrado (ASRM, 2006). Los protocolos de congelación /descongelación convencionales conllevan una reducción lenta de la temperatura en el tiempo, resultando en el daño de estructuras vitales de los ovocitos. Los microtúbulos, que conforman el huso meiótico, y los microfilamentos, localizados en el córtex ovocitario, son muy susceptibles a la temperatura de enfriamiento (chilling) y a la exposición a los crioprotectores (Boiso et al., 2002). Una alteración en estas estructuras podría conducir a una alineación cromosómica incorrecta previa a la extrusión del corpúsculo polar, a una segregación cromosómica alterada, fecundación anómala y/o a una elevada incidencia de aneuploidías.
La vitrificación combina tasas de enfriamiento del orden de -15.000º C a – 30.000º C por minuto (Liebermann et al., 2003) y concentraciones elevadas de crioprotectores, aumentando de tal manera su viscosidad que no cristaliza sino que forma un estado amorfo similar al vidrio.
La técnica de vitrificación permite burlar dos de los factores que limitan el éxito de la criopreservación: por un lado, el proceso conocido como chilling injury (Vatja and Kuwayama, 2006) y, por otro, la formación de cristales de hielo en el interior de las células (Mazur, 1984). El primero se define como el daño irreversible tras la exposición de las células a bajas temperaturas (de + 15º C a -5º C) antes de que se produzca la enucleación del hielo. En consecuencia, estructuras celulares como el citoesqueleto o las membranas celulares se ven claramente afectadas. El fenómeno del chilling puede minimizarse durante el proceso de vitrificación mediante el empleo de tasas de enfriamiento elevadas (Liebermann et al., 2003). La velocidad de enfriamiento de la muestra va a depender del volumen de la solución de vitrificación, así, a menor volumen, mayor velocidad de enfriamiento, aumentando ésta mediante la inmersión directa en nitrógeno líquido. Para evitar la formación de cristales de hielo, en la técnica de vitrificación se emplean elevadas concentraciones de crioprotectores (Liebermann et al., 2003), sin olvidar su efecto tóxico para las células. Sin embargo, una composición adecuada de crioprotectores puede solventar los efectos tóxicos y osmóticos debidos a la alta concentración de crioprotectores en la solución de vitrificación. La mezcla de crioprotectores más utilizada es la formada por etilenglicol (EG), dimetilsulfóxido (DMSO) y sacarosa.
El objetivo de este estudio fue evaluar el efecto de la criopreservación ovocitaria mediante la técnica de vitrificación con un sistema cerrado (Cryotip™) sobre la integridad del huso meiótico y la organización cromosómica en ovocitos humanos Metafase II (MII).
MATERIAL Y MÉTODOS
Ovocitos MII
A todas las pacientes que formaron parte del estudio se les aplicó un protocolo de hiperestimulación ovárica controlada que incluyó, como frenado hipofisario, agonistas de la GnRH en protocolo largo y como estimulación FSH recombinante. Los ovocitos se recuperaron por punción transvaginal ecoguiada, 36-38 horas tras la administración de la hCG. Los complejos cúmulo-ovocito fueron cultivados en medio IVF (Universal IVF Medium, Medicult, Jyllinge, Denmark) bajo condiciones de cultivo estándar (37º C y 5% de CO2). Tras al menos 2 horas de cultivo in vitro, los ovocitos fueron incubados con 80 IU/mL hialuronidasa (Hyadase, Medicult, Jyllinge, Denmark) y las células del cúmulo fueron eliminadas mediante el pipeteado mecánico de los ovocitos. Los ovocitos fueron entonces observados utilizando un microscopio invertido (x200) y los ovocitos MII se identificaron por la presencia del primer corpúsculo polar.
Se vitrificaron un total de 12 ovocitos en estadio de MII recuperados de pacientes incluidas en el Programa de Fecundación in vitro del Instituto de Medicina Reproductiva (IMER) de Valencia que firmaron el correspondiente consentimiento informado. Como grupo control (ovocitos MII no vitrificados), se incluyeron 6 ovocitos procedentes de pacientes pertenecientes al Programa de Fecundación in vitro de la Unidad de Reproducción del Hospital Universitario la Fe de Valencia, previa firma del consentimiento de participación en un Proyecto de Investigación desarrollado en el Centro de Investigación Príncipe Felipe (CIPF) de Valencia y con licencia por parte del Instituto de Salud Carlos III.
Protocolo de vitrificación
Para la vitrificación ovocitaria se utilizó el kit comercial de Irvine Scientific con el Cryotip™ como contenedor. Los ovocitos fueron equilibrados en una solución compuesta por 7.5 % (v/v) de DMSO + 7.5% (v/v) de EG + 20% suplemento sustitutivo de suero en medio 199. Posteriormente, fueron expuestos a la solución de vitrificación compuesta por 15 % (v/v) de DMSO + 15% (v/v) de EG + 0.5M de sacarosa +20% suplemento sustitutivo de suero en medio 199 y cargados en el Cryotip™. Para la desvitrificación, los ovocitos fueron expuestos a soluciones compuestas por medio 199 con concentraciones decrecientes de sacarosa (1.0M y 0.5M). La supervivencia ovocitaria se evaluó inmediatamente tras la desvitrificación y tras 4 horas de cultivo in vitro, valorándose la integridad de la zona pelúcida, la apariencia del citoplasma y la ausencia de lisis celular.
Fijación y tinción inmunocitoquímica
La fijación de los ovocitos y tinción inmunocitoquímica del huso meiótico se realizó siguiendo el protocolo descrito por Lin et al. (2008).
Brevemente, los ovocitos MII desvitrificados y frescos (grupo control) fueron fijados a 37ºC durante 1 hora en una solución de formaldehído al 2% y permeabilizados en una solución de Tritón X-100 al 0.5% durante 30 minutos a temperatura ambiente. Para la tinción de la tubulina, los ovocitos se incubaron durante 90 minutos a 37ºC en una solución de anticuerpos primarios anti-α y anti-β tubulina (1/400), seguido de 3 lavados y se incubaron durante 120 minutos a 37ºC en una solución de anticuerpo secundario Alexa 488 (1/200). Para la tinción de microfilamentos, los ovocitos se incubaron en una solución de rodamina-faloidina durante 60 minutos a temperatura ambiente. Finalmente, los ovocitos fueron montados utilizando medio de montaje con DAPI y mantenidos a 4ºC hasta su evaluación.
Evaluación del huso meiótico
Para la valoración de los microtúbulos, microfilamentos y cromosomas, se utilizó un microscopio confocal con lasser-scanning (Leica DM IRE 2) equipado con un láser de argón, perteneciente al Servicio de Microscopía Confocal del CIPF de Valencia.
RESULTADOS
Se vitrificaron y desvitrificaron 12 ovocitos MII. La tasa de supervivencia fue del 91,6% (11/12). Todos los ovocitos que sobrevivieron a la desvitrificación mostraron una apariencia morfológica normal tras 4 horas de cultivo in vitro.
Se fijaron para tinción inmunocitoquímica 10 ovocitos MII desvitrificados y 6 ovocitos MII frescos. La tasa de ovocitos informativos fue del 100% para el grupo control y del 70% para los ovocitos desvitrificados. Esta menor tasa de informatividad para ovocitos desvitrificados fue debida a problemas acontecidos durante la tinción, con independencia de la técnica de vitrificación.
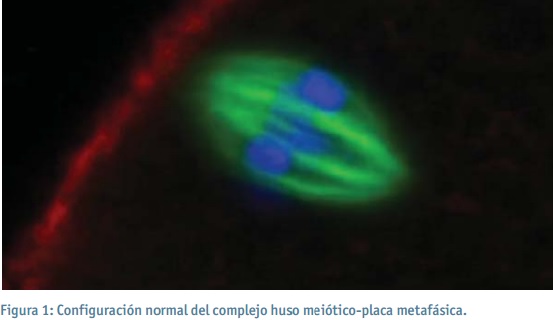
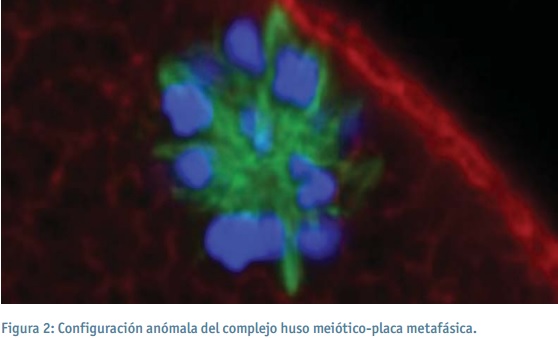
En función de la orientación del complejo huso/cromosomas respecto al plano focal, se consideró una configuración normal si: a) cuando al estar orientado de forma paralela al plano focal el huso presenta una estructura típica en forma de barril con los polos ligeramente señalados y los cromosomas dispuestos en el ecuador, b) cuando al estar orientado de forma perpendicular al plano focal el huso presenta una estructura circular con los cromosomas orientados en forma de círculo y c) cuando al estar orientado de forma oblicua al plano focal el huso presenta una estructura en forma oval (barril acortado) con los cromosomas alineados en el ecuador. Por otro lado, una configuración anómala del complejo huso/cromosomas quedó representada por una desorganización parcial o completa de los microtúbulos o por una dispersión cromosómica o apariencia cromosómica aberrante o poco condensada. En las Figuras 1 y 2 se muestran una configuración normal y una anómala del complejo huso/cromosomas, respectivamente.
La proporción de ovocitos con una configuración normal del huso meiótico y una alineación correcta de los cromosomas fue del 100% para los ovocitos del grupo control y de 85,7% para los ovocitos desvitrificados, sin que se observaran diferencias significativas entre ambos grupos.
DISCUSIÓN
En este trabajo se evalúa el efecto de la técnica de vitrificación con un sistema cerrado (Cryotip™) sobre la configuración del huso meiótico y la organización cromosómica en ovocitos humanos en estadio de MII. La integridad de este complejo es imprescindible para que se produzca una correcta segregación cromosómica y evitar así la posible aparición de aneuploidías en el embrión. Aunque sólo se observaron anomalías en el huso meiótico/cromosomas en el grupo de ovocitos desvitrificados, las diferencias no fueron estadísticamente significativas respecto al grupo control (frescos). Estos resultados son similares a los descritos en la bibliografía (Li et al., 2006; Cobo et al., 2008).
La vitrificación utilizando el Cryotip™ como contenedor permite la vitrificación de ovocitos en microvolúmenes (alrededor de 1 μL), incrementando la tasa de enfriamiento y minimizando el efecto tóxico de los crioprotectores al disminuir su concentración. El mantenimiento de la integridad del huso meiótico y de la placa metafásica tras la desvitrificación sugiere que dicha técnica de vitrificación permite preservar la calidad inicial del ovocito y el potencial necesario para soportar el posterior desarrollo embrionario.
AGRADECIMIENTOS
Este estudio ha sido parcialmente financiado por el Programa de Medicina Regenerativa del Instituto de Salud Carlos III.
Referencias
Boiso I, Martí M, Santaló J. A confocal microscopy analysis of the spindle and chromosome configurations of human oocytes cryopreserved at the germinal vesicle and metaphase II stage. Human Reprod 2002; 17: 1885-1891.
Cobo A, Pérez S, De los Santos MJ, Zulategui J, Domingo J, Remohí J. Effect of different cryopreservation protocols on the metaphase II spindle in human oocytes. Reprod Biomed Online 2008; 3: 350-359.
Li Y, Feng HL, Cao HL, Zheng GJ, Yang Y, Mullen S, Critser JK, Chen ZJ. Confocal microscopic analysis of the spindle and chromosome configurations of human oocytes matured in vitro. Fertil Steril 2006; 85 (4): 827-832.
Liebermann J, Dietl J, Vanderzwalmen P, Tucker MJ. Recent developments in human oocyte, embryo and blastocyst vitrification: where are we now? Reprod Biomed Online 2003; 7: 623-633
Lin T, Tsay C, Chen C, Tang P, Ju J. Nuclear and cytoskeletal dynamics during oocyte maturation and development of somatic cell cloned pig embryos injected with membrane disintegrated donor cells. Anim Reprod Sci 2008; 103: 107-119.
Mazur P. Freezing of living cells: mechanisms and implications. Am J Physiol 1984; 247: C125-42
The Practice Committee of the American Society for Reproductive Medicine. Practice Committee of the Society for Assisted Reproductive Technology. Ovarian tissue and oocyte cryopreservation. Fertil Steril 2006; 86: S142-7
Vatja G, Kuwayama M. Improving cryopreservation systems. Theriogenol 2006; 65: 236-244.