ESTUDIO GENÉTICO PREIMPLANTACIONAL EN PACIENTES PORTADORES DE TRANSLOCACIÓN ROBERTSONIANA (13;14)
Hebles, M.; Dorado, M.; Migueles, B.; González, M; Aguilera, L.; Núñez, G.; Lara, J.; Rodríguez, A.; Sánchez, F. y Sánchez, P. Clínica Ginemed. Sevilla .
mhebles@ ginemed.es
Resumen: En pacientes portadores de translocaciones Robertsonianas (13;14) se observa una mayor tasa de abortos. El análisis cromosómico de los espermatozoides por FISH en estos pacientes, describe la proporción de espermatozoides normales que nos podemos encontrar en el eyaculado de los mismos. Esta proporción se ajusta al número de pre-embriones normales que se obtienen en estas parejas tras someterlas a un ciclo de Fecundación in Vitro y posterior diagnóstico genético preimplantacional.
El objetivo del presente trabajo es establecer la relación entre el análisis cromosómico de los espermatozoides por FISH y la tasa de pre-embriones genéticamente normales en pacientes portadores de una traslocación Robertsoniana (13;14).
PREIMPLANTATION GENETIC DIAGNOSIS OF ROBERTSONIAN TRASLOCATION CARRIERS
Summary: There is a higher miscarriage rate in patients with robertsonian translocations. The chromosomal analysis by FISH in the spermatozoa of these patients describes the percentage of normal spermatozoa that we can find in the ejaculate. From the relevant literature it has been shown that this proportion is comparable to the rate of normal embryos that can be found in a preimplantation genetic diagnosis IVF cycle.
The aim of this study is to determine the correlation between the chromosomal analysis of spermatozoa by FISH and the percentage of chromosomically normal embryos analysed by PGD in an IVF cycle in patients with Robertsonian translocations.
INTRODUCCIÓN
Las translocaciones estructurales cromosómicas son comunes en la población humana (Nielsen and Wohlert, 1991). Dentro de las translocaciones estructurales, las más frecuentes son las translocaciones Robertsonianas, con una frecuencia de 1 caso cada 1000 nacidos (Gardner and Sutherland,1996). Esta proporción se ve aumentada en el caso de los varones estériles estando asociadas a casos de oligospermia (Chandley, 1998).
La translocación Robertsoniana fue descrita en 1916 por W. Robertson y representa la fusión pericéntrica entre 2 cromosomas acrocéntricos , es decir, entre los cromosomas 13,14,15,21 y 22. El resultado es un único cromosoma anómalo, generalmente dicéntrico, conteniendo el brazo largo de los cromosomas implicados con pérdida de los brazos cortos (R.J.M. Gardner, G. R. Sutherland. 2º ed. New Cork; 1996 ). Las combinaciones más frecuentes son entre los cromosomas 13 y 14 y entre los cromosomas 14 y 21. La translocación (13;14) es la más frecuente, con una incidencia de 0.7 cada 1000 nacidos (Nielsen and Wohlert, 1991).
Las translocaciones Robertsonianas pueden ocurrir de novo en aproximadamente el 50% de los casos, o ser trasmitida por los progenitores. Como consecuencia de este tipo de translocaciones se puede ver afectada la fertilidad, observándose distintos grados de oligoastenoteratozoospermias, y/o el desarrollo del embarazo, debido a una posible alteración de la gametogénesis y/o a la producción de gametos con una combinación no balanceada. Un zigoto no balanceado puede presentar monosomía o trisomía.
El uso combinado del análisis espermático por técnica de fluorescencia in situ (FISH) junto al diagnóstico genético preimplantacional (DGP), es de gran utilidad en parejas portadoras de dicha translocación.
El análisis espermático por FISH puede ser de gran utilidad para describir la proporción de gametos anormales en hombres portadores de una translocación Robertsoniana, así como para prever la segregación espermática (Estop et al., 1996; Blanco et al., 1998).
El PGD, desarrollado para el tratamiento de parejas con riesgo de trasmitir alteraciones genéticas a sus descendientes, nos permite la selección de embriones no afectos, siendo una alternativa al diagnóstico prenatal.
En el presente trabajo, exponemos la experiencia en dos ciclos de PGD por varón portador de una translocación Robertsoniana entre los cromosomas 13 y 14. La segregación meiótica de los cromosomas 13 y 14 fue analizada en los embriones, y comparada con las anomalías observadas en los espermatozoides.
MATERIAL Y MÉTODOS
El estudio fue realizado a dos parejas que acudieron a la Unidad de Reproducción de la clínica Ginemed, tras varios años de esterilidad y abortos repetidos en ambos casos.
Tras la anamnesis inicial de la pareja, fueron solicitadas pruebas hormonales, serológicas así como cariotipo a ambos miembros de la pareja y estudio seminal al varón.
El cariotipo en sangre periférica se realizó en la Unidad de Genética de la Clínica Ginemed mediante cultivo de linfocitos en medio PB-Max y tinción de bandas G.
El estudio seminal se realizó en la Unidad de Andrología según protocolo de la Organización Mundial de la Salud (OMS-99).
La paciente 1 tenía 36 años de edad. Su pareja, con 38 años, presentaba un cariotipo con una translocación entre los cromosomas 13 y 14: 45 XY, t (13,14) (q10;q10) . Tras el análisis espermático fue diagnosticado de oligoteratozoospermia severa y astenozoospermia moderada.
La paciente 2 presentaba 38 años de edad, y su pareja, con 37 años era portador de una translocación entre los cromosomas 13 y 14: 45 XY, t (13;14)(q10;q10). En este caso, el varón presentaba un recuento y una motilidad espermática normal con una teratozoospermia severa.
En ambos casos, las mujeres presentaban un cariotipo 46 XX, y era el primer ciclo de Fecundación in Vitro al que se sometían tras haber sufrido 2 abortos en el primer caso y 3 en la segunda pareja.
ANÁLISIS DE FISH EN ESPERMATOZOIDES
El FISH en espermatozoides se realizó según protocolo estándar (Munné et al, 1998), empleando una mezcla de hibridación que contiene un Indicador Locus Específico (LSI) para el cromosoma 13, visualizándose a la luz naranja, y teloméricas para 14q en el espectro verde.
Las muestras seminales fueron fijadas con la mezcla metanol: acético 3:1. Posteriormente, los portas con las muestras fijadas fueron incubados en la solución dithiothreitol (DDT)/ Triton X- 100 al 1%. A continuación se realizó una hibridación con mezcla de sonda para los cromosomas 13 y 14.
Los portas con las muestras fueron observados en un microscopio de fluorescencia (Nikon E-400) con los filtros apropiados para la visualización de los cromosomas.
ESTIMULACIÓN OVÁRICA
En ambos casos se realizó una estimulación ovárica utilizando un protocolo largo tras un mes de reposo ovárico con anticonceptivos. Para la supresión se ha utilizado análogos de la GnRH (Synarel diario ®) desde la mitad de la fase lútea previa a dosis de 1 pulverización cada 12 horas intranasal. Según los niveles séricos de FSH, LH y estradiol y en función de la edad de la paciente se fijan las dosis de estimulación ovárica con hormona folículo estimulante (FSH) (Gonal-F ®) Y Menotropina (HMG Lepori ®). La administración de estos se individualiza de acuerdo al control ecográfico del ciclo. El criterio para la administración de la hormona gonadotrófica humana (1000 UI HCG) (HCG Lepori ®) es la presencia de al menos dos folículos de 16 mm. De diámetro. La administración de aGnRH y FSH se suspende el día de la administración de la HCG.
Las punciones se realizaron a las 36 horas de la administración de la HCG por vía vaginal ecoguiada.
Las muestras usadas para ICSI se prepararon mediante combinación de dos procedimientos: gradientes de densidad en capas de 0.3 a 1 ml de 40% y de 0.3 a 1 ml de 80% de Sperm Grad (Vitrolife ®) y Ham F-10 (Gibco) con gentamicina, seguido por un swim-up usando como medio final Gamete (Vitrolife ®).
La microinyección se realizó entre las 3 y 6 de la captación oocitaria descrita en detalla por Svalander et al. Previamente el cúmulo fue eliminado con HYASE 10 en G-Mops en microgotas de 25 μL durante segundos y finalmente pasando repetidas veces por micropipetas de distinto diámetro en G-Mops. La fecundación se evaluó a las 16-20 horas. A los tres días de la punción se evaluaron los preembriones, realizándose la biopsia en aquellos donde estaba indicado.
DIAGNÓSTICO GENÉTICO PREIMPLANTACIONAL
Pareja 1: Se procedió a la biopsia de 4 pre-embriones que en día +3 estaban en estadío de ocho células.
Pareja 2: Se biopsiaron un total de 12 pre-embriones que en día +3 tenían un número de células mayor de 6.
Una célula por embrión fue biopsiada y posteriomente fijada según la técnica de Tarkoswky(1996) : metanol:acético (3:1). Una vez fijadas las blastómeras, fueron analizadas por FISH, estudiándose los cromosomas 13, 16, 18, 21, X e Y.
RESULTADOS
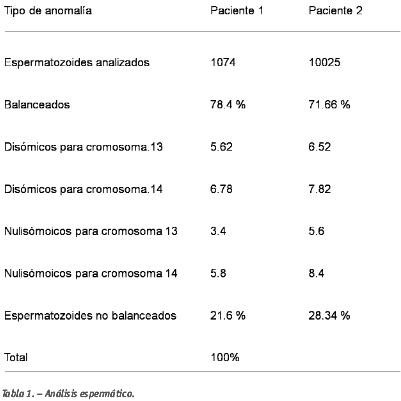
Tras la realización del FISH en las muestras seminales de ambos pacientes se obtuvieron los siguientes resultados: en la pareja 1 se observó que un 5.62% de los espermatozoides estudiados presentaban disomía para el cromosoma 13 y un 6.78% de los espermatozoides eran disómicos para el cromosoma 14. Para la pareja 2 se observó que un 6.52% de los espermatozoides eran disómicos para el cromosoma 13 y un 7.82% de ellos presentaban disomías para el cromosoma 14 (Tabla 1).
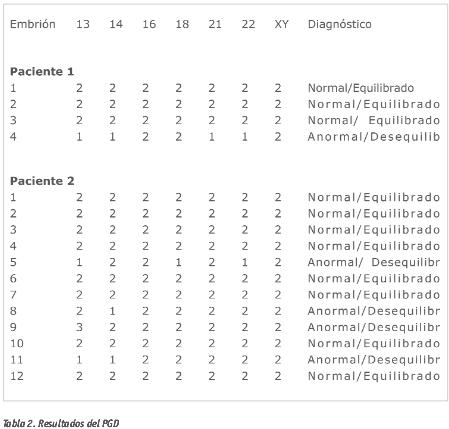
Respecto a los pre-embriones biopsiados, a la pareja 1 se le biopsiaron un total de 4 pre-embriones siendo 3 de ellos equilibrados y 1 desequilibrado.
A la pareja 2 se le biopsiaron un total de 12 pre-embriones, con 5 de ellos equilibrados y un pre-embrión equilibrado pero no informativo para el cromosoma 16. (Tabla 2).
Las aneuploidías para los cromosomas implicados fueron monosomías para el cromosoma 14 y monosomías/trisomías para el cromosoma 13.
Un 75% de los preembriones analizados en el caso de la paciente 1 y un 66% en el caso de la paciente 2 no presentaban anomalías en los cromosomas implicados en la translocación. Esto es similar a las anomalías detectadas en los espermatozoides en ambos casos (78.4% en la pareja 1 y 72% en la pareja 2).
En ambos casos se realizó una transferencia de 2 pre-embriones, criopreservándose los restantes por la técnica de vitrificación, según protocolo de Kuwayama M. (Kuwayama M., 2007).
DISCUSIÓN
El análisis espermático por FISH nos da información acerca de la proporción de espermatozoides normales en pacientes portadores de anomalías cromosómicas. Mediante este análisis también podemos predecir la proporción de gametos con anomalías que nos vamos a encontrar tras la realización de un ciclo de fecundación in Vitro y posterior diagnóstico preimplantacional.
Los pre-embriones resultantes de la fecundación de espermatozoides portadores de una translocación robertsoniana entre los cromosomas 13 y 14 pueden ser portadores de cromosomas derivados dicéntricos que se han formado como consecuencia de roturas en los brazos cortos de ambos cromosomas ( Han JY, et al). Estos preembriones, si no son analizados, pueden dar lugar a abortos repetidos.
Mediante la combinación de un ciclo de Fecundación in Vitro seguido de un Diagnóstico Genético Preimplantacional, se realiza una selección de aquellos preembriones “normales” o equilibrados, pudiendo evitar así el aborto que sufren estas parejas.
En nuestro estudio tras el análisis del PGD se observa que aunque el número de gametos equilibrados en ambos casos (75% y 66%) es comparable con la proporción de espermatozoides normales en el eyaculado (78.4% y 71.66). Otras anomalías de los preembriones pueden ser debidas a factores oocitarios y/o efectos post-meióticos.
Este trabajo muestra que la proporción de pre-embriones anormales debido a la traslocación Robertsoniana (13;14) es similar a la proporción de espermatozoides anormales encontrados en los varones portadores de la translocación. Así, el análisis espermático mediante la técnica de FISH sería de gran utilidad para predecir el número de pre-embriones normales que nos encontraríamos tras la realización de un ciclo de Fecundación in Vitro en parejas portadoras de la translocación. Esto nos permite que mediante una prueba sencilla y barata, orientar a las parejas sobre el número de pre-embriones sin anomalías que se podrían esperar tras un tratamieno de reproducción asistida. En aquellos casos en los que el número de espermatozoides con anomalías sea muy alto, se puede indicar el uso de un semen de donante.
Referencias
1.- Nielsen J, Wohlert M. 1991. Chromosome abnormalities found among 34,910 newborn children: results from a 13- year incidence study in Arhus, Denmark. Hum Genet 87: 81-83.
2.- Gardner, R.J.M. and Sutherland, G.R. (1996) Chromosome Abnormalities and Genetic Counselling. 2nd end, Oxford University Press, Oxford.
3.- Chandley AC. 1998. Meiotic studies anf fertility in human traslocation carriers. In: The Cytogenetics of Mammalian Autosomal Rearrangements, Daniel A. (ed). A.R. Liss: New York, 361 - 382.
4.- Guichaoua MR, Quack B, Speed RM, Noel B, Chandley AC, Luciani JM. 1990. Infertility in human males with autosomal traslocations: meiotic study of a 14; 22 Robertsonian traslocation. Human Genet 86: 162 - 166.
5.- Estop AM, Van Kirk V, Cieply K. 1996. Segregation analysis of four traslocations, t (2;18), t (3;15), t (5;7) and t (10;12), by sperm chromosome studies and review of the literature. Cytogenet Cell Genet 70: 80 - 87.
6.- Svalander P, Forsberg AS, Jakobsson AH, and Wikland M.: Factor of importance for the establishment of a sucessful program of intracytoplasmic sperm injection treatment for male infertility. Fertil. Steril. 1995; 63: 827 - 837.
7.- Han JY, Choo KH, Shaffer LG. 1994. Molecular cytogenetic characterization of 17 rob (13q 14q) Robertsonian traslocation by FISH, narrowing the region containing the breakpoints. Am J Hum Genet 55: 960-967.
8.- Kuwayama M. Highly efficient vitrification for cryopreservation of human oocytes and embryos: the cryotop method. Theriogenology 2007 Jan 1; 67 (1): 73 - 80.