IMPLICACIÓN DE LA TÉCNICA MSOME EN CICLOS DE OVODONACIÓN
Cristina Urda, Ana R. Díaz, Mª Carmen Cañadas, Vicente Badajoz, Silvia Camacho, Moisés de la Casa, Julio Gijón, Jose A. Gragera, Ricardo Bonache y Alberto Martínez de Arenaza
Clínica Ginefiv. Madrid
email:c.urda@ginefiv.com
Fecha recepción: 29 Septiembre 2010 · Fecha aceptación: 23 Febrero 2011
Resumen: El objetivo de este estudio fue evaluar si es posible una mejor selección espermática con la técnica MSOME. Para ello, se compararon de manera retrospectiva 245 ciclos de ovodonación, 119 con IMSI y 126 con ICSI. Todas las muestras usadas para la microinyección fueron diagnosticadas como teratozoospérmicas.
Nuestros resultados muestran que el uso de la técnica MSOME supone un aumento significativo de las tasas de implantación (grupo IMSI: 36%; grupo ICSI: 25%), así como de las de gestación (grupo IMSI: 55%; grupo ICSI: 38%). Concluimos, por tanto, que la técnica MSOME es una herramienta válida para seleccionar espermatozoides cuando trabajamos con muestras teratozoospérmicas. Rev Asoc Est Biol Rep 2011; 16(1):19-23.
Palabras clave: técnica MSOME, donación de óvulos, teratozoospérmicas, implantación, gestación.
IMPLICATIONS OF MSOME METHOD IN OVODONATION CYCLES
Summary: The aim of this study was to assess that if by applying the MSOME method a better sperm selection could be possible. To prove this, a comparative retrospective study was completed with a total of 245 ovodonation cycles, 119 with IMSI and 126 with ICSI. All the sperm samples used for the microinjection were diagnosed as teratozoospermia.
Our results show that implantation rates (IMSI group: 36%; ICSI group: 25%), and pregnancy rates (IMSI group: 55%; ICSI group: 38%) are significantly higher when the MSOME method is used. Therefore, in conclusion, we identify the MSOME method as a valid tool for spermatozoa selection in samples with teratozoospermia. Rev Asoc Est Biol Rep 2011; 16(1):19-23.
Keys words: MSOME method, oocyte donation, teratozoospermia, implantation, pregnancy.
INTRODUCCIÓN
Tras el desarrollo del MSOME (Evaluación de la Morfología de los orgánulos de Espermatozoides Móviles), la morfología normal del núcleo espermático fue definida por la forma simétrica y oval, por la textura lisa, así como por el contenido de una masa cromática homogénea sin presencia de invaginaciones, intrusiones y con menos del 4% del área nuclear ocupado por vacuolas. Según Bartoov et al. (2002), con menos de un 20% de espermatozoides con núcleo morfológicamente normal, no se conseguían embarazos a término, demostrando la gran importancia de la forma y contenido del núcleo espermático en los resultados de un ciclo. Una pequeña desviación de la morfología de la cabeza puede llegar a dar embarazo; sin embargo, superar el umbral de vacuolas establecido por Bartoov et al., en 2002, puede acabar en aborto (Berkovitz et al., 2005) y se ha correlacionado con una menor capacidad de desarrollo hasta blastocisto (Vanderzwalmen et al., 2008).
La presencia de vacuolas puede reflejar defectos moleculares responsables de las anomalías que se producen en el empaquetamiento de la cromatina del espermatozoide durante la maduración espermática, y por lo tanto hacer al espermatozoide más vulnerable a sufrir daños en su ADN e interferir en el desarrollo embrionario a partir del día 3 de desarrollo (Cayli et al., 2003; Vanderzwalmen et al., 2008). Aunque no se han observado diferencias significativas en las calidades embrionarias al comparar grupos ICSI-IMSI (Hazout et al., 2006; Mauri et al.,2008) o grupos IMSI entre sí (Berkovitz et al., 2006a), los resultados en términos de implantación y embarazo han sido significativamente mejores en los ciclos donde se realizaba una selección espermática más estricta (Antinori et al., 2008; Bartoov et al., 2003; Berkovitz et al., 2005, 2006a,b; Hazout et al., 2006; Mauri et al., 2008).
La fragmentación del ADN se ha posicionado como un parámetro objetivo y fácil de diagnosticar, siendo responsable de muchos de los fallos de ICSI por factor masculino (Evenson et al., 2002). La presencia de grandes vacuolas en la cabeza espermática, se ha relacionado con mayores tasas de fragmentación (Franco et al., 2008), así como con una peor función mitocondrial y existencia de aneuploidías (Garolla et al., 2008).
En parejas con oligoastenoteratozoospermias severasy elevada fragmentación de ADN se ha visto que la utilización del IMSI (inyección intracitoplasmática de espermatozoides seleccionados morfológicamente), después de 2 o más ciclos fallidos de FIV-ICSI, supone un aumento significativo en las tasas de embarazo e implantación, así como una reducción en las tasas de abortos cuando se compara con grupos controles donde se realiza microinyección convencional (Antinori et al., 2008; Bartoov et al., 2003; Berkovitz et al.,2006b; Hazout et al., 2006). Sin embargo, para Berkovitz et al. (2005) los resultados del primer ciclo ya están condicionados por la morfología espermática. En este sentido, el MSOME permite excluir, en la selección para ICSI, a espermatozoides con defectos nucleares y disminuye la probabilidad de inyectar ovocitos con ADN dañado (Vanderzwalmen etal., 2008).
Basándonos en esta revisión bibliográfica, el objetivo de este estudio, unicéntrico y retrospectivo, fue demostrar que una selección más estricta de los espermatozoides mediante la óptica del MSOME, mejora los resultados de ciclos de ovodonación cuando trabajamos con muestras teratozoospérmicas.
MATERIALES Y MÉTODOS
Se analizaron de forma retrospectiva 245 ciclos de ovodonación llevados a cabo en nuestro centro en el año 2009. Por petición de las pacientes, en 119 ciclos se realizó IMSI, mientras que en los 126 ciclos restantes, ICSI. Todas las muestras usadas para la microinyección fueron diagnosticadas como teratozoospérmicas
Metodología FIV-ICSI. Las receptoras se sometieron a supresión hipofisaria, y/o preparación endometrial con estrógenos. La fase lútea se apoyó con dosis de progesterona, vía oral o vía vaginal. Confirmada la gestación, la administración de estrógenos y progesterona se mantuvo hasta un máximo de 100 días. Tras el frenaje ovárico de la donante, la estimulación ovárica controlada comenzó con dosis de FSHr (100 uI-225 uI), en pauta con antagonistas. La punción ovárica se programó con la visualización de 2-3 folículos superiores a 17mm, administrando bolo de GnRH análogo 32/48 horas previas a la punción ovárica.
Las muestras seminales fueron obtenidas por masturbación. Se diagnosticaron siguiendo los parámetros de la OMS 1999 y se procesaron en un periodo máximo de 1 hora, manteniéndolas siempre a 37ºC. Si las muestras eran criopreservadas, para la congelación se utilizó criopreservante Sperm Frezee™ FertiPro. La capacitación se hizo mediante columnas de gradientes con medios de cultivo de la serie Vitrolife.
Tras la punción, la recuperación y decumulación de los complejos cúmulo-ovocito, se realizó la microinyección siguiendo el protocolo habitual. Los ovocitos microinyectados se cultivaron de forma individualizada, hasta el día de la transferencia, en placas NUNC IVF 35×10 utilizando medios de cultivo Vitrolife.
A las 18-20h post inseminación, se evaluó la fecundación mediante la visualización de 2 pronúcleos y 2 corpúsculos polares. La tasa de fecundación se calculó considerando los ovocitos correctamente fecundados, respecto del total inseminados. La división de los zigotos se evaluó y categorizó siguiendo las pautas de la Asociación para el Estudio de la Biología de la Reproducción (ASEBIR). El porcentaje de embriones de calidad A+B se calculó respecto al número total de embriones viables en día 3 de desarrollo. En este mismo día se realizó la transferencia en todos los casos.
A los 14 días de la transferencia ecoguiada se realizó la β-hCG para confirmar embarazo. Se consideró gestación clínica la visualización de latido cardiaco. Cuando la gestación no llegó a término fue considerada aborto. El porcentaje de implantación se calculó tomando el número de sacos gestacionales respecto al total de embriones transferidos; y el porcentaje de gestación considerando el número de embarazos clínicos respecto al total de transferencias realizadas. El número de abortos representa el número de embarazos no llegados a término respecto al total de gestantes.
Selección espermática. En el grupo IMSI, la selección espermática se hizo a temperatura ambiente y con microscopio invertido Nikon Eclipse Ti acoplado al sistema MSOME, utilizando placas 50×40 Willco-Dish. Se siguieron los criterios y el protocolo de Bartoov et al., 2002, 2003.
El sistema MSOME está basado en cuatro parámetros principales: un objetivo de 100x, un selector de aumento de 1,5x, un acoplador de magnificación de 0,99x acoplado a una cámara, y un magnificador de la imagen de 44,45x, mediante el cual la morfología espermática puede ser visualizada a 6600 aumentos (100 x 1.5 x 0.99 x 44.5) sin necesidad de tinción y a tiempo real (Bartoov et al., 2002).
En el grupo ICSI, la selección se llevó a cabo bajo el objetivo 40x en un microscopio Nikon Eclipse TE2000S con placa calefactada a 37ºC.
Estudio estadístico. El análisis de los datos se realizó con el paquete estadístico SPSS XVI. Se utilizó un estadístico de contraste, la prueba de independencia de χ2, estableciendo como nivel de significación el p valor 0,05.
RESULTADOS
1. Muestras Seminales
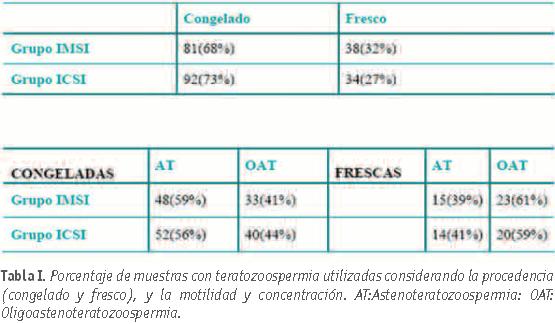
Grupo IMSI. En el 68% (81) de los ciclos las muestras procedieron de eyaculados congelados y en el 32% (38) de eyaculados frescos. Dentro de las muestras congeladas, el 59% (48) presentaron astenozoospermia y teratozoospermia y el 41% (33) oligoastenozoospermiay teratozoospermia. En las muestras en fresco, el 39% (15) presentó astenozoospermia y teratozoospermia,y el 61% (23) oligoastenozoospermia.
Grupo ICSI. En el 73% (92) de los ciclos las muestras procedieron de eyaculados congelados y en el 27% (34) de eyaculados frescos. El 56% (52) de las muestras congeladas presentaron astenozoospermia y teratozoospermia, y el 44% (40)
oligoastenoteratozoospermia. El 41% (14) de los eyaculados frescos presentaron asteno y teratozoospermia, y el 59 % (20) oligoastenozoospermia y teratozoospermia.
No se han observado diferencias significativas entre la utilización de muestras congeladas y frescas entre ambos grupos, al igual que tampoco las ha habido al comparar la calidad seminal; p>0,05,tabla 1.
2. Resultados FIV-ICSI
Grupo IMSI. Se inseminaron 1492 ovocitos. La tasa de fecundación (2PN y 2CP) fue del 62%. El número de embriones totales el día de la transferencia fue de 5,5 ± 2,5 por paciente. En 115 (96%) ciclos se hizo transferencia. De las 5 (4%) pacientes que transfirieron un único embrión, 4 fueron transferencias selectivas. En total, se transfirieron 225 embriones, siendo el 54% embriones de categoría A+B. El 36% de los embriones transferidos fue capaz de implantar. En el 30% (19) de los ciclos se visualizaron dos sacos gestacionales. En total 63 pacientes quedaron gestantes, terminando 13 en aborto.
Grupo ICSI. Se inseminaron 1508 ovocitos. La tasa de fecundación en 2PN y 2CP fue del 60%. La transferencia se llevó a cabo en 117 (93%) ciclos, en 6 de los cuales (5%) se transfirió un solo embrión (5 fueron transferencias selectivas). De los 228 embriones viables el día de la transferencia, el 58% fueron de categoría A+B. El 25% de los embriones transferidos consiguieron implantar. Similar al grupo IMSI, en el 29% (13) de los casos se confirmó gestación múltiple. Hubo 45 gestaciones y 7 no lograron llegar a término. No se han observado diferencias significativas entre ambos grupos en ninguno de los siguientes parámetros: tasa de fecundación, calidad embrionaria (tipo A+B) y número de embriones transferidos; p>0,05. Se observaron diferencias significativas entre las tasas de implantación (36% en el grupo IMSI; 25% en el grupo ICSI; p<0,05), al igual que en la tasa de gestación (55% grupo IMSI; 38% en el grupo ICSI; p<0,01). La tasa de embarazo múltiple, aunque no se estudió mediante un cálculo estadístico, aparece equiparable entre ambos grupos. Respecto a la tasa de aborto, aunque se observa una tendencia al alza en el grupo IMSI, no se vieron diferencias significativas entre ambos grupos; p>0,05.tabla 2.
DISCUSIÓN
El efecto paterno ha sido valorado en los ciclos de FIV-ICSI usando como modelo la recepción ovocitaria (Tesarik, 2005). Con la introducción del MSOME, se han desarrollado estudios retrospectivos (Berkovitz et al., 2006a), prospectivos (Antinori et al., 2008; Bartoov et al., 2002) y/o randomizados (Mauri et al.,2008), con el fin de poder testar los beneficios de la IMSI en los resultados de un ciclo de FIV. Sin embargo, este estudio es el primero en el que se comparan de forma retrospectiva ciclos de IMSI e ICSI utilizando un modelo de ovodonación.
En todos los casos, las muestras seminales tuvieron más de dos parámetros afectados, siendo la teratozoospermia el diagnóstico común. Los datos, analizados estadísticamente, muestran que las diferencias obtenidas entre los grupos IMSI e ICSI no están influenciadas ni por la procedencia de la muestra (congelada o fresca), ni por los parámetros de motilidad y concentración. Todos los ciclos se realizaron en el mismo periodo de tiempo, bajo idénticas condiciones de selección de pacientes, estimulación ovárica, calidad espermática y equipo material y humano. La única diferencia entre grupos fue el tipo de óptica y el protocolo para la selección de los espermatozoides. Teniendo en cuenta que la morfología espermática se ha posicionado como un parámetro clave para predecir los resultados de un ciclo de reproducción asistida (Bartoov et al., 1994, 2002, 2003; de Vos et al., 2003), nuestros datos nos llevan a proponer la técnica del MSOME como una herramienta válida para llevar a cabo la selección espermática previa a la microinyección.
La literatura y nuestra propia experiencia sugieren que existen malformaciones en el espermatozoide capaces de dar lugar a embarazos, incluso en casos de teratozoospermia total (Berkovitz et al., 2005). Sin embargo, el aumento significativo de las tasas de implantación y gestación en el grupo IMSI apoyan la idea de que a 400 aumentos existen defectos que no pueden ser detectados (Bartoov et al., 2002). Al igual que otros estudios, podemos concluir que una buena morfología espermática, así como intentar microinyectar espermatozoides libres de vacuolas nucleares, aumenta las posibilidades de éxito (Berkovitz et al., 2006a; Hazout et al., 2006; Vanderzwalmen et al., 2008).
La evaluación con MSOME de muestras con indicación para ICSI, muestra que solamente el porcentaje de espermatozoides vacuolados se sitúa en torno al 40% (Berkovitz et al., 2006a), y en el 22% de los casos no es posible encontrar ningún espermatozoide morfológicamente normal (Bartoov et al., 2003), aunque otros autores documentan que esto ocurre en el 50% de los casos (Vanderzwalmen et al., 2008).
En nuestro laboratorio, el porcentaje de vacuolización de las muestras usadas para ICSI no fue valorado previamente con MSOME, pero, si tenemos en cuenta lo anteriormente expuesto, la probabilidad de seleccionar espermatozoides con un bajo potencial implantatorio es más alta en el grupo ICSI. De esta manera, apoyamos que una mejor selección supone una mejora de resultados (Bartoov et al., 2002), y que la calidad de la muestra no es representativa del espermatozoide
seleccionado (de Vos et al., 2003).
Estudiando espermatozoides de manera individualizada, se ha relacionado la morfología con bajas tasas de implantación y embarazo, y, a su vez, con defectos cromosómicos que pudieran ser transferidos al embrión (de Vos et al., 2003; Garolla et al.,2008). La zona pelúcida presenta una alta sensibilidad a ser penetrada por espermatozoides portadores de anomalías cromosómicas (Liu and Baker et al., 2007), pero en ciclos de microinyección se llegan a conseguir buenas tasas de fecundación y calidad embrionaria, aún microinyectando con muestras con elevada fragmentación en el ADN espermático (Larsonet al., 2000). Pero, eliminar esta selección natural puede jugar un papel importante en el desarrollo embrionario (Vanderzwalmen et al., 2008).
Usando un modelo de donación de ovocitos se han distinguido dos tipos de efectos paternos: un efecto temprano implicado en el proceso post-fecundación, visible en el estadio de pronúcleos, y un efecto tardío que, sin producir alteraciones en la velocidad de desarrollo y morfología embrionaria, haría disminuir las tasas de implantación (Tesarik et al.2004, 2005). El efecto paterno tardío ha sido relacionado con los daños en el DNA, provocando que la expresión genómica embrionaria se paralice alrededor de las 72 horas post-fecundación (Vanderzwalmen et al., 2008).
Independientemente de la óptica usada para la selección espermática (Hoffman o Nomarski), la tendencia ha sido observar igualdad en las tasas de fecundación y calidades embrionarias, pero microinyectar con espermatozoides anormales, y
sobre todo cuando éstos presentan alta vacuolización, genera embriones con bajo potencial implantatorio (Antinori et al., 2008; Berkovitz et al., 2006a; Hazout et al., 2006; Mauri et al., 2008). Nuestros resultados no difieren de los mostrados por estos autores, las tasas de fecundación se mantienen similares entre ambos grupos (grupo IMSI: 62%; grupo ICSI: 60%), a igualdad de embriones transferidos (grupo IMSI: 225; grupo ICSI: 228) y calidades embrionarias tipo A+B (grupo IMSI: 54%; grupo ICSI: 58%), y aunque observamos una tendencia al alza respecto a la calidad embrionaria en el grupo ICSI, las diferencias observadas suponen un aumento del 11% en las tasas de implantación (grupo IMSI: 36%; grupo ICSI: 25%) y un 17% en las de gestación (grupo IMSI: 55%; grupo ICSI: 38% ) en el grupo IMSI. En relación a la disminución de los abortos, expuesto por otros autores cuando se realiza IMSI, la única explicación es pensar que cuando se realizó el estudio estadístico, más de la mitad de los embarazos no habían llegado a término, lo que nos lleva a no observar diferencias significativas.
La IMSI podría ser un buen método para excluir de la selección a espermatozoides vacuolados que pudiesen portar algún tipo de anomalía cromosómica responsable del mal desarrollo embrionario. Sin embargo, la técnica se enfrenta a los inconvenientes de suponer una inversión económica por parte del centro para la adquisición del equipo, y una puesta a punto de la técnica por parte del equipo humano del laboratorio, además de un aumento significativo del tiempo empleado por caso para la selección de espermatozoides.
Optimizar la selección de gametos es la mejor herramienta con la que contamos los embriólogos, por lo que proponemos el MSOME como un buen método de selección espermática, mediante el cual podemos ofrecer a las parejas una técnica de microinyección más pulida. Y concluimos que, en nuestro laboratorio, el MSOME ha supuesto una ventaja para parejas que se someten a ciclos de ovodonación con muestras teratozoospérmicas.
Referencias
Antinori, Licata e, Dani G, Cerusico F, Versaci C, d ́Angelo D, et al.Intracytoplasmic morphologically selected sperm injection: a prospective randomized trial. Reproductive Biomedicine online 2008; 16:835-841
Bartoov B, Berkovitz A,eltes F, Kogosovsky A,yagoda A, Lederman H, et al. Pregnancy rates are higher with intracytoplasmic morphologically selected sperm injection than with conventional intracytoplasmic injection. Fertility and sterility 2003; 80:1413-1419.
Bartoov B, Berkovitz A,eltes F. Real-Time fine morphology of motile human sperms cells is associated with IVF-ICsI outcome.Journal of Andrology 2002; 23:1-8
Bartoov B,eltes F, Pansky. Improved diagnosis of male fertility potential via a combination of quantitative ultramorphology and routine semen analysis. Human Reproduction 1994; 9:2069-2075
Berkovitz A,eltes F,ellenbogen A. Does the presence of nuclear vacuoles in human sperm selected for ICsI affect pregnancy outcome? Human Reproduction 2006a; 21:1787-1790
Berkovitz A,eltes F, Lederman H, Peers,ellenbogen A, Feldberg B, et al. How to improve IVF-ICsI outcome by sperm selection. Reproductive Biomedicine online2006b; 12(5): 634-638
Berkovitz A,eltes F,yaaris, Katzn, Barr Ilya, Fishman A, et al. The morphological normalcy of sperm nucleus and pregnancy rate of intracytoplasmic injection with morphologically selected sperm. Human Reproduction 2005; 12(1):185-190
Caylis, Jakab A, Ovari L, Delpiano e, Celik-Ozenci C,sakkas D, et al. Biochemical markers of sperm function: male fertility and sperm selection for ICsI. Reproductive Biomedicine online 2003; 7(4):462-468.
De Vos A, Van de Velde H, Joris H. Influence of individual sperm morphology on fertilization, embryo morphology, and pregnancy outcome of intracytoplasmic sperm injection. Fertility and sterility 2003; 79(1): 43-48
evenson D.P, Kjersten L. Larson.sperm chromatin structure assay: Its clinical use for detecting sperm DnA fragmentacion in male infertility and comparisons with other techniques. Journal of Andrology 2002; 23:25-43
Franco JG, Jr., Baurffi RLR, Mauri AL. Significance of large nuclear vacuoles in human spermatozoa: implication for ICsI. Reproductive Bio medicine online 2008; 17(1): 42-45
Garolla A, Fortini D,menegazzom, De ToniL,nicoletti V,moretti A, et al. High-power microscopy for selecting spermatozoa for ICSI by physiological status. Reproductive Biomedicine online 2008; 17(5):610-616
Hazout A, Dumont-Hassan m, JuncaA-M. High-magnification ICSI overcomes paternal effect resistant to conventional ICsI. Reproductive Biomedicine online 2006; 12(1):19-25
Larson K, DeJonge C, Barnes A. Relationship of assisted reproductive technique (ART) outcomes with sperm chromatin integrity and maturity as measured by sperm chromatin structure assay (sCsA). Human Reproduction 2000; 15:1717-1722.
Liu D, Baker H. Antioxidants to reduce sperm DnA fragmentation: an expected adverse effect. Human Reproduction 2007; 22:1597-1602
mauri AL, Petersen CG, Oliveira JBA. Comparation of day 2 embryo quality after ICsI versus intracytoplasmic morphologically selected sperm injection (ImsI) using sibling oocytes. Human Reproduction 2008; 23(suppl.1):i70-i72
Tesarik J, Greco e,mendoza C. Late, but not early, paternal effect on human preimplantation development after ICsI. Human Reproduction 2004; 19(3):611-615
Tesarik J. Paternal effects on cell division in the human preimplantation embryo. Reproductive Biomedicine online 2005; 10(3):370-375
Vanderzwalmen P, Hiemer A, Rubner P, Bach m,neyer A,stecher A, et al. Blastocyst development after sperm selection at high magnification is associated with size and number of nuclear vacuoles. Reproductive Biomedicine Online 2008; 17(5):617-627.
World Health Organization 1999 WHO Laboratory manual for the examination of Human semen and sperm-Cervical mucus Interation, 4thedn. Cambridge university Press, Cambridge