IMPLICACIONES DE LA LONGITUD DE LOS TELÓMEROS EN LA BIOLOGÍA REPRODUCTIVA
Mercedes Gallardo
Grupo de Telómeros y Telomerasa, Centro Nacional de Investigaciones Oncológicas (CNIO). Madrid. e-mail: mmgallardo@cnio.es
Los telómeros de las especies de vida larga se acortan con la edad y la presencia de estos telómeros críticamente cortos inducen una pérdida de la viabilidad celular, que se ha relacionado con una alteración de la función tisular y con la pérdida de capacidades regenerativas, características del envejecimiento. Hoy día sabemos que existen muchas enfermedades y síntomas asociados a un acortamiento telomérico acelerado, como son enfermedades cardiovasculares, del sistema nervioso central (Alzheimer, Parkinson), cáncer, diabetes e infertilidad, por citar algunos ejemplos. Este artículo se centra en la relación entre la longitud de los telómeros y el envejecimiento reproductivo, así como en las consecuencias de este acortamiento en la fertilidad. Asimismo, se muestra su gran potencial como biomarcador en los procesos de fecundación asistida. Rev Asoc Est Biol Rep 2012; 17(2): 39-44.
¿QUÉ SON LOS TELÓMEROS?
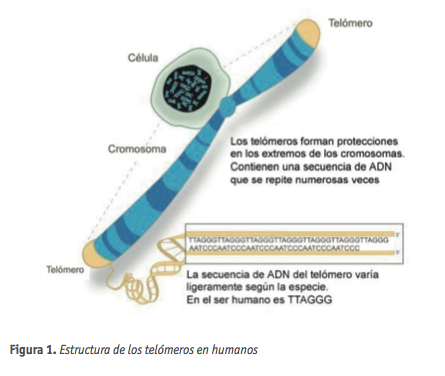
Los telómeros son unas estructuras nucleoprotéicas situadas en los extremos de los cromosomas eucarióticos, de importancia crítica tanto en el mantenimiento de la estabilidad genómica como en los procesos de supresión tumoral y envejecimiento. La función protectora que desempeñan los telómeros fue descrita de forma independiente por Müller (1938) y McClintock (1939), quienes observaron de manera independiente que los cromosomas portaban en sus extremos una estructura especial que les confería estabilidad. Müller acuñó el término de etimología griega “telómeros” para denominar a esas estructuras, “telos” final y “meros” parte (Müller, 1938). Los telómeros ejercen su función protectora de los extremos cromosómicos evitando que estos sean reconocidos y posteriormente procesados, como roturas de la doble hebra del DNA.
En la mayor parte de los eucariotas, los telómeros consisten en repeticiones en tándem de una secuencia rica en guanina (TTAGGG en todos los vertebrados) (Figura 1).
La longitud de los telómeros es variable entre las distintas especies. Mientras que en la levadura Saccharomyces cerevisiae la longitud de los telómeros está comprendida entre 225 y 375 pb (Zakian, 1996), los telómeros de los humanos tienen una longitud de entre 5-15 kb (de Lange et al., 1990).
Estas diferencias en la longitud media del telómero no afectan a la correcta función telomérica, a menos que los telómeros se acorten por debajo de una longitud crítica, lo cual impediría su correcta función y conduciría a una inestabilidad genómica (Blasco et al., 1997; Lee et al., 1998).
En ausencia de un mecanismo compensatorio, los telómeros se acortan progresivamente con cada división celular debido al denominado problema de la replicación de los extremos del DNA lineal (Olovnikov, 1971; Watson, 1972). Existen, además, otros factores como la acción de las nucleasas y la de los radicales libres de oxígeno (ROS), que contribuyen al acortamiento telomérico con cada ciclo celular (Makarov et al., 1997; Sfeir et al., 2005; Wellinger et al., 1996; Ramirez et al., 2003; Sitte et al., 1998). El acortamiento telomérico originado por ROS se reduce con el uso de agentes antioxidantes (von Zglinicki et al., 2000).
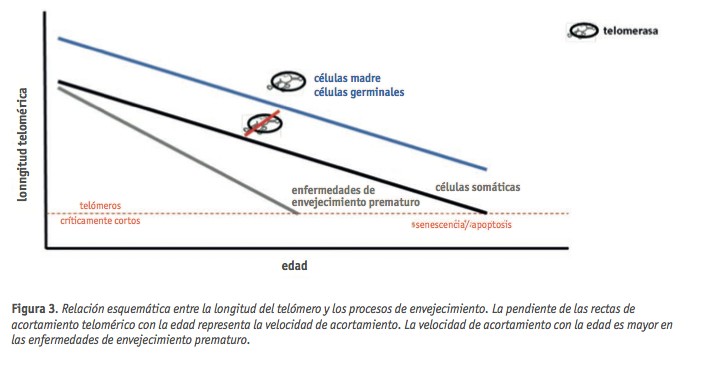
En la especie humana, como en la mayor parte de las especies de vida larga, los telómeros de todas las células se acortan en mayor o menor medida con la edad, llegando a una longitud crítica tras un determinado número de divisiones celulares (Harley et al., 1990). Los telómeros críticamente cortos inducen una pérdida de viabilidad celular, que está relacionada con la pérdida de potencial regenerativo de los diferentes tejidos (Flores et al., 2006; von Zglinicki et al., 2005). De esta manera, el acortamiento de los telómeros con cada división celular convierte a la longitud telomérica en un “reloj molecular” del envejecimiento del organismo (Figura 2) (Blackburn, 2001; Collins and Mitchell, 2002) y por lo tanto en un importante biomarcador de la edad biológica con múltiples aplicaciones clínicas.
LA TELOMERASA
El principal mecanismo para mantener la longitud de los telómeros es la telomerasa, una ribonucleoproteína que alarga los telómeros en aquellas células que la expresan. La telomerasa se activa durante la embriogénesis. De hecho, espermatozoide y ovocitos maduros no tienen actividad telomerasa, y es justo después de la fecundación y a lo largo de toda la gestación cuando se detectan altos niveles de actividad telomerasa, persistiendo durante gran parte del desarrollo fetal y protegiendo a los telómeros de un acortamiento significativo en este periodo de elevada tasa de expansión celular (Blasco et al., 1995; Ulaner and Giudice, 1997; Wright et al., 2001). La actividad telomerasa, no obstante, se silencia tras el nacimiento en la mayor parte de los tejidos somáticos y, como consecuencia, el nacimiento marca el inicio del acortamiento telomérico en la mayor parte de los tejidos a lo largo de la vida. Los tejidos proliferativos de alto potencial regenerativo como son la medula ósea, la piel y el tracto intestinal, así como los linfocitos activados, expresan una actividad telomerasa moderada (Forsyth et al., 2002; Liu et al., 1999). Asimismo, las células madre también expresan telomerasa (Bachor et al., 1999; Ramirez et al., 1997; Yui et al., 1998). De igual manera, la mayor parte de los tumores malignos y las líneas celulares derivadas tienen una actividad telomerasa muy elevada (Hiyama et al., 1996; Kyo et al., 1997; Lin et al., 1997).
En la especie humana, tres son los factores que contribuyen a la mortalidad celular dependiente de los telómeros: la represión de la actividad telomerasa en la mayoría de los tejidos somáticos tras el nacimiento (Ulaner et al., 1998; Wright et al., 1996), los telómeros relativamente cortos en el nacimiento y a lo largo de la vida (Kakuo et al., 1999; Okuda et al., 2002) y la actividad telomerasa muy regulada en las células madre (Bodnar et al., 1996; Broccoli et al., 1995). Estos factores, junto con el acortamiento inherente a la división celular, confieren a las células una capacidad de división finita. Se ha descrito un acortamiento telomérico con la edad en células mononucleares de sangre periférica (Canela et al., 2007; Iwama et al., 1998) y en la mayor parte de tejidos de humanos y ratón (Figura 3) (Flores et al., 2008; Hastie et al., 1990).
La velocidad de acortamiento telomérico con la edad se puede acelerar por factores de riesgo para ciertas enfermedades, como el estrés psicológico, la obesidad, el tabaquismo o el estatus socioeconómico (Cawthon et al., 2003: Cherkas et al., 2006; Epel et al., 2004; Valdes et al., 2005). Recientemente se ha publicado que individuos jóvenes que han sido sometidos a un estrés intrauterino, presentan telómeros significativamente más cortos (Figura 4) (Entriger et al., 2011). Las consecuencias clínicas de este descubrimiento son tremendamente importantes, ya que el envejecimiento celular podría estar influenciado por el estrés prenatal, incrementando así la susceptibilidad de estos individuos a padecer serias enfermedades asociadas al envejecimiento.
La longitud telomérica en los individuos de una misma edad en una población presenta variabilidad debida a factores genéticos y ambientales. Numerosos estudios realizados en poblaciones humanas han descrito una correlación entre determinadas enfermedades asociadas a la edad, como las enfermedades cardiovasculares y la enfermedad de Alzheimer (Ogami et al., 2004; Panossian et al., 2003), y la presencia de telómeros más cortos en los individuos que las padecen respecto de los individuos control. Esta fuerte relación entre telómeros cortos y enfermedades asociadas al envejecimiento, convierte la longitud telomérica en un biomarcador de envejecimiento muy poderoso. Se ha descrito un acortamiento telomérico con la edad en células mononucleares de sangre periférica (Canela et al., 2007; Iwama et al., 1998) y esto hace que los leucocitos sean el tipo celular más idóneo para medir el acortamiento telomérico a lo largo de la vida del organismo, ya que proliferan durante toda la vida de éste y son, además, de fácil obtención mediante una simple extracción de sangre.
Por otra parte, el acortamiento de los telómeros es más acelerado en hombres que en mujeres (Benetos et al., 2001) y este hecho es consistente con una mayor mortalidad vista en los varones, así como una mayor variabilidad en la capacidad reproductiva en hombres que en mujeres. Los estrógenos podrían explicar esta diferencia en la tasa de acortamiento entre hombres y mujeres: tienen un efecto antioxidante y son capaces de estimular la expresión de la telomerasa (Demerath et al., 2004).
EL EFECTO PATERNAL EN LA LONGITUD DE LOS TELÓMEROS
En los años 80s se describió por primera vez que el esperma tiene los telómeros más largos que los leucocitos del mismo individuo (Cooke and Smith, 1986). Y posteriormente, en los 90s, distintos estudios mostraron que, de hecho, la longitud de los telómeros en el esperma aumenta a medida que aumenta la edad del donante (Allsopp et al., 1992). Como consecuencia, la descendencia de hombres mayores tienen telómeros más largos (De Meyer et al., 2007). Con la madre parece no ocurrir lo mismo; no se ha encontrado ninguna correlación entre la edad de la madre y la longitud de los telómeros de la descendencia (Kimura et al., 2008). Esta elongación de la longitud telomérica en el esperma se podría explicar por la necesidad de producir gametos masculinos a lo largo de toda la vida, mientras que las mujeres tienen ya todos los gametos producidos desde el nacimiento (Keefe et al., 2007).
TELÓMEROS Y FERTILIDAD
Existen distintos estudios que correlacionan, positivamente, la longevidad en humanos con una mayor fecundidad, una reproducción a una edad más avanzada (Doblhammer, 2000) y la aparición de la menopausia a edades mas tardías (Jacobsen et al., 1999). El retraso en la aparición de la menopausia en mujeres más longevas podría deberse, entre otras razones, a un envejecimiento celular más lento (Perls et al., 2001). Y esto ha llevado a muchos investigadores a pensar en el papel de los telómeros en el envejecimiento reproductivo, por la relación existente entre telómeros y envejecimiento celular. De modo que uno podría pensar que mujeres que presentan un envejecimiento reproductivo prematuro tendrían telómeros más cortos. Hanna et al. (2009), comparan un grupo de mujeres con envejecimiento reproductivo prematuro (RM) (mujeres que han sufrido abortos recurrentes) con un grupo de mujeres control (mujeres mayores de 37 años que han tenido un embarazo sano y sin ningún historial de abortos) y ven que, efectivamente, las primeras (RM) tienen telómeros más cortos.
Conocido es que la fertilidad en las mujeres decae con el paso del tiempo. Esto es debido al efecto combinado de un descenso en la tasa de concepción y en un incremento en la tasa de abortos. Los procesos biológicos que, principalmente, contribuyen al envejecimiento del ovario y por tanto a la infertilidad en las mujeres son: una disminución en el número de folículos (insuficiencia ovárica) y un aumento de la estabilidad genómica asociada a la aparición de aneuploidías (Faddy, 2000).
A. INSUFICIENCIA OVÁRICA.
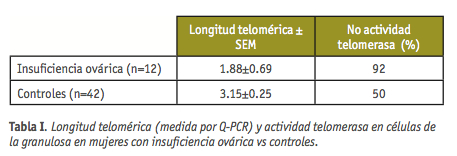
Recientemente se ha descrito una relación entre longitud telomérica y la insuficiencia ovárica, fenómeno caracterizado por una disminución en el número inicial de folículos así como un aumento en la destrucción de los mismos y una débil respuesta folicular a la estimulación por gonadotropinas (Butts et al., 2009). Una de las principales consecuencias de este síndrome, es una reducida fecundidad. En humanos, se ha demostrado la presencia de actividad telomerasa en embriones (Liu et al., 2007; Wright et al, 1996). Un trabajo realizado en folículos bovinos ha puesto también de manifiesto la existencia de actividad telomerasa en las células de la granulosa, necesarias para la formación de los folículos (Lavranos et al., 1999). Pues bien, se ha demostrado que mujeres con problemas de insuficiencia ovárica tienen células de la granulosa con telómeros más cortos, coincidiendo con una capacidad proliferativa limitada de dichas células (Tabla I). La ausencia de actividad de la telomerasa podría explicar ambos hechos: erosión de los telómeros acelerada y capacidad replicativa limitada, ya que una activación insuficiente de la telomerasa en estadios tempranos del desarrollo del folículo pondría en compromiso las funciones celulares necesarias para la correcta maduración del folículo.
Pero, ¿cómo afecta la disminución de la actividad telomerasa y el acortamiento telomérico en los resultados de FIV? Existe una relación significativa entre ausencia de actividad telomerasa y numero de folículos producidos. Otros parámetros analizados (no de ovocitos recuperados, % de fecundación, tasa de embarazo, etc.) muestran una tendencia negativa en los casos de ausencia de actividad de la telomerasa, pero dicha asociación no es significativa (Butts et al., 2009). Estas observaciones abren la posibilidad de usar la longitud telomérica como un marcador de la disfunción de las células de la granulosa, de la insuficiencia ovárica y por tanto del éxito reproductivo de una mujer.
B. ANEUPLOIDÍAS
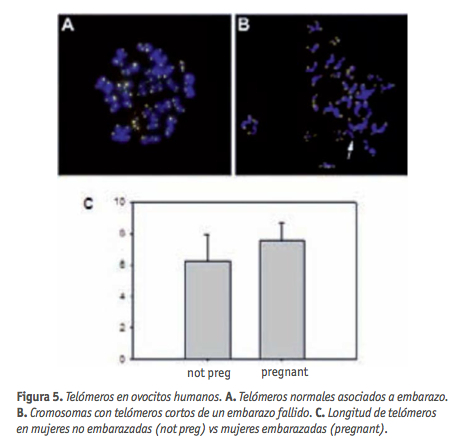
La mayoría de los ovocitos y embriones que han sufrido algún tipo de aneuploidía entran en apoptosis antes de implantarse, pero algunos consiguen escapar de la muerte celular programada y acaban en abortos o generando descendencia con alteraciones cromosómicas. Una de las principales causas de la generación de aneuploidías en el ovocito durante la meiosis en la madre, es la disfunción telomérica (Keefe et al., 2006), ya que los telómeros tienen un papel muy importante al comienzo de la meiosis, facilitando el alineamiento, sinapsis y formación de quiasmas (Scherthan, 2006). Recientemente, se ha demostrado que la longitud de los telómeros está asociada con el desarrollo de aneuploidías en humanos (Treff et al., 2011). ¿Se podría, pues, utilizar la longitud telomérica como “predictor” de disfunciones meióticas y por lo tanto de la posibilidad de embarazo tras un tratamiento de FIV? Hay estudios que sugieren que sí (Keefe et al., 2007). Los telómeros de pacientes que se quedaron embarazadas después de un tratamiento por FIV resultaron ser más largos que en aquellas mujeres que no consiguieron quedarse embarazadas (Figura 5).
CONCLUSIONES
Cada vez tenemos más evidencias de las implicaciones biológicas que supone el acortamiento de los telómeros, y lo que es más importante, de sus consecuencias clínicas. El gran potencial que tiene como biomarcador de la salud en general y de muchas enfermedades y síndromes concretos, en áreas muy distintas de la medicina, hace que se considere como un importante factor en el ámbito de la medicina personalizada, incluyendo la medicina reproductiva, ayudando a diseñar tratamientos personalizados y por tanto más eficaces y con menos efectos secundarios.
Referencias
Allsopp et al. Telomere length predicts replicative capacity of human fibroblasts. Proc Natl Acad Sci USA 1992; 89(21):10114- 10118.
Bachor et al. Telomerase is active in normal gastrointestinal mucosa and not up- regulated in precancerous lesions. J Cancer Res Clin Oncol 1999; 125(8-9):453-460.
Benetos et al. Telomere length as an indicator of biological aging: the gender effect and relation with pulse pressure and pulse wave velocity. Hypertension 2001; 37(2 Part 2):381-385.
Bodnar et al. Mechanism of telomerase induction during T cell activation. Exp Cell Res 1996; 228(1):58-64.
Blackburn EH. Switching and signaling at the telomere. Cell 2001; 106(6):661-673.
Blasco et al. Functional characterization and developmental regulation of mouse telomerase RNA. Science 1995; 269(5228):1267-1270.
Blasco et al. Mouse models to the study of telomerase. Ciba Found Symp 1997; 211:160-170; discussion 166-170.
Broccoli et al. Telomerase activity in normal and malignant hematopoietic cells. Proc Natl Acad Sci USA 1995; 92(20):9082-9086.
Butts et al. Correlation of telomere length and telomerase activity with occult ovarian insufficiency. J Clin Endocrinol Metab 2009; 94(12):4835-43.
Canela et al. High-throughput telomere length quantification by FISH and its application to human population studies. Proc Natl Acad Sci USA 2007; 104(13):5300-5305.
Cawthon et al. Association between telomere length in blood and mortality in people aged 60 years and older. Lancet 2003; 361 (9355):393-395.
Cherkas et al. The effects of social status on biological aging as measured by white- blood-cell telomere length. Aging Cell 2006; 5(5):361-365.
Collins and Mitchell. Telomerase in the human organism. Oncogene 2002; 21(4):564-579.
CookeandSmith.Variabilityatthetelomeres of the human X/Y pseudoautosomal region. Cold Spring Harb Symp Quant Biol 1986; 51(1):213-219.
De Lange et al. Structure and variability of human chromosome ends. Mol Cell Bio 1990; 10(2):518-527.
Demerath et al. Telomeres and telomerase in the fetal origins of cardiovascular disease: a review. Hum Biol 2004; 76(1):127-146.
De Meyer et al. Paternal age at birth is an important determinant of offspring telomere length. Hum Mol Genet 2007; 16(24):3097-102.
Doblhammer G. Reproductive history and mortality later in life: a comparative study of England and Wales and Austria. Popul Stud (Camb) 2000; 54(2):169-76.
Entringer et al. Stress exposure in intrauterine life is associated with shorter telomere length in young adulthood. Proc Natl Acad Sci USA 2011; 108(33):5 13-518.
Epel et al. Accelerated telomere shortening in response to life stress. Proc Natl Acad Sci USA 2004; 101(49):17312-17315.
Faddy MJ. Follicle dynamics during ovarian ageing. Mol Cell Endrocrinol 2000; 163(1- 2):43-48.
Flores et al. Telomerase regulation and stem cell behavior. Curr Opin Cell Biol 2006;18(3):254-260.
Flores et al. The longest telomeres: a general signature of adult stem cell compartiments. Genes Dev 2008; 22(5):654-667.
Forsythetal.Telomeraseanddifferentiation in multicellular organisms: turn it off, turn it on, and turn it off again. Differentiation 2002; 69(4-5):188-197.
Hanna et al. Telomere length and reproductive aging. Hum Reprod 2009; 24(5):1206-11.
Harley et al. Telomeres shorten during ageing of human fibroblasts. Nature 1990; 345(6274):458-460.
Hastie et al. Telomere reduction in human colorectal carcinoma and with ageing. Nature 1990; 346(6287):866-868.
Hiyama et al. Telomerase activity in human breast tumors. J Natl Cancer Inst 1996; 88(2):116-122.
Iwama et al. Telomeric length and telomerase activity vary with age in peripheral blood cells obtained from normal individuals. Hum Genet 1998;102(4):397- 402.
Jacobsen et al. Age at natural menopause and total mortality and mortality from ischemic heart disease: the Adventist Health Study. J Clin Epidemiol 1999; 52(4):303-307.
Kakuo et al. Human is a unique species among primates in terms of telomere length. Biochem Biophys Res Commun 1999; 263(2):308-314.
Keefe et al. The telomere theory of reproductive senescence in women. Curr Opin Obstet Gynecol 2006; 18(3):280-285.
Keefe et al., Telomeres and aging-related meiotic dysfunction in women. Cell Mol Life Sci 2007; 64(2):139-143.
Kimura et al. Offspring ́s leukocyte telomere length, paternal age, and telomere elongation in sperm. PLoS Genet 2008; 4(2):37.
Kyo et al. Telomerase activity in human urothelial tumors. Am J Clin Pathol 1997; 107(5):555-560.
Lavranos et al. Evidence for ovarian granulose stem cells: telomerase activity and localization of the telomerase ribonucleic acid component in bovine ovarian follicles. Biol Reprod 1999; 61(2):358-366.
Lee et al. Essential role of mouse telomerase in highly proliferative organs. Nature 1998; 392(6676):569-574.
Lin et al. Telomerase activity in primary prostate cancer. J Urol 1997; 157(3):1161-1165.
Liu et al. Constitutive and regulated expression of telomerase reverse transcriptase (hTERT) in human lymphocytes. Proc Natl Acad Sci USA 1999; 96(9):5147-5152.
Liu et al. Telomere, telomerase and aging. Mech Ageing Dev 2007; 129(1-2):1-2.
Makarov et al. Long G tails at both ends of human chromosomes suggest a C strand degradation mechanism for telomere shortening. Cell 1997; 88(5):657-666.
McClintock B. The Stability of Broken Ends of Cromosomes in Zea Mays. Genetics (1941) 26(2):234-282.
Müller HJ. Bar duplication. Collecting Net (Woods Hole) 1938;13:183-198.
Ogami et al. Telomere shortening in human coronary artery diseases. Arterioscler Thromb Vasc Biol 2004;24(3):546-550.
Olovnikov AM. Principel of marginotomy in template synthesis of polynucleotides. Dokl Akad Nauk SSSR 1971; 201(6):1496-1499.
Okuda et al. Telomere length in the newborn. Pediatr Res 2002; 52(3):377-381.
Panossian et al. Telomere shortening in T cells correlates with Alzheimer ́s disease status. Neurobiol Aging 2003; 24(1):77-84.
Perls et al. The evolution of menopause and human life span. Ann Hum Biol 2001; 28(3):237-245.
Ramirez et al. Telomerase activity concentrates in the mitotically active segments of human hair follicles. J Invest Dermatol 1997; 108(1):113-117.
Ramirez et al. Massive telomere loss is an early event of DNA damage-induced apoptosis. J Biol Chem 2003; 278(2):836-842.
Scherthan H. Factors directing telomere dynamics in synaptic meiosis. Biochem Soc Trans 2006; 34(4):550-553.
Sfeir et al. Telomere-end processing the terminal nucleotides of human chromosomes. Mol Cell 2005; 18(1):131-138.
Sitte et al. Accelerated telomere shortening in fibroblasts after extended periods of confluency. Free Radic Biol Med 1998; 24(6):885-893.
Treff et al. Telomere DNA deficiency is associated with development of human embryonic aneuploidy. PLoS Genet 2011; 7(6):1002161.
Ulaner et al. Telomerase activity in human fetal tissues during gestation. Mol Hum Reprod 1998; 3(9):769-773.
Valdes et al. Obesity, cigarette smoking, and telomere length in women. Lancet 2005; 366 (9486):662-664.
von Zglinicki et al. Accumulation of single- strand breaks is the major cause of telomere shortening in human fibroblasts. Free Radic Biol Med 2000; 28(1):64-74.
von Zglinicki et al. Telomeres as biomarkers for ageing and age-related diseases. Curr Mol Med 2005; 5(2):197-203.
Watson JD. Origin of concatemeric T7 DNA. Nat New Bio 1972; 239(94):197-201.
Wellinger et al. Evidence for a new step in telomere maintenance. Cell 1996; 85(3):423-433.
Wrigth et al. Telomerase activity in human germline and embryonic tissues and cells. Dev Genet 1996; 18(2):173-179.
Wrigth et al. Characterization of telomerase activity in the human oocyte and preimplantation embryo. Mol Hum Reprod 2001; 7(10):947-955.
Yui et al. Telomerase activity in candidate stem cells from fetal liver and adult bone marrow. Blood 1998; 91(9):3255-3262.
Zakian VA. Telomere functions: lessons from yeast. Trends Cell Biol 1996; 6(1):29-33.