Inmunología e Infertilidad. Anticuerpos contra Gametos y Gónadas en el Varón y en la Mujer
Lluís Bassas Arnau
Laboratorio de Seminología y Embriología, Fundació Puigvert. Cartagena 340, 08025 Barcelona
Las situaciones fisiológicas de tolerancia inmunológica localizada son comunes en todo lo relacionado con la reproducción, por lo que se han propuesto mecanismos inmunológicos para explicar ciertas alteraciones de la fertilidad. La producción de anticuerpos antiespermáticos (AAE) en el hombre suele ser debida a disrupción de la barrera hematotesticular, aunque es posible que haya una pérdida de tolerancia inmunológica debida a otras causas. En la mujer se ha propuesto que el daño en la pared del tracto genital puede favorecer la producción de AAE, que aparecen en el moco cervical sobre todo. Los mecanismos de acción de los AAE pueden ser variados, como es de esperar por su naturaleza policlonal. Pueden ocasionar aglutinaciones, disminuir la movilidad, producir citotoxicidad directa o mediada por complemento, bloquear complejos moleculares implicados en la fecundación, e incluso interferir en el desarrollo del zigoto o el embrión. Sin embargo, no hay estudios concluyentes que demuestren la importancia relativa de estas acciones en el origen de la infertilidad. El diagnóstico de los AAE se basa actualmente en métodos de inmunocitoadherencia sobre gametos vivos (MAR, IBT). A pesar de su sencillez, están lejos de ser las técnicas ideales por sus limitaciones prácticas (requieren espermatozoides móviles), su variabilidad, y porque no es posible cuantificar su sensibilidad. Se han ensayado diversos tratamientos inmunosupresores, especialmente corticoesteroides, para el tratamiento de la infertilidad asociada a AAE. El consenso actual es que no son eficaces. Las inseminaciones intrauterinas y la fecundación in vitro ofrecen resultados aceptables, aunque su efectividad es irregular y está inversamente relacionada con la severidad de la respuesta autoinmune. La inyección intracitoplasmática de espermatozoides consigue fecundación y gestación en una proporción no inferior a la de pacientes sin AAE, pero no hay estudios aleatorizados para evaluar esta técnica.
Los anticuerpos antigonadales se observan en síndromes poliendocrinos autoinmunitarios. En el hombre se pueden manifestar como un hipogonadismo, y en la mujer son causa de fallo ovárico prematuro. Es probable que una respuesta autoinmune simultánea contra antígenos testiculares y espermatozoides ocurra en patologías adquiridas. En la gónada femenina se ha demostrado que los anticuerpos pueden dirigirse contra células de la teca, cuerpo lúteo, células de la granulosa, ovocitos (en particular zona pelúcida) e intersticio. En la práctica, no hay métodos diagnósticos estandarizados ni estudios clínicos convincentes. Por ello, la medición de anticuerpos antitesticulares, antiováricos y antioocitarios ha quedado hasta ahora fuera de las pautas de actuación clínica habitual. El interés de las investigaciones más recientes se centra en el análisis y estudio funcional de los antígenos diana (en gametos y tejidos gonadales) correspondientes a los anticuerpos, de modo que en el futuro sea posible identificar con mayor certeza los casos en los que el factor autoinmune compromete realmente la función reproductiva.
INTRODUCCIÓN
Cuando, a partir de la pubertad, las células reproductoras empiezan a madurar y a diferenciarse, muchos nuevos antígenos previamente no reconocidos por el organismo emergen a la superficie de los espermatozoides y los ovocitos. En general, todo el proceso de reproducción sexual constituye una situación especial en la que células y tejidos inmunológicamente heterogéneos entran en contacto íntimo, se fusionan y forman un organismo que exhibe características mixtas. Esta situación de intolerancia inmune circunscrita al sistema reproductivo permite la coexistencia de líneas celulares antigénicamente extrañas en un mismo organismo. Debido a que las posibles anomalías en la regulación de este refugio inmunológico pueden comportar un deterioro en la función reproductiva, desde hace décadas se han propuesto mecanismos inmunológicos para las situaciones de subfertilidad y pérdidas fetales.
Puesto que el panorama de las lesiones inmunológicas en relación con la infertilidad es muy amplio, nos limitaremos aquí a tratar de los fenómenos de autoinmunidad humoral dirigida contra los gametos y las gónadas en el hombre y la mujer.
Debido a la desigual atención recibida por los investigadores, adelantamos que la mayor parte de esta monografía abordará la cuestión de los anticuerpos antiespermáticos. Voluntariamente excluiremos el escenario de la autoinmunidad femenina dirigida contra diversos tejidos, en la que las alteraciones de la reproducción son sólo una parte del cuadro clínico general.
Anticuerpos antiespermáticos
Origen de la respuesta autoinmune masculina
Los mecanismos de producción de los anticuerpos antiespermáticos (AAE) se conocen sólo parcialmente, aunque se sabe que algunas patologías se asocian a mayor incidencia de autoinmunidad (Tabla I).  Los antígenos espermáticos específicos aparecen a partir de la pubertad, mucho después de que el proceso de reconocimiento y adquisición de tolerancia ante los antígenos propios se haya establecido. En el testículo, el epitelio germinal queda aislado por las uniones intercelulares entre las células de Sertoli. Estas auténticas barreras delimitan un compartimiento luminal aislado (Russell, 1977). La separación entre el sistema reproductivo y el resto del organismo persiste a lo largo de casi todo el trayecto seminal, constituyendo lo que se ha dado en llamar la barrera hematotesticular (Dym and Fawcett, 1970). Junto a ello, las poblaciones de células linfocitarias que se encuentran en el interior de la vía seminal y en su vecindad, son predominantemente del tipo T supresor (CD8+). Esto significa que eventuales fugas de antígenos espermáticos dan lugar a respuestas predominantemente inmunosupresoras en vez de activadoras (El-Demiry el al., 1985). En condiciones normales la barrera hematotesticular impide el contacto de los antígenos espermáticos con la circulación general y las células inmunocompetentes del resto del organismo. La formación de AAE debe por tanto considerarse como una reacción inmunológica adquirida contra antígenos extraños (Alexander and Anderson, 1986). Se han postulado distintas hipótesis para explicar la patogenia de la pérdida de tolerancia inmunológica, como (a) disminución de la cantidad o actividad de las células T supresoras en el tracto genital, (b) disminución o ausencia de factores que reclutan células supresoras en los fluidos del tracto genital masculino, (c) alteración de la antigenicidad espermática que resulta en una supresión inadecuada de la respuesta inmune, y finalmente (d) lesión de la vía seminal que sobrepasa los mecanismos inmunoreguladores y vierte al organismo cantidades importantes de antígenos espermáticos (Witkin, 1988).
Los antígenos espermáticos específicos aparecen a partir de la pubertad, mucho después de que el proceso de reconocimiento y adquisición de tolerancia ante los antígenos propios se haya establecido. En el testículo, el epitelio germinal queda aislado por las uniones intercelulares entre las células de Sertoli. Estas auténticas barreras delimitan un compartimiento luminal aislado (Russell, 1977). La separación entre el sistema reproductivo y el resto del organismo persiste a lo largo de casi todo el trayecto seminal, constituyendo lo que se ha dado en llamar la barrera hematotesticular (Dym and Fawcett, 1970). Junto a ello, las poblaciones de células linfocitarias que se encuentran en el interior de la vía seminal y en su vecindad, son predominantemente del tipo T supresor (CD8+). Esto significa que eventuales fugas de antígenos espermáticos dan lugar a respuestas predominantemente inmunosupresoras en vez de activadoras (El-Demiry el al., 1985). En condiciones normales la barrera hematotesticular impide el contacto de los antígenos espermáticos con la circulación general y las células inmunocompetentes del resto del organismo. La formación de AAE debe por tanto considerarse como una reacción inmunológica adquirida contra antígenos extraños (Alexander and Anderson, 1986). Se han postulado distintas hipótesis para explicar la patogenia de la pérdida de tolerancia inmunológica, como (a) disminución de la cantidad o actividad de las células T supresoras en el tracto genital, (b) disminución o ausencia de factores que reclutan células supresoras en los fluidos del tracto genital masculino, (c) alteración de la antigenicidad espermática que resulta en una supresión inadecuada de la respuesta inmune, y finalmente (d) lesión de la vía seminal que sobrepasa los mecanismos inmunoreguladores y vierte al organismo cantidades importantes de antígenos espermáticos (Witkin, 1988).
En aproximadamente la mitad de los hombres que producen AAE no se detecta ningún factor de riesgo conocido (Bassas et al., 1995). Esta proporción es todavía más alta en las mujeres que tienen isoAAE en moco cervical, suero o líquido folicular.
Producción en la mujer
La ruta natural de migración espermática recorre el canal cervical, la cavidad uterina, y las trompas, llegando hasta la cavidad peritoneal (Templeton and Mortimer, 1982). Sin embargo, ello no produce respuesta inmunológica en el organismo femenino. El plasma seminal contiene componentes que se unen transitoriamente a la superficie del espermatozoide ocultando antígenos hasta que el gameto está en las cercanías del ovocito (O’Rand, 1982). Sin embargo, la capacidad inmunosupresora del plasma seminal no es distinta en los pacientes cuyas esposas producen AAE en comparación con mujeres sin AAE (Bronson, 1987).
Los AAE pueden encontrarse en tracto genital femenino como resultado de la producción local y también por trasudación desde el suero. Los AAE se encuentran exclusivamente en suero en casi la mitad de los casos, mientras que sólo en un 3% se encuentran únicamente en moco cervical o en secreciones vaginales. La producción local de AAE en moco cervical, compuesta en la mayoría de los casos por IgA (Ingerslev et al., 1982), produce inmovilización de los espermatozoides en contacto con él.
A priori, los factores que alteran la pared del sistema genital femenino podrían dar lugar a un contacto entre los espermatozoides y el sistema inmunocompetente. En particular, la enfermedad inflamatoria pélvica. Sin embargo, la prevalencia de AAE en moco cervical es baja en pacientes infértiles (Eggert-Kruse et al., 1993). Esta proporción no difiere mucho de la encontrada en mujeres fértiles (Bronson 1999). En la actualidad, únicamente está indicado el estudio de AAE en mujeres cuando se observa un test postcoital (TPC) patológico en presencia de semen con buena movilidad en el que no se observen AAE. Para el diagnóstico se puede estudiar suero o moco cervical licuado por sonicación o bromelina, y la ténica de IBT indirecto.
Efectos biológicos y mecanismos de acción
Los AAE son de naturaleza policlonal y pueden dirigirse contra diversos antígenos simultáneamente. La capacidad para impedir la fertilidad dependerá de las acciones biológicas que resulten afectadas en los gametos masculinos como consecuencia del bloqueo de epítopos espermáticos por los AAE (Tabla II). Sin embargo, no existen estudios clínicos suficientemente amplios y bien diseñados que permitan aportar evidencia definitiva de los efectos deletéreos de los AAE en la fertilidad.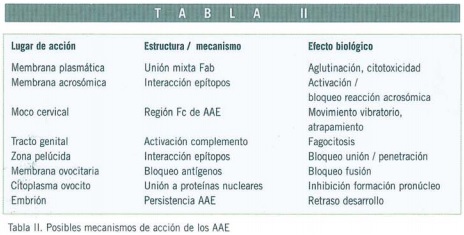
A pesar de ello, sí hay abundantes datos circunstanciales de que los anticuerpos antiespermáticos (AAE) juegan un papel primordial en ciertos casos de infertilidad masculina, y coadyuvante en otros (Francavilla et al., 1999). La prevalencia de AAE oscila entre el 3 y el 15% de los hombres infértiles, mientras que en los fértiles es unas diez veces menor (De Almeida et al., 1986; Ohl and Naz, 1995). En sujetos con factor autoinmune los títulos de AAE en suero y la proporción de espermatozoides con inmunoglobulinas unidas a su superficie se correlacionan positivamente con la existencia de infertilidad (Bronson, 1993).
Los AAE pueden alterar la movilidad espermática por mecanismos de citotoxicidad directa o mediada por complemento (Mathur et al., 1986). Provocan además aglutinaciones que pueden secuestrar un porcentaje importante de la población espermática móvil (Friberg, 1980). A pesar de ello, la presencia de AAE puede pasar desapercibida, ya que ni las aglutinaciones aparecen siempre, ni la motilidad tiene porqué estar alterada (Lombardo et al., 1992; Munuce et al., 2000). Los AAE pueden interferir el transporte espermático en el canal cervical y en otras zonas del tracto genital femenino. Existe abundante información que asocia la existencia de AAE con un TPC negativo (Haas, 1986) a pesar de una buena movilidad espermática. Es característica la adopción de una movilidad estática, vibratoria, en los espermatozoides atrapados en el moco cervical, probablemente debida a la unión entre la región Fc de los anticuerpos con la matriz del moco. Aunque se ha sugerido que la clase de inmunoglobulina y el patrón de unión preferente al espermatozoide tienen especial importancia en los efectos de los AAE sobre la movilidad, lo cierto es que cuando la proporción de espermatozoides afectados es superior al 60%, tales diferencias tienden a desaparecer (Eggert-Kruse et al., 1993). Además, en la mayoría de los casos la respuesta inmune incluye tanto IgA como IgG. En todo caso, sí parece que cuando la especificidad regional se limita a la punta del flagelo, loa AAE no interfieren con la capacidad de penetrar el moco cervical (Haas, 1986). En el tracto genital femenino, los espermatozoides con AAE adherido son más vulnerables a la fagocitosis (London et al., 1985).
Los AAE pueden unirse a ciertos antígenos que poseen funciones específicas en el proceso de fecundación, como la unión a determinantes específicos de la zona pelúcida (Tsukui et al., 1986; Mahoni el al., 1991) y la fusión del espermatozoide con la membrana plasmática del ovocito (Aitken et al., 1988). Como consecuencia, la fecundación ovocitaria puede verse reducida en algunos casos (Clarke et al., 1988). Los resultados procedentes de series clínicas de FIV así parecen indicarlo, aunque la mayoría de los estudios están limitados por el escaso número de pacientes analizados, y por la interferencia de otros factores seminales. En una reciente revisión de las distintas series de FIV publicadas, Lombardo et al. (2001) hallaron una reducción en la tasa de fecundación en 12 de las 16 series analizadas. En general (a) el efecto de reducción es relativo (disminución de la fecundación más que fallo total de fecundación), (b) los niveles de positividad se correlacionan con el grado de afectación (por encima de 70-90% la disminución en las tasas de fecundación es mayor), (c) la asociación de varias inmunoglobulinas (IgG + Ig A) empeora el pronóstico, (d) los especímenes con otras anomalías asociadas (oligo, asteno, teratozoospermia) se comportan peor, y (e) existe una amplia heterogeneidad en el comportamiento de pacientes individuales, reflejo probable de la distinta especificidad de los AAE presentes en cada paciente.
La capacitación es un proceso dinámico de modificación y reestructuración de las membranas espermáticas, y que culmina en la reacción acrosómica. Los AAE fijados a la superficie alteran este proceso. Según algunos estudios pueden impedir la reacción acrosómica (Tsukuiet al., 1988) si bien otros autores encuentran que los AAE la activan precozmente (Bohring et al., 2001), o no ejercen sobre ella efectos apreciables (Francavilla et al., 1991).
Ya se ha mencionado el valor del isotipo de AAE (IgA, IgG, IgM) y de la localización preferente en el espermatozoide (cabeza, flagelo). En general, existe una tendencia a considerar que los AAE unidos a la cola pueden afectar la penetración en moco cervical, mientras que los AAE unidos a la cabeza pueden afectar principalmente la reacción acrosómica y la interacción espermatozoide-ovocito.
En un modelo experimental de conejas inmunizadas contra espermatozoides de conejo, la presencia de IgA secretora aislada de los fluidos oviductales y uterinos fue capaz de inhibir el desarrollo in vitro de embriones hasta blastocisto. Dichas inmunoglobulinas se detectaron unidas a estos embriones (Menge et al., 1974). Similares resultados fueron hallados usando anticuerpos antiespermáticos de ratón (Seki and Mettler, 1982).
La identificación de los antígenos espermáticos afines a los AAE y antigonadales está acaparando durante los últimos años el interés de los investigadores. Los únicos antígenos sobre los que actúan los AAE en condiciones fisiológicas son los situados en la membrana externa del espermatozoide, y a ellos debe limitarse la caracterización. Por medio de la electroforesis simple o 2D seguida de transferencia (blotting) a una membrana, los AAE a estudiar son incubados para unirse localmente a sus antígenos correspondientes, que se visualizan mediante conjugados enzimáticos unidos a marcadores colorimétricos, radioactivos o quimioluminiscentes (Snow and Ball, 1992). A continuación, las proteínas identificadas pueden aislarse y secuenciarse, y compararse con una base de datos para reconocerla o identificarla como nueva. Finalmente, la deducción de la secuencia de cDNA correspondiente conducirá al gen responsable (Bohring and Krause, 2003). Alternativamente los antígenos pueden fijarse a una columna de afinidad, donde se unen los anticuerpos, para posteriormente ser eludidos y enfrentados a un panel de antígenos bien caracterizados (Auer et al., 1995). De este modo, usando AAE como sondas moleculares se han identificado numerosos antígenos espermáticos con funciones conocidas. Entre ellas, diversas proteínas cuyo bloqueo se asocia a los fenómenos aglutinantes, a inducción de la reacción acrosómica (Koide et al., 2000; Bohring et al., 2001) o inhibición (Santhanam and Naz, 2001), interferencia de la unión a la ZP (Naz et al., 2000), a la fusión con el oolema (Noor and More, 1999), o la formación de pronúcleos (Batova et al., 2000). Otras proteínas tienen funciones todavía no conocidas (Shetty et al., 1999), como HS70 (proteína heat shock), ER60 (disulfuro isomerasa), la forma inactiva de la caspasa-3, componentes del sistema proteasoma, una glicoproteína (SAGA-1) cuya cadena aminoácido es idéntica a CD52 expresada en linfocitos (Diekman et al., 2000), y otras muchas. Es de esperar que en el futuro puedan desarrollarse métodos diagnósticos en los que los principales antígenos purificados se utilicen en baterías de pruebas para identificar las características de los AAE.
MÉTODOS DIAGNÓSTICOS
Puesto que ni las anomalías en el seminograma ni la aparición de aglutinaciones constituyen indicios específicos de la existencia de AAE, la indicación de realizar un estudio inmunológico en el semen (o en otros productos biológicos) dependerá de la relevancia que los resultados tengan en el manejo y el tratamiento de la pareja estéril (Hatasaka, 2000). En este sentido, el grado de fervor varía ampliamente entre grupos y profesionales, de modo que mientras algunos expertos se manifiestan bastante escépticos (Helmerhost et al., 1999; Hatasaka, 2000), otros defienden su utilidad (Bronson, 1999). Las directrices de la OMS (WHO, 1999) y las de la ESHRE (Kvist and Björndahl, 2002) incluyen las pruebas diagnósticas de AAE en el estudio básico del semen, esto es, a realizar en todos los pacientes evaluados por cualquier forma de subfertilidad.
Los primeros métodos de detección de AAE se basaban en la capacidad del suero o plasma seminal de pacientes para inducir aglutinación de espermatozoides control vivos (Friberg, 1974). Sin embargo, estos productos biológicos no juegan un papel directo en los acontecimientos reproductivos y por tanto los AAE circulantes en suero y plasma seminal sólo deben considerarse como marcadores indirectos de la reacción autoinmune. Por otro lado, la capacidad aglutinante no está limitada a los AAE, y otros productos (microorganismos, partículas) pueden dar lugar a reacciones falsamente positivas (Helmerhorst et al., 1999). Otros métodos de detección desarrollados (ver Tabla III) incluyen la inmunofluorescencia (Tung et al., 1976) la selección mediante fluorocitometría (Haas and Cunningham 1984) y los enzimoinmunoanálisis (Zanchetta et al., 1982). Debido a que esta última técnica facilitaba la estandarización y la cuantificación de los resultados y además evitaba la necesidad de usar espermatozoides vivos, se llegó a comercializar, pero su utilidad clínica se mostró muy pobre. Las principales razones de su fracaso se deben a que la fijación de antígenos espermáticos altera sus características (Haas et al., 1988) y la correlación con las pruebas de inmunocitoadherencia (MAR, IBT) es mala (Bassas et al., 1991). 
Los métodos de detección de AAE unidos a la superficie de los gametos masculinos han desplazado progresivamente los procedimientos iniciales en los que se evaluaba el suero o el plasma seminal. Técnicas como la reacción mixta de antiglobulina (MAR) (Pager et al., 1978; Comhaire et al., 1987) o el test de unión a inmunoesferas (IBT) (Clarke et al., 1985) deben considerarse actualmente como rutinarias, y están al alcance de cualquier laboratorio de reproducción. El MAR test se basa en la incubación de hematíes (o partículas de látex) tratados con IgG y espermatozoides en cuya superficie se encuentran AAE tipo IgG. Al añadir un exceso de inmunoglobulina específica anti-IgG se forman aglutinaciones mixtas que implican a los espermatozoides con AAE. El método IBT utiliza microesferas (inmunobeads) de poliacrilamida en las que se han fijado moléculas de anti-inmunoglobulinas específicas (anti-IgA, -IgG, – IgM) fijadas por su región Fc, y que se incuban con espermatozoides vivos libres de plasma seminal (para evitar el bloque de las Anti-Ig). Las inmunobeads se unen a los espermatozoides cuya superficie contiene Ig del tipo estudiado. Existe un método de MAR test para IgA, pero se basa en el mismo principio que el IBT. Las pruebas indirectas de IBT y MAR pueden realizarse preincubando espermatozoides vivos control con una dilución apropiada de suero, plasma seminal o moco cervical licuado (por sonicación o bromelina) y realizando a continuación la determinación descrita (Kvist and Björndahl, 2002).
Las pruebas basadas en la inmunocitoadherencia (MAR con partículas de látex, IBT) tienen la ventaja de que informan de la proporción de espermatozoides positivos, del tipo de Ig implicada y del patrón de distribución regional de los AAE. Sin embargo, están lejos de ser métodos ideales, puesto que (a) presentan dificultades de lectura cuando hay pocos o ningún espermatozoide móvil, (b) consideran como positivas las Ig no específicas adheridas a la superficie espermática, (c) no se conoce el número de moléculas de Ig necesarias para mediar la unión de las inmunoesferas, (d) requieren espermatozoides vivos de donante para las pruebas indirectas. Una nueva dificultad aparece en la interpretación de los resultados, procedente de la confusión respecto a los valores de referencia propuestos. En efecto, la OMS ha modificado los valores de corte desde el 10% en la segunda edición del manual de la OMS (1987) al 20% en la tercera edición (1992) hasta el 50% en la 4ª edición (1999). Para concluir, diremos que algunas de las principales sociedades (WHO, 1999; Kvist and Björndahl, 2002) recomiendan el MAR test o bien el IBT, sin decantarse por ninguno de ellos, a pesar de que sus resultados difieren ligeramente entre sí (Andreou el al., 1995).
ALTERNATIVAS TERAPÉUTICAS
Corticoterapia inmunosupresora
Desde que Bassili y el-Alfi (1970) y posteriormente Shulman (1976) propusieron la corticoterapia como tratamiento de la infertilidad por AAE, diversas pautas de glucocorticoides se han venido utilizando con éxito irregular. La metilprednisolona (96 mg/día) o la prednisona (15-60 mg/día) fueron los esteroides más utilizados inicialmente. Las pautas intermitentes tenían como objeto reducir los efectos secundarios. Los resultados globales de la corticoterapia aislada son poco convincentes (para una revisión ver Hatasaka, 2000). Los métodos de análisis son muchas veces imprecisos, y las pautas de tratamiento y su duración se han establecido arbitrariamente. Únicamente cinco de los estudios publicados hasta hoy están controlados con placebo. Tres de ellos encuentran que el tratamiento esteroideo no es útil (De Almeida et al., 1985; Haas and Manganiello, 1987; Bals-Pratsch el al., 1992) mientras que otros dos llegan a la conclusión contraria (Hendry et al., 1990; Omu el al., 1996).
La corticoterapia se acompaña de una cierta mejoría de la movilidad y la concentración espermática. Igualmente, existe acuerdo en que hay disminución del nivel de AAE, cualquiera que sea el método diagnóstico usado. Pero ninguno de estos cambios se traduce en incremento claro de gestaciones. Los factores que se relacionan con un mejor pronóstico son (a) esterilidad secundaria, duración menor de 2 años, (b) positividad moderada (<75% de positividad en IBT), (c) patrón de localización de AAE en flagelo (Sharma 1995 et al., Bassas et al., 1995). El hecho de que disminuyan los AAE sin que desciendan las inmunoglobulinas totales es interpretado por algunos autores en el sentido que la acción de la corticoterapia es más antiinflamatoria que inmunosupresora (Scarselli el al., 1987).
Teniendo en cuenta la eficacia limitada de los corticoides y los efectos secundarios que pueden producir, durante los últimos años no se han publicado ensayos clínicos usando este tratamiento, y el consenso general es el de abandonar la corticoterapia.
Otros inmunosupresores
Han habido tímidos intentos de usar inmunosupresores más selectivos que los corticoides. En 1986, Lovett et al. sugirieron que la administración de ciclosporina antes de la vasectomía en ratas era capaz de prevenir la formación de AAE. Los estudios clínicos en humanos se limitan a un pequeño grupo de 9 hombres con factor autoinmune que recibieron ciclosporina A (Bouloux et al., 1986). Hubo tres gestaciones, pero dos de ellas no estaban directamente relacionadas con el tratamiento. Sin embargo la ciclosporina o la azatioprina tienen efectos perjudiciales sobre la espermatogénesis, y existe poca predisposición a usar estos fármacos en hombres por otra parte sanos.
Inseminación artificial conyugal
La inseminación artificial con semen de marido se empezó a aplicar pronto para la indicación inmunológica (Ulstein, 1973). La justificación provenía del frecuente hallazgo de tests postcoitales y pruebas de interacción moco-semen patológicas en estos pacientes. Los resultados clínicos reflejaron que también los casos con AAE se benefician de la estimulación de la ovulación y de la inseminación intrauterina (Confino et al., 1986; Glazener et al., 1987). En conjunto la inseminación artificial conyugal intrauterina (IACI) consigue entre un 5 y un 12% de gestación por ciclo. Constituye por tanto una opción aceptable para este tipo de indicación. A pesar de que no hay evidencia de que el proceso de inseminación desencadene o empeore la producción de AAE por el organismo femenino, algunos autores han desaconsejado el uso de cualquier forma de inseminación usando especímenes con AAE (Francavilla et al., 1999).
Asociación de corticoides e inseminaciones
Vistas las respectivas limitaciones de los inmunosupresores y de las inseminaciones, algunos estudios han comparado diversas combinaciones de tratamiento. Robinson et al. (1995), comparó inseminaciones intrauterinas con la fecundación natural en un diseño cruzado. En ambas ramas del tratamiento se administraron 40 mg/día de prednisolona los días 1-10. Los resultados muestran una tasa acumulada de gestación del 39% con IAC (11,5% por ciclo) frente al 4,8% (1,2% por ciclo natural) durante la corticoterapia aislada. Láhteenmáki et al. (1995a) realizó un estudio comparativo entre la corticoterapia cíclica a dosis bajas y la IAC. Cada modalidad terapéutica se aplicó por 3 ciclos de forma excluyente. Los resultados fueron de nuevo favorables a las técnicas de reproducción asistida frente a prednisolona más coito dirigido. Hay que recordar que el análisis basado exclusivamente en términos de fecundidad por ciclo ignora el hecho de que ambos tratamientos son poco comparables, y sugiere que es el procedimiento de inseminación más estimulación ovulatoria y no el efecto de los esteroides, el responsable de los resultados observados.
Para averiguar si la inmunosupresión potencia el efecto de la reproducción asistida, Grigoriou et al. (1996) comparó IAC aislada con IAC más prednisolona en un diseño cruzado, sin observar ningún efecto beneficioso de la corticoterapia. Nuestra propia experiencia se orienta en la misma dirección (Bassas et al., 1995).
Fecundación in vitro
La fecundación in vitro (FIV) parece ser útil en muchos casos en los que otros tratamientos han resultado ineficaces (Clarke et al., 1988). Además, la FIV constituye la principal opción terapéutica en casos de isoAAE producidos por la mujer. A pesar de que la fecundación tiende a estar reducida en presencia de AAE, los embriones que se obtienen muestran buena capacidad de desarrollo y de implantación (Hadito et al., 1995; Lähteenmäki, 1993). La proporción de espermatozoides positivos a AAE está inversamente relacionada con el índice de fecundación (Rajah et al., 1993). La intensidad de la reacción autoinmune ejerce un efecto más o menos acusado según el tipo de inmunoglobulina involucrada, y también según la localización topográfica en el espermatozoide. Al parecer es necesario > 90% de positividad para IgG, pero sólo > 70% con IgA, y > 40% con IgM para bloquear apreciablemente la fecundación. Cuando los AAE se unen a la cabeza espermática los efectos son más acusados que si la unión se produce a otras regiones, como la cola o el segmento intermedio (Clarke et al., 1988; Yeh et al., 1995).
ICSI
La aplicación de la microinyección intracitoplásmica de espermatozoides parece a priori una buena opción para superar los posibles efectos de la AAE en la interacción con la zona pelúcida y la fusión ovocitaria. Nagy et al. (1995) comunicó los primeros resultados empleando esta técnica en pacientes fuertemente positivos para AAE. La tasa de fecundación y división fue mejor en estos pacientes que en los controles AAE negativos. Los autores sugirieron que los efectos inductores de la reacción acrosómica de los AAE pudieran haber facilitado la mayor eficacia de la ICSI en los sujetos con factor autoinmune. Otros estudios posteriores confirman que la ICSI consigue fecundación en casos de AAE en una proporción no inferior a la de pacientes AAE de equivalentes características seminales (Lähteenmäki et al., 1995b; Clarke et al., 1997, Mercan et al., 1998; Check et al., 2000), aunque en algunos casos la calidad embrionaria fue peor y la frecuencia de abortos mayor en el grupo de AAE positivos (Lähteenmäki et al., 1995b).
Tratamientos espermáticos en el laboratorio
Las técnicas convencionales de tratamiento de semen no son útiles para disociar los anticuerpos que están unidos a las menbranas de los espermatozoides. Ni la dilución rápida y lavado del semen en medio de cultivo, ni el uso de antígeno espermático como inmunoabsorbente son útiles (Lenzi et al., 1988) ya que -contrariamente a lo que se creía- los AAE se unen a los gametos en regiones bastante proximales de la vía seminal y no en el momento de formarse el semen (Patricio et al., 1992). Además, su alta afinidad impide que se disocien. Aunque la utilización de medio de cultivo con albúmina o suero no inmune disminuye transitoriamente la positividad de las pruebas de detección de AAE, no hay auténtica eliminación de inmunoglobulinas. Tampoco es eficaz la centrifugación en gradientes densitométricos.
Algunos autores han encontrado disminución en los niveles de positividad para AAE en espermatozoides capacitados, en comparación con los no capacitados (Monroe et al., 1990). Ciertas moléculas adheridas de forma lábil a la membrana espermática externa podrían constituir dianas antigénicas para los AAE. Los cambios que ocurren en la membrana plasmática durante la capacitación, podrían facilitar la eliminación de los complejos antígeno-anticuerpo, y restituyendo la capacidad funcional espermática. Estos gametos capacitados podrían ser útiles para fecundación in vitro (Lenzi et al., 1992).
La selección de aquellos espermatozoides que están libres de AAE es en principio más fácil de conseguir. Para ello, se han utilizado métodos de inmunoadherencia basados en la utilización de proteína A (que se une a las IgG) o en la incubación con inmunoesferas a las que se han unido anti-inmunoglobulinas específicas. Estos métodos, similares a los usados para diagnóstico, se han combinado con la separación por gravedad o campo magnético (Kiser et al., 1987; Foresta et al., 1990; Verheyen et al., 1994; Ryan et al., 1994). También se ha aplicado la filtración por medio de partículas de dextrano, Sephadex G200 (Kiser et al., 1987). El problema al que se enfrentan todos estos procedimientos es que el rendimiento final de la selección espermática es muy pobre, al menos en los casos más fuertemente positivos. Incluso los gametos que superan la inmunoabsorción, siguen presentando AAE, y su funcionalidad en ténicas de reproducción asistida no es mejor que la del semen no tratado (Verheyen et al., 1994).
Bronson et al. (1987) propuso la proteolisis específica de las inmunoglobulinas tipo A1. Para ello, incubó espermatozoides AAE positivos con una proteasa producida por Neisseria gonorhoeae (Halter et al., 1984). Los espermatozoides tratados mostraron un marcado descenso de la positividad para IgA1, y la capacidad de penetración en moco cervical mejoró en el 64% de los casos. Posteriormente se confirmó que el tratamiento in vitro con proteasas anti-IgA1 es efectivo para lisar parte de los AAE unidos (Kutteh et al., 1994; Kutteh et al., 1995). Aunque las proteasas anti-IgA pueden representar un avance en el tratamiento de los AAE, no podemos olvidar que en la mayoría de los casos las IgG coexisten con -o incluso predominan sobre- las IgA. Puesto que no se dispone de proteasas anti-IgG, la única alternativa para tratar de actuar sobre todas las inmunoglobulinas es recurrir a enzimas proteolíticas no específicas. Siguiendo esta estrategia, Pattinson et al. (1990a; 1990b) demostró que la quimiotripsina y especialmente la tripsina pueden reducir las aglutinaciones espermáticas dependientes de AAE. Además, la tripsina parece tener un efecto favorecedor de la motilidad espermática (Cohen and Asfjes, 1982). Se ha aplicado con éxito el tratamiento in vitro de espermatozoides mediante la combinación de quimiotripsina y galactosa en parejas sometidas a IACI (Bollendorf et al., 1994).
Anticuerpos antitesticulares
La presencia de anticuerpos antitesticulares es infrecuente, y ha sido menos investigada que la autoinmunidad antiovárica. Los síndromes poliendocrinos autoinmunitarios presentan alteraciones de diversas glándulas endocrinas, entre las que se puede incluir el ovario y el testículo con una frecuencia baja. El tipo I es de inicio prepuberal, y en él se asocian la enfermedad de Addison y el hipoparatiroidismo, así como otras alteraciones no endocrinas (Betterle et al., 1998). El tipo II, inicialmente denominado síndrome de Schmidt debuta en edad adulta con enfermedad de Addison, tiroidopatía autoinmune y diabetes mellitus tipo I (Farloni et al., 2002). En ambas formas del síndrome se pueden observar también manifestaciones autoinmunitarias no endocrinas, como anemia perniciosa, vitíligo, alopecia, candidiasis mucocutánea, malabsorción y hepatitis crónica activa. La afectación gonadal se expresa con un patrón de hipogonadismo primario (Maclaren et al., 2001). No obstante, puede haber hipogonadismo en una forma todavía más rara, que se ha denominado también síndrome de Barkan, en el que existe afectación hipofisaria (Barkan et al., 1985).
Los autoanticuerpos pueden estar dirigidos contra las células de Leydig, Sertoli, y contra enzimas involucradas en la esteroidogénesis (Soderbergh et al., 1996).
Es muy probable que ciertos procesos testiculares adquiridos se acompañen de una respuesta autoinmune inducida por la lesión. Así, las infecciones víricas (Fountain et al., 1997) o la torsión testicular (Sinisi et al., 1993) pueden producir autoinmunidad humoral y celular conjunta contra antígenos gonadales y espermáticos. De hecho, los AAE pueden asociarse a orquitis alérgica y anomalías de la espermatogénesis. Aunque la existencia de fenómenos típicos de orquitis alérgica (infiltrados linfocitarios en el intersticio testicular) no se observan con frecuencia, algunos pacientes con títulos elevados de AAE suelen presentar bajos recuentos espermáticos, a menudo asociados a otras alteraciones de la maduración espermática y sin otras causas aparentes de riesgo para fenómenos de autoinmunización (Zhong et al., 1989). Una de las regiones más susceptibles a la acción inflamatoria de los leucocitos activados parece ser la rete testis (Tung et al., 1971). Esta zona de paso obligado no es accesible a la biopsia testicular, y en caso de afectación puede dar lugar a obstrucciones intratesticulares y a oligozoospermia (Rümke and Hellinga, 1959). Los antígenos afectados pueden incluir el epidídimo (Fichorova et al., 1995).
No existen ensayos clínicos en los que se han intentado tratamientos específicos para la autoinmunidad testicular, y la única opción es -al igual que para otras endocrinopatías- la sustitución hormonal cuando hay hipoandrogenismo, y las técnicas de reproducción asistida para los casos que consultan por subfertilidad.
Anticuerpos antiováricos y antiovocitarios
La detección de anticuerpos antiováricos (AAO) se realizó inicialmente en mujeres afectas de enfermedad de Addison (Irvine et al., 1968). Posteriormente, se han encontrado en otras enfermedades de estirpe autoinmune, como la insuficiencia endocrina múltiple tipo I y tipo II, lupus eritematoso sistémico, miastenia gravis, etc. También se han detectado AAO en casos de fallo ovárico prematuro idiopático, y en procesos adquiridos, como endometriosis, enfermedad inflamatoria pélvica e infertilidad (Geva et al., 1997). La actividad autoinmune puede incluir diversos tejidos, como las células de la teca, cuerpo lúteo, células de la granulosa, ovocitos e intersticio (Coulam et al., 1981). El mecanismo de acción podría ser interfiriendo las acciones de la FSH y la LH en sus receptores. Sin embargo, esto se ha podido documentar en pocas ocasiones (Scully, 1986; Moncayo et al., 1989). Los efectos sobre la función de las células de la granulosa podrían manifestarse en una reducción de la capacidad para sintetizar progesterona (McNatty et al., 1975). También se ha descrito reacción inflamatoria con infiltrados celulares de linfocitos y células plasmáticas alrededor de los folículos (Sedmark et al., 1987). Se ha propuesto que la estimulación hormonal repetida asociada a las TRA , y sobre todo los microtraumas producidos durante la punción folicular, podrían desencadenar una reacción autoinmune contra diversos componentes del ovario (Gobert et al., 1992).
La zona pelúcida es una estructura acelular glicoprotéica que recubre y protege el ovocito, a la vez que juega un importante papel en la selección y el reconocimiento de los gametos masculinos, y en la reacción acrosómica. En experimentos clásicos, la inmunización activa de diversas especies animales con extractos de ZP producen esterilidad temporal (Mahi-Brown et al., 1985), o alteraciones de la maduración folicular (Gulyas et al., 1983). Asimismo, la administración de anticuerpos monoclonales dirigidos contra la ZP3 de ratón impide la unión y penetración de los espermatozoides de la misma especie (East et al., 1984).
Algunos estudios clásicos que estudiaban anticuerpos anti-ZP en humanos mostraban resultados discordantes y difíciles de interpretar (Sacco and Moghisse, 1979; Nishimoto et al., 1980). Hay que tener en cuenta que hace algunos años la dificultad para conseguir ovocitos humanos obligaba a usar antígenos de otras especies como substrato para identificar los anticuerpos séricos. Más recientemente, nuevas investigaciones sugieren que la prevalencia de AAO puede explicar fallos de fecundación y de implantación en mujeres sometidas a FIV (Horejsi et al., 2000, Geva et al., 1999), y también en reproducción natural (Luborsky and Pong, 2000). En mujeres que presentan anticuerpos anti-ZP, la aplicaión de ICSI incrementa significativamente la tasa de gestación (Mardesic et al., 2000). Esta información orienta a las alternativas de tratamiento en pacientes con este tipo de autoinmunidad.
A pesar de las evidencias circunstanciales expuestas, la falta de estandarización de métodos de laboratorio, y sobre todo la ausencia de amplios estudios suficientemente convincentes, han mantenido hasta ahora el estudio de AAO y antiovocitarios fuera de las pautas de actuación clínica habitual.
SUMARIO
Poco a poco se van aclarando diversos aspectos de la respuesta autoinmune sobre los gametos y las gónadas, y sus consecuencias biológicas, pero la abundante información acumulada no parece convencer a muchos expertos, que más bien se muestran escépticos sobre la importancia del componente autoinmune en la etiología de la infertilidad (Kallen and Arici, 2003; Zeynelogiu and Yarali, 2002). Las razones de esta relativa incredulidad son:
(a) Aunque todos los datos acumulados son creíbles y aportan pruebas indirectas de interés, faltan estudios diseñados de acuerdo con las exigencias de la medicina basada en la evidencia, que relacionen clara y definitivamente los AAE (y aún más los AAT y AAO) con la infertilidad.
(b) Los métodos diagnósticos actuales no son lo bastante precisos y específicos, y ello repercute adicionalmente en la credibilidad de los datos epidemiológicos.
(c) Desde el punto de vista práctico la utilidad del estudio de anticuerpos es limitada, a falta de tratamientos específicos eficaces.
En todo caso, el estado de opinión no cambiará mientras no se realicen nuevos avances diagnósticos. En la actualidad, el tratamiento más eficaz para superar los posibles efectos de los AAE y AAO es la ICSI, aunque se vislumbran posibilidades reales de conseguir atenuar los efectos nocivos de los AAE en los gametos masculinos por medio de tratamientos enzimáticos en el laboratorio.
Por otro lado, la mayor parte de las investigaciones actuales se centran en el análisis y estudio funcional de los antígenos espermáticos correspondientes a los AAE, de modo que en el futuro sea posible identificar con mayor certeza los casos en los que el factor autoinmune compromete realmente la función reproductiva. Además, estas investigaciones ampliarán el conocimiento de los mecanismos biológicos de la fecundación, y probablemente puedan usarse en el desarrollo de nuevos métodos contraceptivos.
Referencias
Aitken RJ, Parslow JM, Hargreave TB, Hendry WF. Influence of antisperm antibodies on human sperm function. Brit J Urol 1988; 62:367-73.
Alexander NJ, Anderson DJ. Immunology of semen. Fertil Steril 1986; 47:192-205.
Andreou E, Mahmoud A, Vermeulen L, Schoogans F, Comhaire F. Comparison of differents methods for the investigation of antisperm antibodies on spermatozoa, in seminal plasma and serum. Hum Reprod 1995; 10:125-31.
Auer J, Pignot-Paintrand I, De Almeida M. Identification of human sperm surface glicoproteins by sperm membrane-specific autoantibodies. Hum Reprod 1995; 10:551-57.
Bals-Pratsch M, Doren M, Karbowski B, Schneider HPG, Nieschlag E. Cyclic corticosteroid immunosupression in unsuccessful in the treatment of sperm antibody-related male infertility: a controled study. Hum Reprod 1992;7:99-104.
Barkan AL, Kelch RP, Marchall JC. Isolate gonadotrope failure in the polyglandular autoimmune syndrome. N Engl J Med 1985; 312:1535-40.
Bassas L, Mata A, López O, Antich M, Almará R, Ruiz-Romero J. Valoración de dos nuevos métodos de enzimoinmunoanálisis para el diagnóstico de anticuerpos antiespermáticos. En: ASESA (ed) V Congreso Nacional de Andrología. Libro de ponencias y resúmenes: 1991, p. 285.
Bassas L, Segura A, Torrús C, López O Valoración crítica de las alternatives terpéuticas del factor inmunológico en la infertilidad masculine. En: ASESA (ed) VII Congreso Nacional de Andrología. Libro de ponencias y resúmenes. Bilbao; 1995. p 134-46.
Bassili F, el-Alfi OS. Immunological aspermatogenesis in man. Response to corticosteroids in cases of non-obstructive azoospermia eith a positive blastoid transformation test. J Reprod Fertil 1970; 21:29-35.
Batova IN, Richardson RT Widgren EE, O'Rand MG. Analysis of the autoimmune epitopes on human testicular NASP using recombinant and synthetic peptides. Clin Exp Immunos 2000; 121:201-9.
Betterle C, Greggio NA, Volpato M. Clinical review 93: Autoimmune polyglandular syndrome type 1.J Clin Endocrinol Metab 1998; 83:1049-55.
Bollendorf A, Check JH, Katsoff D, Fedele A. The use of chymotrypsin/galactose to treat spermatozoa bound with antisperm antobodies prior to intra-uterine insemination. Hum Reprod 1994; 9:484-8.
Bohring C, Skrzypek J, Krause W. Influence of antisperm antibodies on the acrosome reaction as determined by flow cytometry. Fertil Steril 2001; 76:275-80.
Bohring C, Krause W. Immune infertility: towards a better understanding of sperm (auto)-immunity. The value of proteomic analysis. Hum Reprod 2003; 18:915-94.
Bouloux PMG, Wass JAH, Parslow JM, Hendry WF, Besser GM. Effect of cyclosporin A in male autoimmune infertility. Fertil Steril 1986; 46:81-5.
Bronson RA, Cooper GW, Rosenfeld DL. Correlation between regional specificity of antisperm antibodies to the spermatozoan surface and complement-mediated sperm immobilization. Am J Reprod Immunol 1982; 2:222-4.
Bronson RA. Inmunologic abnormalities of the female reproductive tract. En: Gondos B, Riddick DH (eds) Pathology of infertility. Clinical correlations in the male and female. New York: Thieme Medical Pub; 1987. p. 13-28.
Bronson RA, Cooper GW, Rosenfeld DL. Effect of IgA1 protease on immunoglobulins bound to the sperm surface and sperm cervical mucus penetrating ability. Fertil Steril 1987; 47:985-91.
Bronson RA. The role of antisperm antibodies in impaired sperm function. En: Whitcomb RN, Zirkin BR (eds) Understan ding male infertility: basic and clinical approaches. Serono Symposia, vol 98, Raven Press, New York. 1993. p. 229-44.
Bronson R. Antisperm antibodies: a critical evaluation and clinical guidelines. J Reprod Immunol 1999; 45:159-183.
Check ML, Check JH, Katsoff D. et. al. ICSI as an effective therapy for male factor with astisperm antibodies. Arch Androl. 2000; 45:125-30.
Clarke GN, Elliot PJ, Smile C. Detection of sperm antibodies in semen using the immunobead test: a survey of 813 consecutive patiens. Am J Reprod Immunol Microbiol 1985; 7:118-23.
Clarke GN, Hyne RV, du Plessis Y, Ian W, Johnston H. Sperm antibodies and human in vitro fertilization. Fertil Steril 1988; 49:1018-25.
Clarke GN, Lopata A, McBain JC. Effect of sperm antibodies in males on human in vitro fertilization (IVF). Am J Reprod Immunol Microbiol 1985; 8:62-6.
Clarke GN, Bourne M, Baker HWG. Intracytoplasmic sperm injection for treating infertility associated with sperm autoimmunity. Fertil Steril 1997;68:112-7.
Cohen J, Aafjes JH. Proteolitic enzymes stimulate spermatozoal motility and in vitro hamster egg penetration. Life Sci 1982; 30-899-904.
Comhaire FH, Hinting A, Vermeulen L, Schoojans F, Goethals I. Evaluation of the direct and indirect mixed antiglobulin reaction with latex particles for the diagnosis of immunological infertility. Int J Andrology 1987; 11:37-44.
Confino E, Friberg J, Dudkiewicz AB. Intrauterine inseminations with washed human spermatozoa. Fertil Steril 1986; 46:55-60.
Coulam CB, Kempers RD, Randall RV. Premature ovarian failure: evidence for autoimmune mechanism. Fertil Steril 1981; 36:238-40.
Daitoh T, Kamada M, Yamano S, Murayama S, Kobayashi T, Maegawa M, Aono T. High implantation rate and consequently high pregnancy rate by in vitro fertilization-embryo transfer treatment in infertile women with antisperm antibodies. Fertil Steril 1995; 63:87-91.
De Almeida M, Feneux D, Rigaud C, Jouannet P. Steroid therapy for male infertility associated with sperm antibodies. Results of a small randomized clinical trial. Int J Androl, 1985; 8:111-7.
De Almeida M, Sounah, A, Jouannet, P. Incidence of sperm-associated immunoglobulins in infertile men suspected of antisperm autoimmunity. Int J Androl 1986; 9:321-30.
Diekman AB, Norton EJ, Westbrook VA, Klotz KL, Naaby-Hansen S, Kerr JC. Anti-sperm antibodies from infertile patients and their cognate sperm antigens: a review. Identity between SAGA-1 the H6-3C4 antigen, and CD52. Am J Reprod Immunol 2000; 43:134-43.
Dym M, Fawcett DW. The blood-testis barrier in the rat and the physiological compartmentation of the seminiferous epithelium. Biol Reprod 1970; 3:308-26.
East IJ, Mattison DR, Dean J. Monoclonal antobodies to the major protein of the murine zona pellucida: effects on fertilization and early development. Dev Biol, 1984; 104:49-56.
Eggert-Kruse W, Bochem-Hellwig S, Doll A. Antisperm antibodies in cervical mucus in an unselected subfertile population. Hum Reprod, 1993; 8:1025-31.
El-Demiry MIM, Hargreave TB, Busutil A. Lymphocyte subpopulations in the male genital tract. Br J Urol 1985; 57:769-74.
Farloni A, Laureti S, Santeusanio F. Autoantibodies in autoimmune polyendocrine syndrome type II. Endocrinol Metab Clin North Am 2002; 31:369-89.
Fichorova RN, Dimitrova E, Nakov L, Tzvetkov D, Penkov R, Taskov A. Detection of antibodies toward epididymal sperm antigens. A obligatory step in evaluation of human immunologig infertility. Am J Reprod Immunol 1995; 33:341-9.
Foresta C, Varotto A, Caretto A. Immunomagnetic method to select human sperm without sperm surface-bound autoantibodies in male autoimmune infertility. Arch Androl 1990; 24:221-5.
Fountain S, Holland MK, Hinds LA, Janssens PA, Kerr PJ. Interstitial orchitis with impaired steridogenesis and spermatogenesis in the testes of rabbits infected with an attenuated strain of myxoma virus. J Reprod Fertil 1997; 110:161-9.
Francavilla F, Roman R, Santucci R. Effect of sper-antibodies on acrosome reaction of human esperm used for the hamster egg penetration assay. Am J Reprod Immunol 1991;25:77-80.
Francavilla F, Romano R, Santucci R. Naturally ocurring astisperm antibodies in men: interference with fertility and implications for treatment. Front Biosci 1999; 4:9-25.
Friberg J A simple and sensitive micro-method for demonstration of spermagglutinating activity in serum from infertile men and women. Acta Obstet Gynecol Scand, 1974; 36 (suppl):21-9.
Friberg J. Autoagglutination in ejaculates caused by sperm-agglutinating antibodies. Am J Immunol Microbiol 1980; 1:44-8.
Geva E, Amit A, Lerner-Geva L, Lessing JB. Autoimmunity and reproduction. Fertil Steril 1997; 67:599-611.
Geva E, Fait G, Lerner-Geva L, Lessing JB, Swartz T, Wolman I, Daniel Y, Amit A. The possible role of antiovary antibodies in repeated in vitro fertilization failures. Am J Reprod Immunol 1999; 42:292-6.
Glazener CM, Coulson C, Lambert PA. The value of artificial insemination with husband's semen in infertility due to failure of postcoital sperm-mucus penetration. Controlled trial of treatment. Br J Obstet Gynaecol 1987; 94:774-8.
Gobert R, Barbarino-Monnier P, Guillet-May F, Bene MC, Faure GC. Antiovarian antibodies after attempts at human in vitro fertilization induced by folicular puncture rather than hormonal stimulation. J Reprod Fert 1992; 96:213-8.
Grigoriou O, Konidaris S, Antonaki V, Papadias C, Gargaropoulos A. Corticosteroid therapy does not improve the results intrauterine insemination in male subfertility caused by antisperm antibodies. Eur J Obstet Gynecol Reprod Biol 1996; 65;227-20.
Gulyas BJ, Gwatkin RBL, Yuan LC. Active inmunization of cynomolgus monkeys (Macaca fascicularis) with porcine zona pellucidae. Gamete Res 1983; 4:299-307.
Haas GG Jr. The inhibitory effect of sperm-associated immunoglobulins on cervical mucus penetration. Fertil Steril 1986; 46:334-7.
Haas GG Jr, Manganiello P. A double-blind, placebo-controlled study of the use of methylprednisolone in infertile men with sper-associated immunoglobulins. Fertil Steril, 1987; 47:295-301.
Haas GG, DeBault LE, D'Cruz O, Shuey R. The effect of fixatives and/or air-drying on the plasma and acromosomal membranes of human sperm. Fertil Steril 1988; 50:487-92.
Halter R, Pohlner J, Meyer TF. IgA protease of Neisseria gonorhoeae: isolation and characterization of the gene and its extracellular product. EMBO Journal, 1984; 3:1595-1601.
Hatasaka H. Immunologic factors in infertility. Clin Obstet Gynecol 2000; 43;830-843.
Helmerhorst FM, Finken MJJ, Erwich JJ. Detection assays for antisperm antibodies: what do they test? Hum Reprod 1999; 14:1669-71.
Hendry WF, Hughes L, Scammen G, Pryor JP, Hargreave TB. Comparison of prednisolone and placebo in subfertile men with antibodies to spermatozoa. Lancet 1990; 335:85-8.
Horejsi J, Martinek J, Novakova D, Madar J, Brandejska M. Autoimmune antiovarian antibodies and their impact on the success of an IVF/ET program. Ann NY Acad Sc 2000; 900:351-6.
Ingerslev HJ, Moller NPH, Jager S. Immunoglobulin class of sperm antibodies in cervical mucus from infertile women. Am J Reprod Immunol 1982; 2:296-300.
Irvine WJ, Chan MMW, Scarth L, Kolb FO, Hatog M, Bayliss RIS. Immunological aspects of premature ovarian failure associated with idiopathic Addison's disease. Lancet 1968; 2:883-7.
Jager S, Kremer J, Van Slochteren-Draaisma T. A simple method of screening for antisperm antibodies in the human male. Detection of spermatozoal surface IgG with the direct mixed antiglobulin reaction carried out on untreated fresh human semen. Int J Fertil 1978; 23:12-21.
Kallen CB, Arici A. Immune testing in fertility practice: truth or deception? Curr Opin Obstet Gynecol 2003; 15:225-31.
Kiser GC, Alexander NJ, Fuchs EF, Fulgham BA. In vitro immune absorption of antisperm antibodies with immunobead-rise, imuno-magnetic, and immunocolumn separation techniques. Fertil Steril 1987; 47:466-74.
Koide SS, Wang L, Kamada M. Antisperm antibodies associated with infertility: properties and encoding genes of target antigens. Proc Soc Exp Biol Med 2000; 224:123-32.
Kutteh WH, Kilian M, Ermel LD, Byrd EW, Mesteecky J. Antisperm antibodies (ASA) in infertile males: subclass distribution of IgA antibodies and the effect of an IgA1 proteases on sperm-bound antibodies. Am J Reprod Immunol 1994; 31:77-83.
Kutteh WH, Kilian M, Ermel LD, Mestecky J. Antisperm antibodies in infertile women: subclass distribution of immunoglobulin (Ig) A antibodies and removal of Ig A sperm bound antibodies with a specific IgA1 protease. Fertil Steril 1995; 63:63-70.
Kvist U, Björndahl L. Manual on basic semen analysis. ESHRE Monographs, issue 2. Oxford University Press, Oxford, 2002.
Lähteenmäki A. In-vitro fertilization in the presence of antisperm antibodies detected by the mixed antiglobulin reaction (MAR) and the tray agglutination test (TAT). Hum Reprod 1993; 8:84-8.
Lähteenmäki A, Veilahti J, Hovatta O. Intrauterine insemination versus cyclic, low-dose prednisolone in couples with male antisperm antibodies. Hum Reprod 1995a; 10:142-7.
Lähteenmäki A, Reima I, Ottawa O. Treatment of severe male immunological infertility by intracytoplasmic sperm injection. Hum Reprod 1995b; 10:2824-2828.
Lenzi A, Gandini L, Claroni F. Immunological usefulness of semen manipulation for artificial insemination homologous (AIH) in subjectos with antisperm antibodies bound to sperm surface. Andrologia 1988; 20:314-21.
Lenzi A, Gandini L, Lombardo F. In vitro sperm capacitation to treat antisperm antibodies bound to sperm surface. Am J Reprod Immunol 1992; 28:51-5.
Lombardo F, Gandini L, Anticoli L. Can computer analysed sperm motility be normal in seminal samples with high percentage of antisperm antibody bound to sperm surfaces? J Immunol Immunopharmacol 1992; 2:115.
Lombardo F, Gandini L, Dondero F, Lenzi A. Immunology and immunopathology of the male genital tract. Antisperm immunity in natural and assisted reproduction. Hum Reprod Update 2001; 7:450-6.
London SN, Haney AF, Weinberg JB. Macrophages and infertility: enhancement of human macrophage-mediated sperm killing by antisperm antibodies. Fertil Steril 1985; 43:274-8.
Lovett J, Nyberg LM Jr, Brown S, Mathur S. Supression of post-vasectomy cytotoxic sperm antibody formation in rats by a shortterm pretreatment with cyclosporine. Am J Reprod Immunol Microbiol 1986; 11:65-8.
Luborsky J, Pong R. Pregnancy outcome and ovarian antibodies in infertility patients undergoing ovarian hyperstimulation. Am J Reprod Immunol 2000; 44:261-5.
Maclaren N, Chen QY, Kukreja A, Markeer J, Zhang CH, Sun ZS. Autoimmune hypogonadism as part of an autoimmune polyglandular syndrome. J Soc Gynecol Investig 2001; 8 (1 suppl proceedings) S52-54.
Mahi-Brown CA, Yanagimachi R, Hoffman JC. Fertility control in the bitch by active immunization with porcine zona pellucida: use of different adjuvants and patterns of estradiol and progesterone levels in estrous cycles. Biol Reprod 1985; 32:761-72.
Mahoni MC, Blackmore PF, Bronson RA. Inhibition of human sperm-zona pellucida tight binding in the presence of antisperm antibody positive polyclonal patient sera. J Reprod Immunol 1991; 19:287-301.
Mardesic T, Ulcova-Gallova Z, Huttelova R, Muller P, Voboril J, Mikova M, Hulvert J. The influence of different types of antibodies on in vitro fertilization results. Am J Reprod Immunol 2000, 43:1-5.
Mathur S, Barber M, Carlton M, Zeigler J, Williamson HO. Motion characteristics of spermatozoa from men with cytotoxic antibodies. Am J Reprod Immunol Microbiol 1986; 12:87-90.
Menge AC, Rosenberg A, Burkons DM. Effects of uterine fluids and immunoglobulins from semen-immunized rabbits on rabbit embryos cultured in vitro. Proc Soc Exp Biol Med 1974; 145:371-8.
Mercan R, Oehninger S, Muasher SJ, Toner JP, Mayer J Jr, Lanzendorf SE. Impact of fertilization history and semen parameters on ICSI outcome. J Assist Reprod Genet 1998; 15:39-45.
McNatty KP, Short RV, Barnes EW, Irvine WJ. The cytotoxic effect of the serum from patients with Addison's disease and autoimmune ovarian failure on human granulosa cells in culture. Clin Exp Immunol 1975; 22:378-84.
Moncayo H, Moncayo R, Benz R, Wolf A, Lauritzen Ch. Ovarian failure and autoimmunity. J Clin Invest 1989; 84:1957-65.
Monroe JR, Althensen DC, Mathur S. Changes in sperm antibody test results when spermatozoa are subjected to capacitating conditions. Fertil Steril 1990; 54:1114-20.
Munuce MJ Berta CL, Pauluzzi F, Caille AM. Relationship between antisperm antibodies, sperm movement and sperm quality. Urol Int 2002; 65:200-3.
Naggy ZP, Verheyen G, Liu J. Results of 55 intracytoplasmic sperm injection cycles in the treatment of male-immunological infertility. Hum Reprod 1995; 10:1775-80.
Naz RK, Zhu X, Kadam AL. Identification of human sperm peptide sequence involved in egg binding for immunocontraception. Biol Reprod 2000; 62:318-324.
Nishimoto T, Mori T, Yamada I. Autoantibodies to zona pellucida in infertile and aged women. Fertil Steril, 1980; 34:552-6.
Noor MM, Moore HD. Monoclonal antibody that recognizes an epitope of the sperm equatorial region and specifically inhibits sperm-oolemma fusion but not binding. J Reprod Fertil 1999; 115:215-24.
Ohl DA, Naz RK. Infertility due to antisperm antibodies. Urology 1995; 46:591-602.
Omu AE, al-Qattan F, Abdul Hamada B. Effect of low dose continuous corticosteroid therapy in men with astisperm antibodies on spermatozoal quality and conception rate. Eur J Obstet Gynecol Reprod Biol 1996; 69:129-34.
O'Rand MG. Modification of the sperm membrane during capacitation. Annals NY Acad Sciences 1982; 383:392-402.
Patricio P, Bronson R, Silber SJ. Testicular origin of immunobead reacting antigens in human sperm. Fertil Steril 1992; 57:183-7.
Pattinson HA, Mortimer D, Curtis EF, Leader A, Taylor PJ. Treatment of spermagglutination with proteolitic enzimes. I. sperm motility, vitality, longevity and sucessful disagglutination. Hum Reprod 1990a; 5:167-73.
Pattinson HA, Mortimer D, Taylor PJ. Treatment of spermagglutination with proteolitic enzimes. II. Sperm function after enzymatic disagglutination. Hum Reprod 1990b; 5:174-8
Rajah SV, Parslow JM, Howell RJ, Hendry WF. The effects of in-vitro fertilization of autoantibodies to spermatozoa in subfertile men. Hum Reprod 1993; 8:1079-82.
Robinson NJ, Forman RG, Nicholson SC, Maciocia CR, Barlow DH. A comparison of intrauterine insemination in superovulated cycles to intercourse in couples where the male is receiving steroids for the treatment of autoimmune infertility. Fertil Steril 1995; 63:1260-6.
Rümke PH, Hellinga G. Autoantibodies against spermatozoa in sterile men. Am J Clin Pathol 1959; 32:357-63.
Rusell, L. Movement of spermatocytes fron the basal to the adluminal compartment of the rat testis. Am J Anat 1977; 148: 313-28..
Ryan M, Drudy L, Cottell E, Harrison RF. Preparation of antibody free spermatozoa by in vitro immunodepletion using immunobeads. Andrologia 1994:26:247-250
Sacco AG, Moghissi KS. Anti-zona pellucida activity in human sera. Fertil Steril 1979; 31:503-6.
Santhanam R, Naz RK. Novel human testis-specific cDNA: molecular cloning, expression and immunobiological effects of the recombinant protein. Mol Reprod Dev 2001; 60:1-12.
Scarselli G, Livi C, Emmí L, Chelo E, Noci L. Pellegrini S. Analysis of the action of corticosteroid treatment in immunologic infertility: a preliminary report and an alternative hyphotesis. Am J Reprod Immunol Microbiol, 1987; 15:57-60.
Sedmark DD, Hart WR, Tubos RR. Autoimmune ooforitis: a histopathologic study of envolved ovaries with immunologic characterization of the mononuclear cell infiltrate, Int J Gynecol Pathol 1987; 6:73-81.
Scully RE. Case records of the Massachussets General Hospital. N Engl J Med 1986;315:1336-43.
Seki M, Mettler M. Influenceof spermatozoal antibodies on the reproduction of mice. Am J Reprod Immunol 1982; 2:225-32.
Sharma KK, Barrat CLR, Pearson MJ, Cooke ID. Oral steroid therapy for subfertile males with antisperm antibodies in the semen: prediction of responders. Hum Reprod 1995; 10:103-9.
Shetty J, Naaby-Hnasen S, Shibahara H, Bronson R Flickinger CJ, Herr JC. Human sperm proteome: immunodominant sperm surface antigens identified with sera from infertile men and women. Biol Reprod 1999; 61:61-9.
Shulman S. Treatment of immune male infertility with methylprednisolone. Lancet 1976; 2:1243.
Sinisi AA, Di Finizio B, Lettieri F, Pasquali D, Scurini C, De Bellis A, Bellastella A. Late gonadal function and autoimmunization in familial testicular torsion. Arch Alndrol 1993; 30:147-52.
Snow K, Ball GD. Characterization of human sperm antigens and antisperm antibodies in infertile patients. Fertil Steril 1992; 58:1011-9.
Soderbergh A, Winqvist O, Norheim I, Rorsman F, Husebye ES, Dol O, Karlsson FA, Kampe O. Adrenal autoantibodies and organ-specific autoimmunity in patients with Addison's disease. Clin Endocrinol 1996; 45:453-60.
Templeton AA, Mortimer D. The development of a clinical test of sperm migration to the site of fertilization. Fertil Steril 1982; 37:410-5.
Tung KSK, Cooke WD Jr, McCartu TA, Robitaille P. Human sperm antigens and antisperm antibodies. II. Age-related incidence of antisperm antibodies. Clin Exp Immunol 1976; 25:73-9.
Tsukui S, Noda Y, Yano J, Fukuda A, Mori T. Inhibition of sperm penetration through human zona pellucida by antisperm antibodies. Fertil Steril 1986; 46:92-6.
Tsukui S, Noda Y, Fukuda A, Matsumoto H, Tatsumi K, Mori T. Blocking effect of sperm immobilizing antibodies on sperm penetration of human zonae pellucidae. J in Vitro Fert Embryo Transf 1988; 5:123-8.
Tung KSK, Unanue ER, Dixon FJ. Pathogenesis of experimental allergic orchitis. II. The role of antibody. J Immunol 1971; 106:1463-72.
Ulstein M. Fertility of husbands at homologous insemination. Acta Obstet Gynecol Scand 1973; 52:5-8.
Verheyen G, Tournaye H, Laurier K, Devroey P, Van Steirteghem A. Auto-controled study on in-vitro fertilization performance with "antibody-free" spermatozoa selected by inmunobead adsoption from semen of patients with anti-sperm antibodies. Hum Reprod 1994; 9:1119-26.
WHO. WHO laboratory manual for the examination of human semen and sperm-cervical mucus interaction. 4ª ed. Cambridge University Press, Cambridge. 1999.
Witkin SS. Mechanisms of active supression of the immune response to spermatozoa. Am J Immunol Microbial 1988; 17:61-4.
Yeh W-R, Acosta AA, Seltman HJ, Doncel G. Impact of immunoglobulin isotype and sperm surface location of antisperm antibodies on fertilization in vitro in the human. Fertil Steril 1982; 38:730-4.
Zanchetta R, Busolo F, Mastrogiacomo I. The enzyme-linked immunosorbent assay for detection of the antispermatozoal antibodies. Fertil Steril 1982; 38:730-4.
Zeyneloglu HB, Yarali H. Antisperm antibodies: fact or fiction? Immunol Allergy Clin North Am 2002; 22:471-501.
Zhong CQ, Ito PC, Fau MC, Chan SYW, Go WWK, Wang C. Immunological studies in patients with oligospermia. Fertil Steril 1989; 52:667-9.
