LAS APARIENCIAS A VECES ENGAÑAN, LA VERDADERA BELLEZA ESTÁ EN EL INTERIOR.
Olmedo Illueca, C.; Lozano Zamora, M.; Iñiguez Tornero, J. y Cuevas Sáiz, I. Consorcio Hospital General Universitario de Valencia (Unidad de Reproducción Humana).
carla.olmedo@gmail.com
Resumen: La evaluación de embriones mediante criterios morfológicos ha sido hasta ahora la única herramienta fiable de selección. Sin embargo, los avances en técnicas de biología molecular como la proteómica o la metabolómica nos permiten descubrir nuevos métodos que, acompañados de los criterios morfológicos, nos permitan escoger los embriones con mayor potencial de implantación. Con ello, no sólo conseguiremos aumentar las tasas de embarazo, sino que además evitaremos la necesidad de transferir más de un embrión y el posible riesgo de embarazo múltiple.
Palabras clave: marcadores no-invasivos, Viabilidad embrionaria, proteómica, metabolómica.
YOU CAN´T JUDGE A BOOK BY ITS COVER, TRUE BEAUTY IS WITHIN
Summary: Embryo evaluation using morphological criteria has been the unique trustworthy method of embryo selection. However, new advances in molecular biology techniques like metabolomics and proteomics can permit to choose the embryo with the best implantation potential. Therefore, we will be able to increase pregnancy rates but furthermore avoid the need to trasnfer more than one embryo and his multiple pregnancy risk.
Keywords: Non-invasive biomarkers, Embryo viability, proteomics, metabolomics
INTRODUCCIÓN
La reproducción asistida se ha convertido en la única esperanza para muchas parejas con problemas de infertilidad. Sin embargo, esta técnica resulta ineficiente, ya que tan solo entre un 10-30% de todos los embriones que se transfieren al útero materno implantarán y acabarán en embarazo evolutivo (Lieberman et al., 2001).
Muchos son los factores involucrados en la llegada a término del embarazo, pero sin duda el protagonista de esta historia es el embrión. El embrión humano debido a su gran plasticidad es capaz de evolucionar incluso en condiciones subóptimas. Sin embargo esto podría tener ciertos costes, siendo una de las principales causas de los fallos de implantación en las técnicas de FIV.
Hasta hace relativamente poco tiempo la selección del embrión/es a transferir estaba basada únicamente en criterios morfológicos. Estos parámetros, a pesar de tener la ventaja de ser no invasivos, tienen el inconveniente de ser a veces inexactos y subjetivos. En los últimos años, técnicas como la metabolómica y la proteómica son capaces de aportar información clínica importante acerca de los cambios que acontecen en el ambiente del embrión. Con la creación de las “ómicas´´ podremos identificar nuevos marcadores de viabilidad embrionaria no invasivos. Sin embargo, a día de hoy, se hace necesario acompañar estas nuevas herramientas con criterios morfológicos para seleccionar un embrión. Pero en un futuro no muy lejano quizá podamos elegir un solo embrión sin tener que fijarnos únicamente en su aspecto. Porque las apariencias a veces engañan….
METABOLÓMICA
La morfología de un embrión tiene un valor predictivo limitado para determinar su viabilidad y posibilidad de dar embarazo, por lo que se necesitan nuevas herramientas que nos conduzcan a la transferencia embrionaria única (SET).
Una aproximación hacia el problema de la evaluación de la viabilidad embrionaria sería la valoración del perfil metabólico del medio de cultivo consumido por el embrión. Es lógico pensar que el metabolismo de un embrión sano podría alterar el medio que le rodea de forma distinta que uno menos sano y por lo tanto con menor potencial implantatorio. El perfil metabólico debería ofrecer la ventaja de evaluar de forma simultánea un gran número de analitos en el medio, y producir un perfil que podría estar asociado con la viabilidad embrionaria. Se ha obtenido recientemente el perfil metabólico del cultivo de embriones humanos mediante espectroscopía Raman o NIR (Near-infrared spectroscopy). Existe un método para detectar el perfil metabólico en medios de cultivo de embriones de FIV/ICSI que muestra la habilidad para valorar el potencial reproductivo de un embrión (Seli et al., 2007). Esa información se obtiene midiendo biológicamente las concentraciones de grupos funcionales clave como R-OH, -SH, C-C, -CH, -OH y – NH mediante el uso de espectroscopia infrarroja cercana (NIR). Estos son sensibles a especies reactivas del oxigeno, y la variación entre embriones viables y no viables puede ser resultado de una modificación oxidativa. El espectro obtenido por NIR mostró un aumento en los grupos –OH y descenso de los grupos –CH y –NH.
El modelo de estimación de la viabilidad enfatiza en las diferencias existentes entre –CH y –NH. Estos resultados son consistentes con el concepto de que un embrión, cuando madura, consume el medio de cultivo modificando su pool. Es notable que –SH,-CH,-NH y –OH son biomarcadores del estrés oxidativo y se ha demostrado que afectan a la viabilidad embrionaria. Mediante un algoritmo genético se discriminan los embriones que dan embarazo positivo y negativo según su perfil metabólico.
Esto da como resultado un score de viabilidad embrionaria para medir el potencial del embrión para desarrollarse de forma correcta, implantar y dar lugar a una gestación evolutiva.
De forma retrospectiva se ha intentado comprobar si el perfil metabólico de los constituyentes se correlaciona con el embarazo cuando los embriones transferidos se seleccionaron por criterios morfológicos porque no todos los embriones con buena calidad morfológica implantan. Para ello los pacientes se dividieron en grupos. Aquellos con una tasa de implantación del 100% representaron el grupo cuyos embriones tenían potencial reproductivo probado, y aquellos con una tasa del 0% se seleccionaron para representar a los embriones sin potencial de implantación. Las muestras que se analizan son aquellas obtenidas de día 3 y día 5 de desarrollo post-inseminación. Se comparan ambas muestras mediante sus índices de viabilidad usando análisis estadístico de la t-Student y se obtuvieron mejores resultados para las muestras en día 3. Los índices de viabilidad de las muestras con implantación fueron mayores (0.94) que los que no implantaron (0.56). Se crearon curvas ROC (Receiver operator characteristic) para identificar el valor umbral con mejor mezcla de sensibilidad y especificidad. Este valor umbral fue después aplicado a los datos para calcular valores predictivos positivos y negativos. La curva ROC indica que mediante el índice de viabilidad de 0.76 podemos ser capaces de discriminar entre embriones con alto potencial con una sensibilidad y especificidad del 82.4% y 69% respectivamente. Y una exactitud del 75.8%.
Las muestras obtenidas de blastocistos en día 5 fueron evaluadas de igual forma. Las muestras asociadas a la implantación tuvieron unos índices de variabilidad más altos (-0.40) que aquellas con fallo de implantación (- 0.81). Se completó una curva ROC que identificó el mejor valor umbral de – 0.43. Usando este valor, la sensibilidad y especificidad fue del 100%.
Los resultados sugieren que los embriones que implantan y acaban en embarazo modifican su ambiente de forma distinta que los que no implantan. Si se compara la exactitud de los criterios morfológicos y los metabolómicos, estos últimos tienen un 15% más de acierto que los morfológicos después de la transferencia única (SET) en día 3 post-inseminación y un 40% en día 2, cuando la transferencia se lleva a cabo independientemente de los criterios morfológicos
Por tanto los cambios en el medio de cultivo por oxidación pueden ser un indicador del potencial y son independientes de los criterios morfológicos.
En la práctica estos datos sugieren que la metabolómica podría usarse junto con la morfología para seleccionar un embrión.
La GM-CSF (Granulocite Macrophage colony stimulating factor) es una citokina perteneciente a la familia de factores de crecimiento hematopoyéticos secretada por el tracto femenino de humanos y mamíferos al comienzo del embarazo. Su función es regular el número y viabilidad de los blastocistos y su presencia en el ambiente constituye un elemento clave en la implantación, crecimiento y desarrollo fetal.
Esta citokina varía su concentración en función de la edad de la paciente. En aquellas menores de 30 años la concentración es significativamente mayor que en aquellas con 37 años o más. También se ha visto que existe relación entre la G-CSF y los niveles de Estradiol. A medida que aumenta la concentración de citokina en suero disminuye el nivel de Estradiol. Existe correlación entre los niveles de G-CSF y estradiol en suero el día de la punción. En cambio no había diferencias entre folículos de ovocitos fecundados y no fecundados. El hecho de que los niveles fueran superiores en líquido folicular nos indica la producción intrafolicular de esta citokina y el papel auto/paracrino que ejerce en el ambiente folicular.
Mediante Western-Blot y técnicas inmunohistoquímicas se han localizado sus receptores en el ovario, principalmente en las células de la granulosa y células luteales.
Se realizó un estudio comparativo de los embriones procedentes de líquido folicular con concentraciones por encima y por debajo de 20 pg/ml, que constituye el ratio del embrión peor y el mejor. Para decidir el valor límite de G-CSF que determina qué concentración de citokina marca el potencial de implantación de cada ovocito y su correspondiente embrión se realizó una curva ROC. El valor límite por debajo del cual no ocurre la implantación es 20 pg/ml. Sin embargo, cuando la concentración supera 24 pg/ml el valor predictivo positivo alcanza un 40%.
Los resultados muestran claramente que pacientes embarazadas revelaban un aumento constante de citokina desde la transferencia a la implantación. Sin embargo aquellas que no resultaron embarazadas mostraban un ligero aumento seguido de un descenso los dias 6-8 de estimulación, marcando con ello el comienzo de un nuevo ciclo.
Otros autores pretenden identificar las diferencias en el perfil proteico entre blastocistos humanos usando Arrays. Se analizan un total de 120 proteínas del medio de cultivo (CCM, Vitrolife) de blastocistos. Si se compara el perfil proteico de aquellos blastocistos que implantaron respecto a los que no implantaron se encuentran diferencias únicamente en dos proteínas, que son CXCL13 (B-cell attracting homing chemokine) y GM-CSF (Granulocyte macrophage-colony stimulating factor). Estas dos proteínas disminuían su nivel en el medio de cultivo de embriones viables. La GM-CSF es un factor que previene la apoptosis (Sjoblom et al., 2002) y promueve el desarrollo in vitro (Sjoblom et al., 1999). Y no sólo es esencial para el desarrollo, sino también para la implantación (Robertson et al., 2007). Podría por tanto ser considerado un biomarcador de viabilidad embrionaria.
La CXCL13 no tiene funciones relacionadas con la implantación o el desarrollo, pero sí para el sistema inmune aunque no se conoce demasiado acerca de ella.
Por tanto, la G-CSF tiene un papel primordial en el desarrollo folicular, la implantación, la ovulación y el mantenimiento del embarazo. Constituye un biomarcador no invasivo que promueve la transferencia única porque evalúa al ovocito de forma individual y nos ayuda a identificar el mejor protocolo de estimulación. Pero el uso de estas proteínas como criterio de selección embrionaria necesita aún de más estudios.
Las células de la granulosa son las únicas encargadas de producir la hormona antimülleriana (AMH) desde el nacimiento. Esta hormona alcanza su máximo nivel en la pubertad y continúa presente en edad adulta a nivel basal.
Hasta ahora sólo se conocía su función como factor pronóstico de la reserva ovárica. Se ha visto que los niveles de hormona son más bajos en mujeres con baja respuesta que en aquellas con respuesta normal (Elgindy et al, 2008).Sin embargo esta hormona además de predecir la edad ovárica constituye un marcador de calidad embrionaria.
Parece que la cantidad de oocitos y la calidad de los embriones son inversamente proporcionales a la edad de la mujer, cuya respuesta ovárica, como hemos citado anteriormente, se predice con la concentración de dicha hormona en suero. Cuando la concentración de hormona es elevada en líquido folicular el día de la administración de hCG, la calidad embrionaria, la tasa de implantación y, por tanto, la de embarazo aumentan.
Otros autores demuestran que en aquellas pacientes cuyos oocitos fecundaron, la concentración de AMH en líquido folicular fue más elevada que en aquellas a las que no les fecundaron.
Según S.L.Broer et al., 2008 la AMH tiene la misma capacidad de predecir baja respuesta ovárica a la estimulación y no embarazo en FIV que el recuento de folículos antrales.
Para determinar la concentración de hormona se puede utilizar un ELISA, concluyendo que un desarrollo embrionario mejor de lo normal y unas tasas elevadas de embriones de buena calidad se correlacionan con un incremento de AMH en el líquido folicular. Por lo tanto, la determinación de AMH en líquido folicular resultaría útil en la predicción de calidad embrionaria.
La HLA-G es una molécula del complejo mayor de histocompatibilidad (MHC) tipo I no clásica. Adopta siete isoformas, resultado del splicing alternativo de un mismo RNA inmaduro, cuatro se encuentran ligadas a la membrana (HLA-G1,-G2, -G3, -G4) y las otras tres formas son solubles (sHLA-G5, -G6, – G7), además presenta una limitada distribución en los tejidos, expresándose de forma selectiva por las células del citotrofoblasto velloso en la interfase materno-fetal.
Desarrolla un papel importante en la inmunoprotección del embrión, por ello podría jugar un papel esencial en diálogo madre-embrión protegiendo al feto de ser rechazado por la madre.
Desde la primera vez que fue identificado en medios de cultivo embrionario (HTF Irvine Scientific, CA, USA o KSOM Gibco BRL, Grand Island, NY, USA) (Jurisicova et al., 1999) algunos artículos relacionan su concentración con una mayor tasa de división embrionaria o con una condición imprescindible para lograr embarazo, pero todos la asocian con un mayor éxito en la tasa de implantación de dichos embriones (Noci et al., 2005; Sher et al., 2005).
Sin embargo no todos los trabajos están de acuerdo con estos hallazgos. Algunos autores solo detectan s-HLA-G en trofoblasto y no en cultivos de embriones de 8 células ni tampoco en blastocistos. Todos estos desacuerdos podrían venir dados por la especificidad y la sensibilidad de los medios de detección utilizados y por el tipo de medio de cultivo utilizado. Además, parece que también se observa variabilidad entre diferentes lotes del mismo medio.
En cualquier caso, la detección de s- HLA-G podría ser un posible biomarcador de la capacidad implantatoria del embrión, ya que sería un método no invasivo que permitiría realizar la selección embrionaria sin atender únicamente a criterios morfológicos.
PROTEÓMICA
Se conoce poco sobre la producción de proteínas del embrión de humano, en particular de las proteínas que produce el embrión y son secretadas al medio que le rodea (secretoma). Las proteínas son responsables de la mayoría de funciones que dictan cómo un embrión reaccionará a su ambiente.
Los avances en espectroscopia de masas han sido revolucionarios para la proteómica. Mediante el uso de perfiles de expresión se identifican proteínas implicadas en procesos biológicos.
Surface-enhanced láser desorption and ionization time-of-flight mass spectroscopy (SELDI-TOF MS) es uno de los más recientes desarrollos de la proteómica basado en capturar proteínas y péptidos por superficies químicamente modificadas y es altamente sensible para el análisis de muestras biológicas complejas. La sensibilidad del SELDI-TOF MS permite el análisis de pequeñas concentraciones de proteínas secretadas por el embrión a lo largo de su desarrollo.
La novedad está en que utiliza superficies químicas en chips que permiten capturar subclases de proteínas. Una vez unidas al chip las proteínas son ionizadas usando un láser que desorbe en un gas cargado positivamente. El tubo del TOF crea un vacío que permite la separación e interpretación de iones de acuerdo a su masa/carga.
Usando SELDI-TOF MS se ha desarrollado un sistema capaz de analizar el proteoma de un blastocisto humano, y la meta es identificar las proteínas y los eventos críticos que ocurren justo antes de la implantación.
Se utilizan blastocistos de morfología similar pero con diferencias en el tipo y la intensidad de algunas proteínas y péptidos. Cuando los blastocistos se compararon por análisis estadístico con embriones degenerados se encontraron muchas diferencias en proteínas cargadas negativamente.
Los datos han identificado un potencial candidato implicado en apoptosis e inhibición del crecimiento, la Heparin-binding epidermal growth factor (EGF)- like growth factor precursor (HB-EGF) es un potencial candidato implicado con la interacción entre el trofoectodermo y el epitelio luminal del útero materno en la implantación del blastocisto. Es un estimulador del crecimiento, relacionado con el hatching.
Otro de los candidatos es la cystatin-like precursor. Como se sabe que las cistatinas inhiben las cisteína proteinasas, el feedback positivo de esta proteína contribuiría al fallo de implantación de embriones degenerados.
Los estudios han demostrado que los embriones, cada 24 horas secretan distintas proteínas. Esos perfiles proteicos caracterizan el estadio de desarrollo de ese embrión por su secretoma solo, independientemente de la morfología. Los análisis revelan la expresión de varios biomarcadores diferentes solo en puntos específicos cada 24 horas.
El análisis del secretoma de blastocistos humanos que se desarrollan reveló diferencias significativas en la expresión de una proteína de 8.5-kDa. Los embriones que se desarrollaron correctamente mostraron fuerte expresión de esa proteína mientras que los degenerados mostraron ausencia. Esta proteína también se detecta significativamente en estadio de blastocisto y es el biomarcador más abundante en el secretoma en día 5. Esta proteína ha sido identificada como la ubiquitina y está implicada en implantación.
En cuanto a biomarcadores de viabilidad, los blastocistos humanos de morfologías similares muestran perfiles proteicos distintos. Los embriones degenerados y los que se desarrollan también varían en cuanto a las proteínas implicadas en apoptosis e inhibición de crecimiento. En blastocistos de una misma paciente y con morfologías similares varía enormemente su huella dactilar metabólica (Gardner et al., 2001).
Esto indica que existen diferencias significativas en la expresión de proteínas independientemente de la morfología.
El recambio aminoacídico constituye un método no-invasivo de selección embrionaria basado en el depleción/aparición de aminoácidos en el medio de cultivo (Leese, 1994; Houghton, 2002; Brison, 2004). Parece estar relacionado con la habilidad de un embrión para implantar y dar embarazo. Esto es independiente de otros indicadores de embarazo como la edad materna, reserva ovárica y número de células embrionarias y grado.
El análisis mediante HPLC (High performance liquid cromatography) permite ver los cambios que se producen en la concentración de aminoácidos en el medio de cultivo individual de embriones humanos cada 24 horas. Los datos obtenidos retrospectivamente llevan a la conclusión de que existen diferencias claras en el recambio aminoacídico entre embriones evolutivos y no evolutivos.
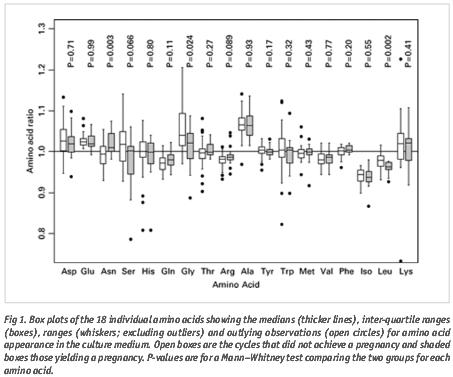
En la figura 1 se puede ver la concentración relativa de 18 aminoácidos en el medio de cultivo, junto con la concentración en aquellos pacientes con y sin consecución de embarazo.
Los análisis muestran que la Asparragina (Asn), Glicina (Gly) y leucina (Leu) están relacionadas con el embarazo clínico y nacimiento. Leu, Gly y Serina (Ser) son las menos abundantes en el medio de embriones de ciclos exitosos mientras que Asn y Arginina( Arg) son los más abundantes.
El número de células y el Embryo Score parece que se correlacionan únicamente con la Glu. No sabemos exactamente que aspectos de la viabilidad embrionaria se reflejan en el recambio aminoacídico, pero lo que sí se sabe es que los aminoácidos cuyo recambio predice la formación del blastocisto no son los mismos que predicen el embarazo (Houghton et al., 2002). Los blastocistos formados in vitro se predicen mediante la Ala, Arg, Gln, Met y Asn entre los días 2 y 3 postinseminación (Houghton et al., 2002) mientras que para el embarazo se miden la Asn, Gly y Leu entre los días 1 y 2 postinseminación. Esto refleja el hecho de que no todos los blastocistos formados in vitro son viables. A lo largo del desarrollo los embriones pasan de necesitar Leu en día 2-3, Ser, Arg y Leu en 8 células y Ser, Leu, Arg, Met y Valina durante el paso de mórula a blastocisto. En cambio los embriones que se detienen usan 7 y 6 aminoácidos en día 2-3 en 8 células.
Esto nos da una idea de las necesidades nutricionales del embrión y su posible relación con la fisiología y desarrollo del mismo. Y nos indica que los embriones que se detienen son metabólicamente más activos que los embriones que se desarrollan. Esto implica que la calidad oocitaria debe jugar un rol mayor en la determinación de la viabilidad embrionaria puesto que la activación del genoma no se detecta hasta estadio de 4-8 células.
CONCLUSIÓN
Actualmente, continuamos trabajando de forma rutinaria en la valoración morfológica de gametos/embriones, pero gracias a los estudios que se están realizando se confirma que los embriones no son entidades estáticas, sino que intercambian metabolitos con el medio que les rodea y a su vez lo modifican, pudiéndose utilizar las medidas de esas modificaciones como herramientas de selección adicionales a la morfología.
Referencias
Brison DR, Houghton FD, Roberts SA, Hawkhead J, Humpherson PG, Lieberman BA, Leese HJ. Identification of viable embryos in IVF by non-invasive measurement of amino acid turnover. Human Reproduction 19: 2319-2324.
Broer S, Mol BW, Hendriks DJ, Broekmans FJ, Anti-Müllerian hormone in IVF outcome prediction: a comparison to the antral follicle count. XXIV Annual Meeting of The European Society of Human Reproduction and Embriology.; 2008 July 6-9; Barcelona, Spain.p.73
Dominguez F, Gadea B, Esteban FJ, Horcajadas JA, Pellicer A, Simón C. Comparative proteinprofile analysis of implanted versus nonimplanted human blastocyst. Human Reproduction 23: 1993-2000.
Elgindy EA, El-Haieg DO, El-Sebaey A. Anti- MÜllerian hormone: correlation of early follicular, ovulatory and midluteal levels with ovarian response and cycle outcome in intracytoplasmic sperm injection patients. Fertil Steril 89: 1670-1676.
Houghton FD, Hawkheaad JA, Humpherson PG, Hogg JE, Balen AH, Rutherford AJ, Leese HJ. Non-invasive amino acid turnover predicts human embryo developmental capacity. Human Reproduction 17: 999- 1005.
Jurisicova A, Casper RF, MacLusky NJ, Mills GB, Librach CL. HLA-G expression during preimplantation human embryo development. Proc Natl Acad Sci USA 93,161-165.
Jurisicova A, Antenos M, Kapasi K, Meriano J, Casper RF. Variability in the expresión of trophectodermal markers human gonadotrophin, human leukocyte antogen- G and pregnancy specific glycoprotein by the human blastocyst. Human Reproduction 14:1852-1858.
Katz-Jaffe MG, Gardner DK, Schoolcraft WB. Proteomic analysis of indiviadual human embryos to identify novel biomarkers of development and viability. Fertil Steril 85: 101-107.
Katz-Jaffe MG. Schoolcraft WB, Gardner DK. Analysis of protein expression ( secretome) by human and mouse preimplantation embryos.Fertil Steril 86:678-685. Katz-Jaffe MG. Can proteomics help to shape the future of human assisted conception? RBM Online August 2008
Lédée N, Lombroso R, Lombardelli L, Selva J, Dubanchet S, Chaouat G, Frankenne F, Foidart JM, Maggi E, Romagnani S, Ville Y, Piccinni MP. Cytokines and chemokines in follicular fluids and potencial of the corresponding embryo: the role of granulocyte colony-stimulating factor. Human Reproduction 23:2001-2009.
Lie Fong S, Baart EB, Martini E, Schipper I, Visser JA, et al. Anti-MÜllerian hormone : a marker for oocyte quantity, oocyte quality and embryo quality ? RBM Online 16:664- 670.
Salmassi A, Schmutzler AG, Schaefer S, Koch K, Hedderich J, Jonat W, Mettler L. Is granulocyte colony-stimulating factor level predictive for human IVF outcome? Human Reproduction 20:2434-2440.
Scott R, Seli E, Miller K, Sakkas D, Scott K, Burns D. Noninvasive metabolomic profiling of human embryo culture media using Raman spectroscopy predicts embryonic reproductive potencial: a prospective blinded study. Fertil Steril 90:77-83.
Seli E, Sakkas D, Scott R, Kwok SC, Rosendahl SM, Burns DH. Noninvasive metabolomic profiling of embryo culture media using Raman and near-infrared spectroscopy correlates with reproductive potencial of embryos in women undergoing in vitro fertilization. Fertil Steril 88:1350-1357.
Sher G, Keskintepe L, Nouriani M, Roussev R, Batzofin J. Expression of HLA-G in supernatans of individually cultured 46-h embryos: a potentially valuable indicator of embryo competency and IVF outcome. Reprod Biomed Online 9, 74-78.
Vercammen MJ, Verloes A, Van de Velde H, Haentjens P.Accuracy of soluble human leukocyte antigen-G for predicting pregnancy among women undergoing infertility treatment: meta-analysis. Human Reproduction. 14:209-218.
Vergouw CG, Botros LL, Roos P, Lens JW, Schats R, Hompes PGA, Burns DH, Lambalk CB. Metabolomic profiling by near –infrared spectroscopy as a tool to assess embryo
viability: a novel, non-invasive method for embryo selection. Human Reproduction. 23: 1499-1504.