LAS VARIANTES CROMOSÓMICAS AFECTAN LA CALIDAD EMBRIONARIA
Mireia Poveda1, Teresa Rubio2, Isabel Ochando3, Laura Gil1, Manuel Lloret1, José Jesús López-Gálvez1, Antonio Urbano3 ,Juan Manuel Moreno1, Joaquín Rueda3,4. 1Unidad de Reproducción, Hospital Clínica Vistahermosa de Alicante 2Unidad de Reproducción, Clínica Virgen de la Vega, Murcia 3Unidad de Genética, Hospital Clínica Vistahermosa de Alicante 4Área de Biología Celular, Universidad Miguel Hernández, Alicante.
email:lab@urvistahermosa.com ·
Fecha recepción: 30 abril 2010 · Fecha aceptación: 10 mayo 2010
Resumen: El objetivo de este estudio es evaluar si la presencia de alguna variante cromosómica en el cariotipo puede afectar a los resultados de los ciclos de ICSI.
Se ha realizado un estudio prospectivo de 81 ciclos de ICSI realizados en nuestro centro en los que algún miembro de la pareja presenta variantes cromosómicas y 169 ciclos de pacientes sometidos a la misma técnica pero con cariotipos normales. En estos ciclos, se ha obtenido la media de ovocitos recuperados, media de ovocitos maduros, tasa de fecundación, porcentaje de fallos de fecundación, porcentaje de embriones de grado A-B transferidos y tasa de gestación y aborto. Los resultados muestran que las variantes más frecuentes son las que afectan al cromosoma 9. Se observa que existen diferencias significativas en la calidad de los embriones que se transfieren, empeorando en los ciclos con variantes cromosómicas. Los resultados nos sugieren que las variantes cromosómicas pueden tener un efecto sobre la gametogénesis, por lo que los embriones generados en estos ciclos de ICSI en los que algún miembro de la pareja presenta variantes cromosómicas son de peor calidad, pero este hecho no afecta a la viabilidad embrionaria. Rev Asoc Est Biol Rep 2010; 15(1):19-23.
Palabras clave: infertilidad, variante cromosómica, gametogénesis, calidad embrionaria.
CHROMOSOMAL VARIANTS AFFECT EMBRYO QUALITY
Abstract: The aim of this study is to assess whether the presence of some variant chromosome in the karyotype may affect the outcome of ICSI cycles.
We performed a prospective study of 81 ICSI cycles performed in our center in which one partner has chromosomal variants and 169 cycles of patients undergoing the same technique but with normal karyotypes. In these cycles, we have obtained the average of oocytes retrieved, mean mature oocytes, fertilization rate, fertilization failure rate, percentage of A-B grade embryos transferred and pregnancy rate and abortion.
The results show that the most frequent variants are affecting chromosome 9. It is noted that there are significant differences in the quality of embryos transferred in cycles with worsening chromosome variants. We suggest that chromosome variants may have an effect on gametogenesis, so that the embryos produced in these cycles of ICSI in which a partner has chromosome variants are worst but this not affect embryonic viability. Rev Asoc Est Biol Rep 2010; 15(1):19-23.
Keywords: infertility, chromosomal variation, gametogenesis, embryo quality.
INTRODUCCIÓN
El genoma se divide en dos partes funcionalmente diferentes y que se pueden visualizar en los cromosomas en forma de eucromatina y heterocromatina. La eucromatina es la parte más activa del genoma y más rica en genes. La heterocromatina se divide en heterocromatina facultativa, que contiene información de algunos genes que no se expresan o que se expresan en algún momento (como el corpúsculo de Barr) y la heterocromatina constitutiva, formada por secuencias altamente repetidas y comprimidas como secuencia satélite, generalmente pobres en genes. Esta heterocromatina es polimórfica, probablemente debido a la intensidad del ADN satélite.
Estos polimorfismos pueden afectar no solamente al tamaño, sino también a la localización de la heterocromatina; aparentemente no tienen traducción fenotípica (Mattei et al., 2003) y se conocen como variantes cromosómicas. Las variantes se deben al aumento de heterocromatina constitutiva y suelen ser más frecuentes en los cromosomas 1, 9, 16 y en los acrocéntricos. Estas variantes cromosómicas se identifican a nivel microscópico y pueden tener diferente tamaño, morfología y propiedades tintoriales, pudiéndose trasmitir a la descendencia o aparecer de novo, estimándose su incidencia de un 3,12% en la población general (Bhasin, 2005). Se sabe que muchos de los genes necesarios para la viabilidad embrionaria y la fertilidad residen en la heterocromatina; es por ello que la presencia de estas variantes se ha relacionado con diferentes procesos patológicos entre los que está la infertilidad (Madon et al., 2005; Minocherhomji et al., 2009).
Algunos estudios señalan que en casos de abortos espontáneos y en la infertilidad idiopática, la presencia de variantes cromósomicas en uno o ambos miembros de la pareja es más frecuente (Dubey et al., 2005). Además, estudios recientes han demostrado que existe una mayor prevalencia de las anomalías cromosómicas numéricas y variantes polimórficas en pacientes sometidos a procesos de reproducción asistida, tales como la fecundación in vitro e inyección intracitoplasmática de espermatozoides (Minocherhomji et al., 2009), teniendo en estos ciclos menores tasas de embarazo e implantación (Scholtes et al., 1998). El objetivo de nuestro estudio es evaluar si la existencia en el cariotipo de alguna variante cromosómica puede afectar a los resultados de los ciclos de ICSI.
MATERIAL Y MÉTODOS
Se ha realizado un estudio prospectivo de 250 ciclos de ICSI, de los cuales en 81 de ellos al menos un miembro de la pareja presentaba una variante cromosómica en el cariotipo. Los resultados de estos 81 ciclos se han comparado con 169 ciclos realizados desde Junio a Septiembre de 2008 de pacientes no seleccionados, sometidos a la misma técnica pero con cariotipos normales.
De los ciclos estudiados, se excluyeron los ciclos en los que se ha utilizado semen procedente de biopsia testicular y ciclos en los que el número de ovocitos recuperados es menor a 3, eliminando así tanto el factor masculino severo como las bajas respondedoras, en los que los fallos de fecundación son más frecuentes.
En todos estos ciclos se han obtenido los siguientes datos: media de ovocitos recuperados, media de ovocitos maduros, tasa de fecundación, porcentaje de fallos de fecundación, porcentaje de embriones de buena calidad (grado A-B) transferidos y tasas de gestación clínica y aborto.
Se ha comparado también la presencia de variantes por sexos, con el fin de observar si la presencia de las variantes cromosómicas tiene el mismo efecto sobre los ciclos de ICSI, si se presenta en el cariotipo del hombre o en el de la mujer.
Procedimiento FIV-ICSI
A todas las mujeres se les aplicó un protocolo de hiperestimulación ovárica controlada (HOC), siguiendo los protocolos de estimulación largo con agonistas, con antagonistas o corto, dependiendo de la indicación ginecológica. En todos ellos se utilizó para la estimulación ovárica medicación recombinante. La ovulación fue inducida con 10.000 UI de hCG, que se administró cuando los folículos alcanzaron un diámetro igual o mayor de 18 mm. La punción folicular se efectuó por vía transvaginal ecoguiada a las 36 horas de la inyección de hCG. La fase lútea fue apoyada con progesterona vía vaginal u oral, comenzando el mismo día de la punción.
Los ovocitos recuperados fueron fecundados siguiendo el protocolo estándar, utilizando los medios de cultivo comerciales Vitrolife®. La fecundación de los ovocitos se confirmó con la presencia de dos pronúcleos y dos cuerpos polares entre las 16-19 horas tras la inseminación. A los embriones procedentes de estos ciclos, se les realizó un seguimiento de su evolución y aspecto morfológico desde el día de la punción hasta el día de su transferencia (67-71 horas post-ICSI). Dependiendo de su morfología y desarrollo, estos embriones fueron catalogados en cuatro categorías siguiendo los criterios de valoración morfológica de ASEBIR (Ardoy et al., 2007).
La transferencia se realizó mediante control ecográfico y dos semanas después se solicitó una ß-hCG para confirmar el embarazo. Se consideró gestación clínica cuando se visualizó latido cardiaco fetal.
Estudio citogenético
El estudio del cariotipo se llevó a cabo en linfocitos de sangre periférica, cultivados a 37º C durante 72 horas en dos cultivos paralelos con Chromosome (Genycell Biotech) y RPMI suplementado con suero fetal y fitohemaglutinina.
Se analizaron un mínimo de 20 metafases y se cariotiparon al menos 3 metafases por caso, teñidas con bandas G (Seabright, 1971), según las directrices de la ECA (European Cytogeneticists Association) (Hastings et al., 2007).
Análisis estadístico
Se utilizó el test de la Chi-cuadrado de Pearson para calcular la significación estadística de los datos y analizar la correlación, si la hay, entre las variables de los grupos con variante y sin variante cromosómica. Para ello, se utilizó el programa SPSS. Se ha considerado que existen diferencias significativamente estadísticas cuando p<0,05.
RESULTADOS
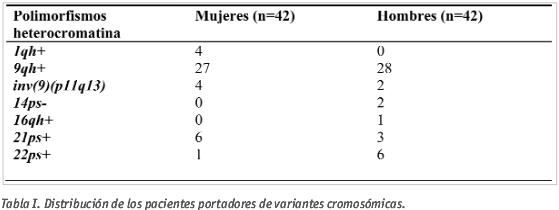
De los 250 ciclos de ICSI estudiados a los que se les realizó un estudio citogenético, se encontró alguna variante polimórfica del cariotipo en 81 ciclos; en tres de estos ciclos ambos miembros de la pareja presentaban algún tipo de variante. En éstos se observó que las variantes cromosómicas más frecuentes fueron las que afectan al cromosoma 9, presente en un 73% de los casos (el 37% de los ciclos en mujeres y el 36% en hombres), siendo la variante 9qh+ la que se presentó con más frecuencia, en un 65% de los casos. La variante 21ps+ se presenta en un 14,3% de los ciclos en mujeres y en un 7,14% de los ciclos en hombres. El resto de variantes está en un porcentaje inferior al 10%. La distribución de los pacientes portadores de algún tipo de variante cromosómica se muestra en la Tabla I, y en la Figura 1 se identifica algunos cromosomas con variantes cromatínicas.
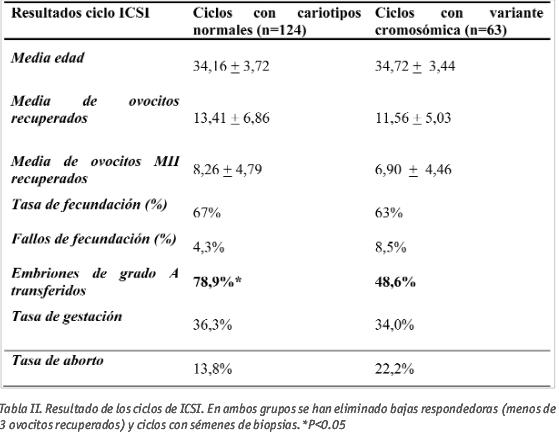
Los resultados de los ciclos de ICSI en ambos grupos, en los que hemos excluido las bajas respondedoras y los ciclos con biopsias testiculares, se observan en la Tabla II. Estos resultados muestran que no existen diferencias entre los dos grupos en cuanto a promedio en la edad de la mujer. La media de ovocitos maduros recuperados tras la punción no es significativamente mayor en los ciclos con variantes cromosómicas que en los ciclos sin variantes. A pesar de que la tasa de fecundación es muy similar en ambos grupos, el porcentaje de fallos de fecundación es mayor, pero no significativo, en los ciclos en los que alguno de los miembros de la pareja tiene alguna variante de la normalidad que en los ciclos con cariotipos normales. Se observan diferencias estadísticamente significativas en la cantidad de embriones de buena calidad transferidos en día 3 de cultivo, de forma que los embriones obtenidos en los ciclos donde algún miembro de la pareja tiene un cariotipo con variante cromosómica son significativamente de peor calidad que los embriones obtenidos en los ciclos donde los progenitores tienen cariotipos normales.
Las tasas de embarazo y aborto fueron muy similares en ambos grupos, sin presentar diferencias estadísticamente significativas.
En cuanto a los resultados obtenidos si comparamos el efecto de las variantes por sexos, no observamos diferencias significativas en ningún parámetro (Tabla III).
DISCUSIÓN
El resultado más importante del presente trabajo es que las variantes cromosómicas tienen relación directa con la calidad embrionaria, si bien este hecho parece no afectar a la viabilidad del embrión.
Se sabe que los factores genéticos tienen un papel muy importante en la esterilidad (Matzuk et al., 2008). Las razones genéticas de la infertilidad son complejas y tienen distintas consecuencias. Estas causas pueden ser cromosómicas, monogénicas o multifactoriales, y pueden afectar a cualquier etapa del desarrollo embrionario (Shah et al., 2003).
Está bien establecido el papel que las alteraciones cromosómicas juegan en la infertilidad, y su diagnóstico (Duzcan et al., 2003); sin embargo, el efecto de las variantes cromosómicas está lejos de aclararse, habiéndose convertido en un campo de controversia en citogenética clínica reproductiva (Madon et al., 2005). Existen autores que concluyen que las variantes cromosómicas no tienen efectos fenotípicos y, por otro lado, también hay un número considerable de publicaciones que aportan datos en sentido contrario (Madon et al., 2005; Gardner et al., 2004; Wyandt et al., 2004).
En los últimos años, varios estudios han analizado la relación de las alteraciones cromosómicas y la infertilidad (Nakamura et al., 2001). En alguno de estos estudios se ha visto que las variantes cromosómicas se encuentran en una frecuencia más elevada en pacientes infértiles que en la población general (Yakin et al., 2005; Madon et al., 2005; Rueda et al., 2007). De hecho, en nuestro medio hemos observado que sobre un 12% de los pacientes que acuden a consulta de reproducción por fallo reproductivo presentan algún tipo de variante cromosómica (Rueda et al., 2007). Se ha observado que las variantes polimórficas en los cromosomas 1, 9, 16, y en el cromosoma Y son más frecuentes en la personas infértiles que en la población general (Madon et al., 2005), habiéndose sugerido que la presencia de estas variantes en uno o ambos miembros de la pareja podría incrementar la frecuencia de abortos de repetición e infertilidad idiopática (Dubey et al., 2005). La mayor parte de datos indican que la variante cromosómica más frecuente, con gran diferencia, afecta al cromosoma 9, como así observamos también en el presente estudio.
Se sabe que la región pericéntrica del cromosoma 9 situada entre las regiones 9p11-12 y 9q11-12/13 es rica en heterocromatina en la que abundan repeticiones de DNA satélite. La secuenciación del DNA y la cartografía del cromosoma 9 ha permitido demostrar, recientemente, que este cromosoma es estructuralmente muy polimórfico y contiene la región más larga de heterocromatina que hay en los seres humanos (Humphray et al., 2004). Es necesario analizar estudios moleculares genéticos y análisis epigenéticos de las regiones heterocromáticas para ver si pueden afectar a genes vecinos implicados en infertilidad. Al comparar los ciclos de ICSI en los que al menos un miembro de la pareja presentaba alguna variante cromosómica en el cariotipo con los ciclos en los que los cariotipos de ambos progenitores son normales, observamos que no existen diferencias significativas entre los dos grupos en cuanto a la tasa de fecundación y los fallos de fecundación. Tampoco hay diferencias en la tasa de embarazo, pero, sin embargo, la calidad de los embriones que se transfieren empeora en los ciclos con variantes cromosómicas, y, a pesar de que la tasa de aborto no es significativamente mayor en los ciclos con variantes, sí hay una tendencia a que ésta sea mayor cuando los cariotipos están alterados. El empeoramiento de la calidad embrionaria cuando algún miembro de la pareja presenta variantes polimórficas en el cariotipo nos lleva a pensar en la presencia de alguna alteración en los gametos y, de hecho, un número significativo de los varones con variantes cromosómicas tienen unas cifras de aneuploidías por encima de lo normal (Rueda et al., 2007), lo que sugiere que las variantes cromosómicas podrían tener un efecto sobre la meiosis. Varios estudios han demostrado que la presencia de variantes cromosómicas está relacionada con la alteración de la espermatogénesis (Kayhan et al., 2005), observándose que estas variantes son más frecuentes en pacientes con oligozoospermia severa o azoospermia que en pacientes con oligozoospermia leve o normozoospermia (Riccaboni et al., 2008).
A pesar de la alta incidencia de variantes cromosómicas en pacientes infértiles, está lejos de dilucidarse su mecanismo de acción. Es más, el presente estudio pone de manifiesto que cuando los gametos de los portadores de variantes se emplean para ICSI, a pesar de la peor calidad embrionaria, no hay efectos sobre la viabilidad del embrión.
Recientemente, se ha demostrado que las variantes cromosómicas no tienen relación con los abortos de repetición, pero sí con la infertilidad primaria (Minocherhomji et al., 2009). Datos de nuestro grupo indican que las parejas con algún miembro con cariotipo portador de variante del cromosoma 9 tienen peores tasas de fecundación que los pacientes con cariotipos normales cuando se hace IA (Ochando et al., 2007), hecho que no ocurre cuando es la ICSI la técnica empleada.
Parece pues, que los pacientes portadores de variantes cromosómicas originan una mayor tasa de gametos con anomalías posiblemente implicadas en el reconocimiento celular pero que, una vez producida la fecundación, la afectación sobre la viabilidad del embrión sería mínima. La conclusión principal de nuestro trabajo es que los portadores de variantes cromosómicas, se beneficiarían de la técnica ICSI; por ello, es fundamental destacar la importancia del estudio citogenético como parte del diagnóstico de la pareja con fallo reproductivo, y de los donantes de gametos.
Referencias
Ardoy M, Calderón G, Cuadros J, Figueroa MJ, Herrer R, Moreno JM, et al. Cuadernos de Embriología clínica. Criterios ASEBIR de valoración morfológica de oocitos, embriones tempranos y blastocistos humanos. Editado por ASEBIR 2007
Bhasin M. Human population cytogenetics: a review. Int J Hum Genet 2005;5:83–152.
Dubey S, Chowdhury MR, Prahlad B, Kumar V, Mathur R, Hamilton S, et al. Cytogenetic causes for recurrent spontaneous abortions—an experience of 742 couples (1484 cases). Indian J Hum Genet 2005;11:94–8
Duzcan F, Munevver G, Ozan G, Bagci H. Cytogenetic studies in patients with reproductive failure. Acta Obstet Gynecol Scand 2003;82:53–6.
Gadner RJ, Stuherland SR. Variant chromosomes and abnormalities of no phenotypic consequence. Chromosome abnormalities and genetic counselling. Eds. Gadner RJ, Stuherland JR. Oxoford Univ. Press 2004; 233-248.
Hastings RJ, Cavan S, Bricarelli FD. Cytogenetic Guidelines and Quality Assurance. Eur J Hum. 2007;15:525-7
Humphray SJ, Oliver K, Hunt AR, Plumb RW, Loveland JE, Howe KL, et al. DNA sequence and analysis of human chromosome 9. Nature 2004;429:369–74
Kayhan Y, Basak B, Bulent U. Is there a possible correlation between chromosomal variants and spermatogenesis? Int J Urol 2005;12:984–9
Matzuk MM, Lamb DJ. The biology of infertility: research advances and clinical challenges. Nature Medicine 2008; 14:1197-1213.
Madon PF, Athalye AS, Parikh FR. Polymorphic variants on chromosomes probably play a significant role in infertility. Reprod Biomed Online 2005;11:726–32. Mattei MG, Luciani J. Heterochromatin, from chromosome to protein. Atlas of Genetics
and Cytogenetics in Oncology and Haematology. January 2003. URL: http://AtlasGeneticsOncology.org/Educ/He terochromEng.html
Minocherhomji S, Athalye AS, Madon PF, Kulkarni D, Shonali A. Uttamchandani, and Firuza R. Parikh. A case-control study identifying chromosomal polymorphic variations as forms of epigenetic alterations associated with the infertility phenotype. Fertil and Steril 2009;92:88-9
Nakamura Y, Kitamura M, Nishimura K, Koga M, Kondoh N, Takeyama M, et al. Chromosomal variants among 1790 infertile men. Int J Urol 2001;8:49–52.
Ochando I, Moreno JM, Gil L, Poveda M, López-Gálvez JJ, Lloret M et al. Variantes citogenéticas del cromosoma 9 en infertilidad. Congreso ASEBIR 2007
Riccaboni A, Lalatta F, Caliari I, Bonetti S, Somigliana E, and Ragni G. Genetic screening in 2,710 infertile candidate couples for assisted reproductive techniques: results of application of Italian guidelines for the appropriate use of genetic tests. Fertil and Steril 2008;89:800–8.
Rueda J, Moreno JM, Ochando I, Gil L, López JJ, Lloret M et al. Chromosome heteromorphisms in infertile couples. Chromosome Res, 2007;15:35-36
Scholtes M, Behrend C, Dietzel-Dahmen J,G., van Hoogstraten D, Marx K, Wohlers S, et al. Chromosomal aberrations in couples undergoing intracytoplasmic sperm injection: influence on implantation and ongoing pregnancy rates. Fertil and Steril 1998;70:933-7
Seabright MA. Rapid banding techniques for human chromosomes. Lancet 1971;2:971-2
Shah K, Sivapalan G, Gibbons N, Tempet H, Griffin DK. The genetic basis of infertility. Reproduction 2003;126:13–25
Wyandt HE, Tonk VS. Atlas of human chromosome heteromorphisms. Ed. Kluwer. Academic Publishers 2004.
Yakin K, Balaban B, Urman B. Is there a possible correlation between chromosomal variants and spermatogenesis? Int J Urol 2005;12:984–9