MADURACIÓN IN VITRO
Laura Escrich, Noelia Grau y Mª Jose Escribá.
Laboratorio FIV, IVI Valencia
INTRODUCCIÓN
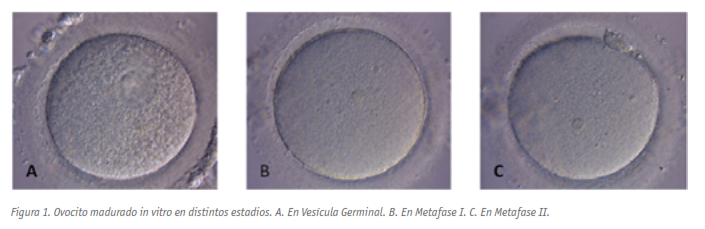
La maduración in vitro (MIV) es una tecnología aplicada en técnicas de reproducción humana asistida, siendo un método por el cual los ovocitos inmaduros procedentes de folículos antrales, se extraen y se maduran en el laboratorio (Figura 1).
Desde la primera experimentación en MIV que fue inicialmente descrita por Pincus y Enzmann (Pincus y Enzmann 1935) en ovocitos de conejo y hasta la actualidad, los protocolos y mejoras de esta metodología han ido avanzando y adaptándose a la aplicación clínica.
La primera MIV de ovocitos humanos y, la primera fecundación de un ovocito madurado in vitro, fue publicada por Edwars (Edwards 1965). Estos hallazgos fueron aplicados inicialmente en un contexto clínico por el equipo del Dr. Veeck, quienes rescataron ovocitos inmaduros recuperados de folículos sometidos a estimulación ovárica con gonadotrofinas (Veeck et al., 1983). Con esta estrategia se demostró que los ovocitos inmaduros no solo eran capaces de culminar la maduración in vitro de forma espontánea, sino también que eran susceptibles de ser fecundados y capaces de desarrollarse in vitro correctamente hasta el estadio de blastocisto.
Los avances en la metodología de MIV ovocitaria permitieron la práctica estricta de la MIV por la que, los ovocitos inmaduros, procedentes de pequeños folículos antrales, en asociación a ciclos de fecundación in vitro no estimulados (o con una mínima estimulación ovárica controlada), son inducidos a madurar mediante complejos sistemas de cultivo in vitro. El equipo del Dr. Trounson consolidó el uso clínico de la MIV tras publicar el primer embarazo en pacientes con síndrome de ovario poliquístico, de las que se recuperaron ovocitos inmaduros de ovarios no estimulados (Trounson et al., 1994).
INDICACIONES PARA MIV
La mayoría de trabajos referentes a maduración ovocitaria in vitro comprende ovocitos inmaduros, recuperados de folículos de pequeño tamaño, de los que se espera obtener precisamente eso, ovocitos inmaduros y crecidos en ovarios no estimulados exógenamente. Estos procedimientos de MIV de ciclos no estimulados o con estimulación suave, pretenden básicamente: i) prevenir a las pacientes de desarrollar una hiperestimulación ovárica; ii) reducir los costes asociados a la estimulación ovárica y iii) reducir la complejidad del tratamiento, eliminando la administración de gonadotrofinas.
Históricamente, la MIV sin estimulación ovárica ha beneficiado a aquellas pacientes que presentaban ovario poliquístico (PCO) o síndrome de ovario poliquístico (Chian et al., 2000; Le Du et al., 2005; Lin et al., 2003; Mikkelsen y Lindenberg 2001), debido al gran número de folículos antrales disponibles por ovario al inicio de la fase proliferativa; lo que, sumado a un protocolo de estimulación ovárica con gonadotrofinas culminaría, casi inevitablemente en un síndrome de hiperestimulación ovárica.
La MIV en ciclo no estimulado también se sugiere como tecnología reproductiva para aquellas pacientes con ovarios normales y ciclos menstruales regulares (Yoon et al., 2001). En este colectivo de pacientes, el objetivo principal es la minimización de los costes derivados de la administración de gonadotrofinas así como la dificultad de los protocolos de fecundación in vitro asociados a la estimulación ovárica controlada.
Asimismo, la MIV se propone como método de elección para pacientes con cáncer, particularmente aquéllas que requieren de una rápida preservación de la fertilidad o presentan un tipo de cáncer sensible a los niveles estrogénicos (Oktay et al., 2010; Fadini et al., 2012).
Sin embargo, la tecnología de MIV también es aplicada en asociación a ciclos de estimulación ovárica controlada. En este caso, no sería una MIV en sentido estricto, ya que la intención del procedimiento de MIV es rescatar ovocitos inmaduros recuperados de folículos de buen tamaño y, los cuales debería haberse obtenido en principio, ovocitos maduros. Tales ovocitos inmaduros, en el caso de ser rescatado, pueden incrementar potencialmente el número de ovocitos del ciclo y, por consiguiente, el número de pre-embriones disponibles (Escrich et al., 2012; Lee et al., 2016).
De hecho esta metodología de rescate ovocitario adquiere un principal interés en aquellas pacientes con baja respuesta o en determinadas circunstancias, cuando el número de ovocitos maduros es más reducido, ya que el éxito del ciclo reproductivo en curso queda comprometido; en estos casos, la MIV es la única alternativa para lograr una gestación (Liu et al., 2003; Lee et al., 2016).
ESTUDIOS MIV
La literatura referente a la optimización de la MIV clínica es extensa y de difícil manejo, debido al empleo de una misma terminología, la maduración in vitro, para describir diversas prácticas y técnicas. Así, la MIV de ovocitos inmaduros ha sido descrita en ciclos estimulados y no estimulados (Cha et al., 2000; Mikkelsen y Lindenberg 2001; Reichman et al., 2010; Escrich et al., 2012) asociados a la inducción o no de la ovulación (Le Du et al., 2005; Yoon et al., 2001); en presencia de las células del cúmulus o sin ellas (Kim et al., 2000; Liu et al., 2003); con diferentes periodos de maduración (Nogueira et al., 2000; Reichma et al., 2010); empleando distintos medios de cultivo y suplementos (De Araujo et al., 2009; Guler et al., 2000), etc.
Estas situaciones tan diversas y/o las combinaciones de las mismas, dificultan la comparación entre estudios, especialmente cuando las técnicas de laboratorio, medios de cultivo y tipo de estimulación no están explícitamente definidos.
Las tasas de éxito, el tipo de cultivo, las indicaciones y, en general, la manera de abordar la técnica de MIV, dependen del origen de los ovocitos que vayan a ser sometidos a la técnica en cuestión. De manera general, se podría dividir la MIV en dos amplios grupos, MIV de ovocitos procedentes de ciclos no estimulados y la MIV de ovocitos procedentes de ciclos estimulados.
MIV de ovocitos procedentes de ciclos no estimulados
Referente al protocolo clínico para la aplicación de la MIV, éste no ha cambiado substancialmente desde que se aplicara inicialmente. En síntesis, se han empleado estas variantes:
- i) MIV sin gonadotrofinas: es el protocolo más original y riguroso, por el que el crecimiento folicular discurre en ausencia de gonadotrofinas exógenas y, en el que la recuperación ovocitaria se practica cuando el folículo de mayor diámetro mide entre 10 y 12 mm; un estadio en el cual aún no se ha establecido la dominancia folicular (Cha et al., 2000).
- ii) MIV con estimulación ovárica suave: es un protocolo alternativo por el que el que el crecimiento folicular es sustentado con dosis bajas de gonadotrofinas; en general se adminitran 150 UI durante 3 días empezando en el día 3 del ciclo menstrual. Es concebible que la administración de pequeñas dosis de esta hormona pueda mejorar la salud folicular e incrementar el número y calidad de los ovocitos recuperados; sin embargo, los resultados no son concluyentes (Lin et al., 2003; Mikkelsen y Lindenberg 2001).
- iii) MIV con hCG-primed, asociado o no a estimulación ovárica suave: este protocolo se propone para facilitar la reanudación de la meiosis in vivo antes de alcanzar la maduración completa in vitro. Normalmente se administra 10.000 UI de hCG cuando el folículo de mayor diámetro alcanza 10-12 mm; realizando la punción 36-38 horas después. Muchos estudios han mostrado la mayor eficacia de los procedimientos de MIV tras la administración exógena de hCG (Chian et al., 2000; Son et al., 2008b), lo que ha permitido incrementar significativamente la tasa de embarazo tras MIV (Chian et al., 2000).
Por lo que respecta a las condiciones de maduración, concretamente referidas al medio de cultivo y sus suplementos, en líneas generales, cabría indicar que deben simular las condiciones fisiológicas intrafoliculares en las que se encuentran los ovocitos objeto de maduración. Llama la atención la existencia de relativamente pocos estudios sobre los medios de cultivo (De Araujo et al., 2009; Moschini et al., 2011), pese a la gran relevancia que esta variable puede llegar a tener sobre la MIV. Se han introducido medios comerciales específicos de MIV, pero no hay evidencias de que su formulación sea idónea para dicho fin. La mayor parte de los modelos de maduración ovocitaria in vitro incluyen la adición de hormonas, destacando la inclusión de FSH, LH, progesterona y estradiol (Trounson et al., 1994). Por su parte, la adición de factores de crecimiento a los medios de maduración ha mostrado ser beneficiosa por incrementar tanto la tasa de maduración nuclear como el potencial de formación de estructuras pronucleares tras la activación ovocitaria (Guler et al., 2000).
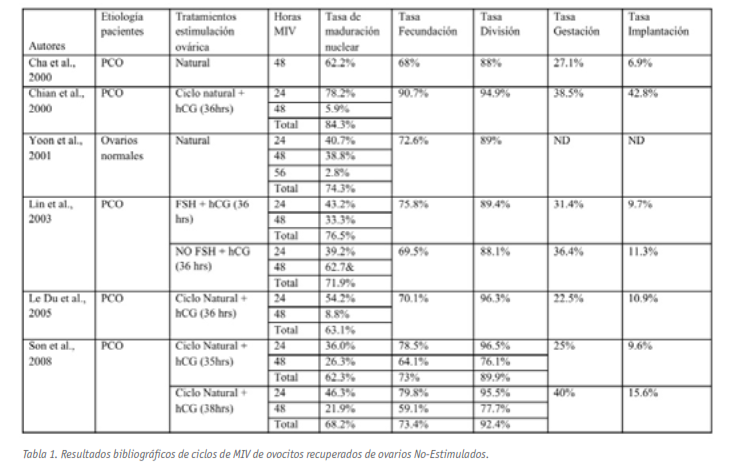
Por lo que respecta a los resultados publicados, las tasas de maduración alcanzadas por ovocitos madurados in vitro tras 48 horas de cultivo fueron superiores al 60% (60-85%), madurando la mayoría de los ovocitos en las primeras 24 horas de cultivo (Tabla 1). En estos ovocitos se observó además que las tasas de fecundación tras microinyección intracitoplasmática de espermatozoides, así como la capacidad de división de los ovocitos madurados in vitro fueron comparables a las observadas en aquéllos madurados in vivo (Chian et al., 2000; Le Du et al., 2005; Lin et al., 2003). En el trabajo de Son (Tabla 1), se muestran dichas tasas, en función del tiempo requerido para alcanzar la madurez nuclear, mostrando que los ovocitos madurados a las 48 horas presentaban significativamente una menor tasa de fecundación, división y desarrollo pre-embrionario in vitro que sus homólogos madurados in vitro durante las primeras 24 horas y aquéllos madurados in vivo (Son et al., 2008a).
En cuanto a los resultados clínicos derivados a partir de ovocitos madurados in vitro, procedentes de pacientes PCO, se han reportado tasas de gestación variables que oscilan entre el 20-38.5% y tasas de implantación entre el 9% y el 42.8%; tasas que resultan más elevadas que aquellas reportadas para ovocitos madurados in vitro pero procedentes de paciente con ovarios normales (Tabla 1).
Por su parte, el análisis cromosómico de los pre-embriones generados a partir de ovocitos madurados in vitro y obtenidos de ciclos no estimulados (Gras et al., 1992; Racowsky et al., 1992), indica tasas de aneuploidías o alteraciones cromosómicas estimadas en aproximadamente el 20%, similares a las reportadas para ovocitos madurados in vivo tras estimulación gonadotrófica y asociados a ciclos de FIV convencionales (Gras et al., 1992; Munne et al., 1993). Aunque estas tasas pudieran parecer elevadas, Lin et al. reportaron 21 nacidos vivos con cariotipo normal y sin malformaciones congénitas cuyo crecimiento y seguimiento fue normal (Lin et al., 2003); habiéndose obtenido a partir de ovocitos madurados in vitro y recuperados de ciclos FSH y hCG-primed. De forma similar, Cha et al. y Child et al. reportaron recién nacidos vivos normales (Cha et al,.2000; Child et al., 2002).
MIV de ovocitos procedentes de ciclos estimulados
En general, los antecedentes bibliográficos encontrados y referentes a la maduración in vitro (MIV) espontánea de ovocitos inmaduros, recuperados de ciclos estimulados, son escasos (Chian y Tan 2002; Kim et al., 2000; Nogueira et al., 2000; Farsi et al., 2011; Reichman et al., 2010; Escrich et al., 2011; Escrich et al., 2012).
Por lo que respecta a la estimulación, el uso de gonadotrofinas es práctica rutinaria vinculada a los ciclos de FIV. Existen muchos protocolos de estimulación ovárica, siendo los más generales:
- i) Uso de agonistas de la GnRH desde la mitad de la fase lútea del ciclo menstrual previo, en protocolo largo, para la supresión hipofisaria, seguido de la utilización de dosis convencionales de FSH o hMG.
- ii) Uso de agonistas de la GnRH en un protocolo “flare”, seguido de la utilización de dosis convencionales de FSH o hMG.
- iii) Uso de antagonistas de la GnRH en un protocolo de estimulación con dosis convencionales de FSH o hMG, iniciadas desde el inicio del ciclo menstrual.
En todos estos protocolos se realiza una monitorización de los folículos así como mediciones de los niveles de estradiol en sangre. De modo general, cuando 2 folículos alcanzan un tamaño de unos 18 mm de diámetro y la concentración de estradiol es mayor de 500 pg/mL, se administra 10.000 UI de hCG y, transcurridas 34-36 horas se realiza la punción ovárica para la captación ovocitaria.
Por lo que respecta al medio de maduración, los diversos estudios muestran que existe una gran variabilidad, desde un medio comercial estándar de cultivo pre-embionario (Nogueira et al., 2000; Farsi et al., 2011; Reichman et al. 2010; Escrich el al., 2012), hasta medios de cultivo con una formulación propia de la maduración ovocitaria (Chian y Tan 2002; Kim et al., 2000).
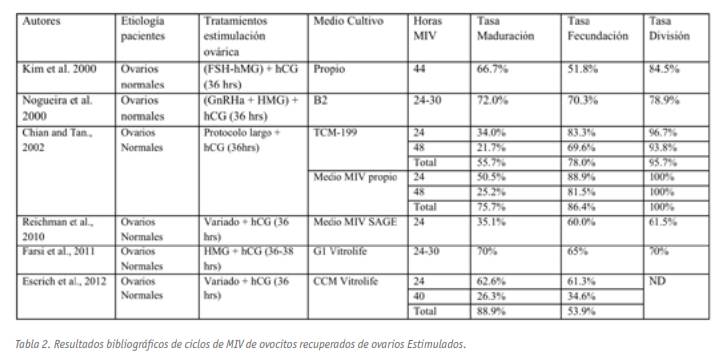
En general, con un periodo de 24 horas se logra la maduración nuclear del 30-60% de las VG cultivadas. Prolongando el periodo de maduración hasta las 30-48 horas, las tasas de maduración globales incrementan hasta el 50-70% (Chian et al., 2002; Escrich et al., 2012).
Las tasas de fecundación de los ovocitos madurados in vitro fueron superiores al 60%; tasas comparables a las obtenidas con ovocitos recuperados maduros tras la punción ovárica. Por su parte, y al igual que sus homólogos madurados in vivo, el 60-94% de los ovocitos correctamente fecundados se dividieron.
Referente a la calidad de los pre-embriones generados por esta metodología, los resultados, cuando los hay (Chian y Tan 2002; Farsi et al., 2011; Kim et al., 2000; Nogueira et al., 2000; Reichman et al., 2010) fueron variados, mostrando tasas de desarrollo hasta el estadio de 8 células del 20% al 69%. Por su parte, Farsi et al. muestra que la tasa de división a pre-embriones de 4 células, en comparación intra-cohorte, madurada in vivo, no presentó diferencias significativas (Farsi et al., 2011).
Por lo que respecta al potencial de desarrollo in vivo de los pre-embriones generados a partir de ovocitos madurados in vitro y recuperados de ciclos estimulados, Child et al. reportaron tasas de gestación por transfer muy limitadas (4%), de las cuales sólo un 2% culmina con un nacimiento, además de una muy baja tasa de implantación (1.5%; Child et al., 2001). Por otro lado, el trabajo de Reichman et al., también presenta resultados de competencia in vivo a partir de ovocitos madurados in vitro (Reichman et al., 2010).
Algunos autores mostraron que la maduración in vitro de ovocitos inmaduros, obtenidos en asociación a un protocolo de estimulación ovárica controlada estándar, produce ovocitos cuyo potencial de fecundación es limitado y/o presentan una división pre-embrionaria deficientes (Kim et al., 2000). Estos autores consideran que el desarrollo de pre-embriones subóptimo se debe a que los ovocitos inmaduros son probablemente “dismaduros”, debido a su exposición intraovárica a niveles suprafisiológicos de gonadotrofinas exógenas. Esta hipótesis explicaría la elevada tasa de aneuploidías (80-90%) observada en pre-embriones generados a partir de ovocitos inmaduros, recuperados en asociación a ciclos de estimulación ovárica controlada estándar (Descisciolo et al., 2000; Nogueira et al., 2000).
CONCLUSIONES
La MIV pudiera ser un procedimiento seguro para obtener ovocitos competentes ya que cerca de unos 2000 niños han nacido por esta tecnología sin mostrar ningún tipo de malformación ni retraso en cuanto a su desarrollo, al menos en edades tempranas, mostrando los recién nacidos un peso medio dentro de los valores considerados normales (Son y Tan, 2010).
La MIV de ovocitos humanos podría ser una atractiva alternativa a la estimulación con gonadotrofinas para pacientes que requieran de técnicas de fecundación in vitro. Sin embargo, la mayoría de centros de FIV no ha adoptado la MIV como técnica rutinaria y muchos centros prefieren los protocolos clásicos de estimulación ovárica. Este hecho es probablemente debido a que los protocolos de MIV requieren de una gran experiencia profesional para la recuperación ovocitaria y tratamiento de los ovocitos (Trounson et al., 1994). Asimismo, una de sus principales ventajas, que originariamente fue el prevenir el síndrome de hiperestimulación ovárica, está actualmente mermado por la existencia de otras estrategias reproductivas para minimizarlo, como por ejemplo, (1) la administración de antagonistas de GnRH para prevenir una luteinización prematura, (2) la administración de un agonista de GnRH en lugar de hCG para inducir la ovulación o (3), la estrategia de vitrificación de ovocitos o pre-embriones a fin de prevenir la manifestación tardía del síndrome de hiperestimulación ovárica en caso de gestación.
El hecho de que existan muy pocos estudios sobre la MIV como rescate ovocitario; es decir, realizando la MIV en aquellos ovocitos reproductivamente desestimados, se debe al supuesto efecto negativo que sobre su competencia pudiera haber ejercido su exposición a dosis altas de gonadotrofinas exógenas, todo lo cual hubiera condicionado a tales ovocitos a no madurar in vivo a su tiempo, consecuencia derivada en una calidad ovocitaria comprometida.
Sin embargo, estudios de nuestro grupo muestran que los ovocitos inmaduros humanos recuperados de ciclos estimulados son competentes nuclearmente y capaces de responder a un estímulo eficiente de activación (señales iniciales de competencia citoplasmática). De nuestros resultados, cabe concluir que la maduración in vitro (MIV) de los ovocitos recuperados de ciclos estimulados es un proceso pre-programado, siendo sólo dependiente del tiempo y existiendo un timing óptimo tanto para la maduración nuclear como para la citoplasmática (Escrich et al., 2012).
A pesar de la posibilidad de que los ovocitos inmaduros no habrían desarrollado su competencia como sus homologos madurados in vivo, los ovocitos inmaduros pueden suponer una oportunidad adicional o única para pacientes con número de MII escasos o nulos en el día de la punción.
Referencias
Cha KY, Han SY, Chung HM, Choi DH, Lim JM, Lee WS, et al. Pregnancies and deliveries after in vitro maturation culture followed by in vitro fertilization and embryo transfer without stimulation in women with polycystic ovary syndrome. Fertil Steril 2000; 73:978-983.
Chian R, Tan S. Maturational and developmental competence of cumulus-free immature human oocytes derived from stimulated and intracytoplasmic sperm injection cycles. Reproductive biomedicine online 2002; 5:125-132.
Chian RC, Buckett WM, Tulandi T, Tan SL. Prospective randomized study of human chorionic gonadotrophin priming before immature oocyte retrieval from unstimulated women with polycystic ovarian syndrome. Hum Reprod 2000; 15:165-170.
Child TJ, Abdul-Jalil AK, Gulekli B, Tan SL. In vitro maturation and fertilization of oocytes from unstimulated normal ovaries, polycystic ovaries, and women with polycystic ovary syndrome. Fertil Steril 2001; 76:936-942.
Child TJ, Phillips SJ, Abdul-Jalil AK, Gulekli B, Tan SL. A comparison of in vitro maturation and in vitro fertilization for women with polycystic ovaries. Obstetrics & Gynecology 2002; 100:665-670.
De Araujo, Carlos Henrique Medeiros, Nogueira D, de Araujo, Maria Cristina Picinato Medeiros, de Paula Martins W, et al. Supplemented tissue culture medium 199 is a better medium for in vitro maturation of oocytes from women with polycystic ovary syndrome women than human tubal fluid. Fertil Steril 2009; 91:509-513.
Descisciolo C, Wright DL, Mayer JF, Gibbons W, Muasher SJ, Lanzendorf SE. Human embryos derived from in vitro and in vivo matured oocytes: analysis for chromosomal abnormalities and nuclear morphology. J Assist Reprod Genet 2000; 17:284-292.
Edwards RG. Maturation in vitro of human ovarian oocytes. The Lancet 1965; 286:926-929.
Escrich L, Grau N, Mercader A, Rubio C, Pellicer A, Escribá M. Spontaneous in vitro maturation and artificial activation of human germinal vesicle oocytes recovered from stimulated cycles. J Assist Reprod Genet 2011; 28:111-117.
Escrich L, Grau N, de los Santos MJ. Romero JL, Pellicer A, Escribá MJ. The dynamics of in vitro maturation of germinal vesicle oocytes. Fertil Steril 2012; 98:1147-1151.
Fadini R, Dal Canto M, Renzini MM, Milani R, Fruscio R, Cantù MG, et al. Embryo transfer following in vitro maturation and cryopreservation of oocytes recovered from antral follicles during conservative surgery for ovarian cancer. J Assist Reprod Genet 2012; 29:779-781.
Farsi MM, Jorsaraei SGA, Esmaelzadeh S, Golaipour MJ. In vitro maturation of germinal vesicle oocytes in stimulated intracytoplasmic sperm injection cycles. Cell Journal (Yakhteh) 2011; 13:73.
Gras L, McBain J, Trounson A, Kola I. The incidence of chromosomal aneuploidy in stimulated and unstimulated (natural) uninseminated human oocytes. Hum Reprod 1992; 7:1396-1401.
Grynberg M, El Hachem H, de Bantel A, Benard J, le Parco S, Fanchin R. In vitro maturation of oocytes: uncommon indications. Fertil Steril 2013; 99:1182-1188.
Guler A, Poulin N, Mermillod P, Terqui M, Cognie Y. Effect of growth factors, EGF and IGF-I, and estradiol on in vitro maturation of sheep oocytes. Theriogenology 2000; 54:209-218.
Kim B, Lee S, Kim K, Han C, Kim J. In vitro maturation, fertilization, and development of human germinal vesicle oocytes collected from stimulated cycles. Fertil Steril 2000; 74:1153-1158.
Le Du A, Kadoch IJ, Bourcigaux N, Doumerc S, Bourrier MC, Chevalier N, et al. In vitro oocyte maturation for the treatment of infertility associated with polycystic ovarian syndrome: the French experience. Hum Reprod 2005; 20:420-424.
Lee H, Barad DH, Kushnir VA, Shotal-Tal A, Lazzaroni-Tealdi E, Wu Y, et al. Rescue in vitro maturation (IVM) of inmature oocytes in stimulated cycle in women with low functional ovarian reserve (LFOR). Endocrine 2016; 52: 165-171.
Lin YH, Hwang JL, Huang LW, Mu SC, Seow KM, Chung J, et al. Combination of FSH priming and hCG priming for in-vitro maturation of human oocytes. Hum Reprod 2003; 18:1632-1636.
Liu J, Lu G, Qian Y, Mao Y, Ding W. Pregnancies and births achieved from in vitro matured oocytes retrieved from poor responders undergoing stimulation in in vitro fertilization cycles. Fertil Steril 2003; 80:447-449.
Mikkelsen AL, Lindenberg S. Benefit of FSH priming of women with PCOS to the in vitro maturation procedure and the outcome: a randomized prospective study. Reproduction 2001; 122:587-592.
Moschini RM, Chuang L, Poleshchuk F, Slifkin RE, Copperman AB, Barritt J. Commercially available enhanced in vitro maturation medium does not improve maturation of germinal vesicle and metaphase I oocytes in standard in vitro fertilization cases. Fertil Steril 2011; 95:2645-2647.
Munne S, Lee A, Rosenwaks Z, Grifo J, Cohen J. Diagnosis of major chromosome aneuploidies in human preimplantation embryos. Hum Reprod 1993; 8:2185-2191.
Nogueira D, Staessen C, Van de Velde H, Van Steirteghem A. Nuclear status and cytogenetics of embryos derived from in vitro–matured oocytes. Fertil Steril 2000; 74:295-298.
Oktay K, Buyuk E, Rodriguez-Wallberg K, Sahin G. In vitro maturation improves oocyte or embryo cryopreservation outcome in breast cancer patients undergoing ovarian stimulation for fertility preservation. Reproductive biomedicine online 2010; 20:634-638.
Pincus G, Enzmann EV. The Comparative Behavior of Mammalian Eggs in Vivo and in Vitro : I. the Activation of Ovarian Eggs. J Exp Med 1935; 62:665-675.
Racowsky C, Kaufman ML, Dermer RA, Homa ST, Gunnala S. Chromosomal analysis of meiotic stages of human oocytes matured in vitro: benefits of protease treatment before fixation. Fertil Steril 1992; 57:1026-1033.
Reichman DE, Politch J, Ginsburg ES, Racowsky C. Extended in vitro maturation of immature oocytes from stimulated cycles: an analysis of fertilization potential, embryo development, and reproductive outcomes. J Assist Reprod Genet 2010; 27:347-356.
Son WY, Chung JT, Chian RC, Herrero B, Demirtas E, Elizur S, et al. A 38 h interval between hCG priming and oocyte retrieval increases in vivo and in vitro oocyte maturation rate in programmed IVM cycles. Hum Reprod 2008a; 23:2010-2016.
Son WY, Chung JT, Herrero B, Dean N, Demirtas E, Holzer H, et al. Selection of the optimal day for oocyte retrieval based on the diameter of the dominant follicle in hCG-primed in vitro maturation cycles. Hum Reprod 2008b; 23:2680-2685.
Son WY, Tan SL. Laboratory and embryological aspects of hCG-primed in vitro maturation cycles for patients with polycystic ovaries. Hum Reprod Update 2010; 16:675-689.
Trounson A, Wood C; Kausche A. In vitro maturation and the fertilization and developmental competence of oocytes recovered from untreated polycystic ovarian patients. Fertil Steril 1994; 62:353-362.
Veeck LL, Wortham JW, Jr, Witmyer J, Sandow BA, Acosta AA, Garcia JE, et al. Maturation and fertilization of morphologically immature human oocytes in a program of in vitro fertilization. Fertil Steril 1983; 39:594-602.
Yoon H, Yoon S, Son W, Lee S, Park S, Im K, et al. Clinical assisted reproduction: pregnancies resulting from in vitro matured oocytes collected from women with regular menstrual cycle. J Assist Reprod Genet 2001; 18:325-329.