MEDIOS DE CULTIVO PARA FECUNDACIÓN IN VITRO: ¿QUÉ LES FALTA PARA SER PERFECTOS?
Pilar Coy
Departamento de Fisiología. Facultad de Veterinaria. Universidad de Murcia.
Campus de Espinardo. Murcia.
email: pcoy@um.es
Actualmente, los medios de cultivo que se emplean en los tratamientos de reproducción asistida humana los proporcionan diferentes casas comerciales especializadas que, en mayor o menor medida, nos informan sobre la composición cualitativa de los mismos, sin ofrecer apenas datos cuantitativos. Este hecho contrasta enormemente con la situación que encontramos en los laboratorios dedicados a la reproducción en diferentes especies de animales, en su mayoría mamíferos, cuyos datos sirven o al menos deberían servir, tras los correspondientes ensayos clínicos, para mejorar la eficacia de los medios empleados en la especie humana. El papel de los embriólogos humanos en este campo podría adquirir una gran relevancia a nivel investigador si ellos, como especialistas que se enfrentan diariamente a la manipulación y el cultivo de los gametos o embriones, dispusieran de la información necesaria para poder valorar el efecto de los diferentes componentes de los medios de cultivo sobre el éxito del proceso reproductivo. Para ilustrar esta idea, este artículo presenta algunos ejemplos de moléculas con efecto beneficioso en la fecundación de diferentes modelos animales que no están actualmente presentes en los medios de cultivo humanos. Asimismo, revisa algunos aspectos sobre la composición actual de los medios de cultivo comparándolos con los correspondientes fluidos fisiológicos que pretenden imitar. Rev Asoc Est Biol Rep 2012; 17(1):44-52
INTRODUCCIÓN
Desde el nacimiento de Louis Brown en 1978 hasta la actualidad, el desarrollo de la fecundación in vitro (FIV) en la especie humana ha sido espectacular y el número de niños nacidos en el mundo por este método o por su más reciente variante, la inyección intracitoplasmática de espermatozoides (ICSI), ha ido incrementando exponencialmente. Curiosamente, aunque la primera referencia sobre el nacimiento de un mamífero (conejo) por FIV data de 1959 (Chang, 1959), el nacimiento del primer ternero se produjo en el año 1982 (Brackett et al., 1982) y el primer potrillo no nació hasta el año 1990 (Palmer et al., 1991), es decir, 12 años después del nacimiento de Louis Brown. Aún en la actualidad, el nivel de éxito de esta técnica en las distintas especies de mamíferos está muy por debajo del alcanzado en la especie humana. Por lo tanto, podríamos decir que éste es un campo de la biomedicina en el que el desarrollo de una tecnología o la puesta en marcha de unos determinados tratamientos en la especie humana no se han producido mayoritariamente sobre la base de la investigación de dicha técnica o tratamiento en modelos animales. Por este motivo, cabría preguntarse: ¿Tiene sentido utilizar modelos animales para continuar avanzando en el desarrollo de la FIV humana? ¿Se ha alcanzado un máximo en el éxito de este procedimiento y por lo tanto ya no hay nada que podamos mejorar? Al margen de la necesidad de obtener gametos sanos para su uso, que no podemos “fabricar”, ¿hay algo que podamos hacer para mejorar el medio de cultivo en el que tiene lugar el contacto entre los gametos, medio que sí podemos “fabricar”? Y, finalmente, ¿debería ser la composición de ese medio de cultivo similar al fluido biológico al que trata de imitar o, por el contrario, debemos intentar diseñar medios químicamente definidos que no dejen ningún cabo suelto en cuanto a la posible acción incontrolada de moléculas “desconocidas”? Éstas y otras preguntas intentarán ser respondidas en los próximos párrafos.
1. MODELOS ANIMALES PARA INVESTIGACIÓN EN BIOLOGÍA REPRODUCTIVA.
En el campo de la biología reproductiva, como en muchos otros campos de la biomedicina, existe una preferencia absoluta por el ratón como modelo animal para investigación. Esto se debe, en gran parte, al espectacular desarrollo de los animales transgénicos, tanto knock out como knock in (Mansour, Thomas & Capecchi, 1988), en los que se inactivan o se introducen uno o varios genes mediante ingeniería genética y se estudia la pérdida o ganancia de función que se produce como consecuencia de dicha manipulación. De este modo se consiguen asignar funciones específicas a genes concretos. En el caso que nos ocupa, la composición de los medios de cultivo, el modelo de ratón puede no ser el más adecuado para la investigación en el tema por varias razones.
Partiendo de las particularidades fisiológicas de la reproducción en ratones y llegando hasta la estructura molecular de la zona pelúcida (ZP), las diferencias con la especie humana son mayores que las que encontramos en otros modelos animales como el porcino o el bovino. Por ejemplo, el número de crías que tienen las ratonas de forma natural, y por tanto la conformación anatómica del ovario o del útero, las alejan bastante del modelo humano, en el que sólo un ovocito suele ser ovulado en cada ciclo y en el que los cuernos uterinos apenas están desarrollados.
La ratona, como la cerda, presenta unos cuernos uterinos largos que proporcionalmente convierten casi en inexistente al cuerpo del útero, de manera que pueden albergar a los numerosos fetos que se desarrollan tras la ovulación de los correspondientes ovocitos, característica fundamental de estas especies politocas. Por otra parte, la duración de la gestación en la ratona es inferior a un mes, y en la cerda próxima a los 4 meses, lo cual también las aleja del modelo humano. En este sentido, por lo tanto, la vaca sería un modelo mucho más próximo a la mujer, ya que el número de ovulaciones por ciclo y el tiempo de gestación son prácticamente iguales en ambas especies.
La segunda razón que aleja la posibilidad de que los resultados de las investigaciones sobre el proceso de fecundación en el modelo de ratón puedan extrapolarse en algunos casos a la especie humana se basa en el hecho de que la FIV en el ratón se realiza con espermatozoides procedentes de epidídimo. Como sabemos, los espermatozoides eyaculados presentan modificaciones a nivel de la membrana plasmática tras el contacto con el plasma seminal que les protegen de una capacitación o reacción acrosómica prematuras (Fraser et al., 2006; Way, Griel & Killian, 2000) y por ello necesitan de una serie de tratamientos (técnicas de swim-up, selección a través de gradientes de densidad, etc.) antes de poder ser utilizados para la fecundación in vitro. Al mismo tiempo, existen proteínas en el plasma seminal que estimulan la capacidad fecundante de los espermatozoides (Calvete & Sanz, 2007), por lo que en el modelo de ratón los estudios relacionados con las moléculas implicadas en la unión y reconocimiento del ovocito deben ser considerados con cautela, ya que dichas proteínas no se encuentran presentes en los ensayos de FIV con espermatozoides de epidídimo. Esto significa que la introducción en los medios de cultivo de determinadas moléculas que pueden ser de utilidad para facilitar la motilidad o la capacidad de penetración de los espermatozoides de epidídimo puede no ser adecuada en modelos en los que se utilizan espermatozoides eyaculados.
Sin embargo, el caso contrario también es digno de mención: en especies de ungulados que podrían ser buenos modelos, como la vaca o la cerda, debido a que en los ensayos de FIV se utilizan mayoritariamente espermatozoides eyaculados, los ovocitos suelen ser de origen folicular y no han tenido, al contrario de lo que ocurre en la ratona, ningún contacto con el ambiente oviductal. Como veremos más adelante, el fluido oviductal ejerce una función importante en el proceso de interacción entre gametos, ya que es capaz de modificar los sitios de unión para los espermatozoides en la zona pelúcida, alterando su estructura y propiedades físico-químicas (Coy et al., 2008). Por ello, tampoco la FIV en estas especies simula estrictamente hablando el mecanismo molecular de unión espermatozoide-ovocito que acontece in vivo. Debido a que en la especie humana se utilizan ovocitos de origen folicular, estos modelos, en cualquier caso, estarían más próximos que el de ratón a los ensayos que se realizan en los laboratorios de reproducción asistida, por lo que para la investigación sobre los componentes de los medios de cultivo a emplear resultarían teóricamente más adecuados.
Finalmente, y ahondando en las diferencias a nivel molecular, es importante recordar que la zona pelúcida humana está formada por cuatro glicoproteínas (ZP1, ZP2, ZP3 y ZP4) (Lefievre et al., 2004) mientras que la zona de ratón está formada por tres (ZP1, ZP2, ZP3) (Bleil & Wassarman, 1980). Esto implica, de nuevo, que es probable que existan diferencias en el proceso de fecundación entre ambas especies que hagan necesarios estudios en otros modelos para comprender en mayor profundidad los mecanismos moleculares que intervienen.
2. MEDIOS DE CULTIVO HUMANOS VERSUS MEDIOS ANIMALES
Los medios de cultivo para FIV y para las etapas iniciales del desarrollo embrionario están descritos a nivel cualitativo y cuantitativo en la mayoría de las especies domésticas, al contrario de lo que ocurre en la especie humana. La investigación en este aspecto avanza continuamente, y se han estudiado factores como la concentración idónea de O2 en el ambiente del incubador (Gomes Sobrinho et al., 2011; Goovaerts et al., 2009), los beneficios del cocultivo de los gametos con células del oviducto (Romar et al., 2003), del cumulus o de la granulosa (Campos et al., 2001; Goovaerts et al., 2009), la utilización de oviductos hospedadores de oveja para cultivo de cigotos de especies de alto valor económico (como la bovina o la equina) durante su transición hasta el estadio de blastocisto (Lazzari et al., 2010), etc.
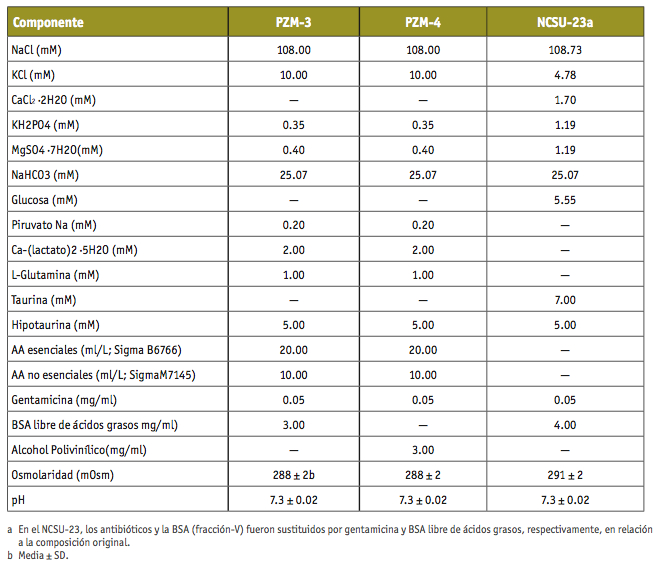
En cuanto a su composición, todos los medios de cultivo están basados en fórmulas similares, que suelen incluir iones, compuestos energéticos (glucosa, lactato o piruvato), aminoácidos, alguna macromolécula biológica (albúmina sérica bovina, BSA) o sintética (alcohol polivinílico, PVA), vitaminas, agentes quelantes, antioxidantes, hormonas o factores de crecimiento, antibióticos y un sistema tampón para mantener el pH estable (Gardner, 2008).
Sin embargo, mientras que las publicaciones en las que se investiga el efecto de determinadas condiciones o componentes sobre el éxito del desarrollo embrionario en especies animales indican, con todo lujo de detalles, las concentraciones de los reactivos químicos e incluso sus códigos de referencia y empresa que los comercializa, la situación en la especie humana es diferente. En primer lugar, porque los medios de fecundación o cultivo embrionario humanos están fabricados bajo unas estrictas condiciones de seguridad toxicológica, inmunológica y pureza que no están legisladas para las especies animales y, por lo tanto, los comercializan empresas farmacéuticas o similares en régimen de competencia entre ellas. Es, en este sentido, parcialmente comprensible que protejan sus fórmulas (y en muchos casos los resultados de sus investigaciones) mediante la obtención de patentes o acuerdos de confidencialidad. Por el contrario, los medios empleados en animales, con algunas excepciones, se suelen preparar en los propios laboratorios de FIV y son completamente transparentes al estar publicados en numerosos artículos de revistas de investigación. Ejemplos de ambos casos podemos verlos en la tabla 1 en la que se muestra la fórmula completa de 3 medios de cultivo empleados en la especie porcina y en las Figuras 1 y 2, donde se muestran los datos públicos de un medio empleado en FIV humana.
TABLA I. Composición de diferentes medios para el cultivo de embriones porcinos (Yoshioka et al., 2002).
En segundo lugar, es precisamente esta preparación “in situ” de los medios de cultivo animales lo que les dota de una flexibilidad y rapidez de cambio de la que carecen los medios empleados en la especie humana. Un medio comercial que se utiliza en una clínica puede no variar durante años y, cuando lo hace, no es porque así lo decidan los embriólogos que lo usan en los laboratorios de dichas clínicas, sino porque, como resultado de las investigaciones de la casa comercial de que se trate, ésta decide hacer las modificaciones oportunas. En este sentido, y pese al buen rendimiento de los medios humanos, cabría preguntarse por cuánto se podría multiplicar el éxito de los tratamientos en las clínicas de reproducción asistida si los embriólogos de las mismas, además de los que trabajan para las compañías farmacéuticas, pudieran aportar su experiencia y participar en la toma de decisiones sobre la composición cualitativa y cuantitativa de los medios de cultivo que emplean, aunque éstos nunca puedan llegar a fabricarse “in situ” por sus requisitos especiales.
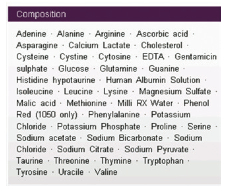
Para ilustrar esta última idea hemos realizado una búsqueda sobre medios de cultivo para FIV humana fabricados por una de las empresas del sector que más información ofrece en su página web sobre la composición de los mismos. Se trata de Medicult, que comercializó el Universal IVF medium hace ya 20 años. En la información del producto publicada en la página web (http://www.origio. com) encontramos referencias de su uso en trabajos publicados en 1992 (Hammadeh et al., 1992, no localizado en la base de datos del National Center for Biotechnology Information NCBI, coloquialmente conocida como “pubmed”), 1998 (Barak et al., 1998) y hasta 2004 (Kattera & Chen, 2004). En cuanto a su composición, todos los datos publicados son los que aparecen en la Figura 1.
Como puede observarse, la composición cuantitativa del medio no es pública. Esta misma empresa comercializa años más tarde el medio ISM1 y refiere en su página web un artículo publicado en 2010 (Xella et al., 2010) en el que, tras un estudio comparativo con el Universal IVF medium, se demuestra que con este nuevo medio mejora el desarrollo embrionario y se obtienen tasas de gestación mayores.
Figura 1. Componentes del Universal IVF Medium de Medicult
Los datos sobre la composición del medio en esta ocasión son los que se refieren en la Figura 2:
Figura 2. Componentes del ISM1 de Medicult
Es decir, la empresa ha cambiado el medio de FIV aproximadamente 15 años después de haber comercializado la primera versión. ¿Significa esto que en 15 años no se ha producido ningún avance en la investigación sobre la composición de los medios de cultivo y no se ha identificado ninguna nueva molécula de interés para su inclusión en la fórmula?
Si realizamos una búsqueda similar en las páginas de cualquier otra empresa que comercialice medios de cultivo, la información que aportan sobre los mismos suele ser incluso menor. Así, en el caso de Vitrolife (http://www. vitrolife.com), todo lo que sabemos sobre el G-IVF plus es que se trata de un medio tamponado con bicarbonato y que contiene hialuronano y BSA. Para el caso del Quinn’s Advantage Fertilization (HTF) Medium, de SAGE Biopharma (http://www.biocareeurope.com), la información es algo más abundante, ya que se indica que contiene cloruro sódico, cloruro potásico, sulfato magnésico, fosfato potásico, lactato cálcico, bicarbonato sódico, glucosa, piruvato sódico, alanil-glutamina, taurina, L-asparagina, L-ácido aspártico, glicina, L-prolina, L-serina, citrato sódico, EDTA, gentamicina y rojo fenol. En cuanto al Fertilization Medium de Cook (http://www.cookartlab. com/), la información publicada indica que es un medio tamponado con bicarbonato que contiene glucosa, antioxidantes y aminoácidos no esenciales. Finalmente, en el caso de Global (http://www.ivfglobal.com/), los datos públicos nos informan de que es un medio libre de glucosa y fosfato, y de que contiene EDTA, taurina, glutatión y alanil glutamina.
De todo lo expuesto anteriormente podríamos concluir que los avances que se han ido produciendo en la composición de los medios de cultivo empleados en las clínicas humanas derivan fundamentalmente de investigaciones privadas que no incluyen la opinión más o menos directa de los usuarios finales de estos medios, los embriólogos que trabajan en los laboratorios de FIV. Además, es desconocido para la opinión pública en qué se basan estos avances, y qué modelos animales se utilizan, en caso de que se utilicen, para obtenerlos. Obviamente, el ratón es la especie más probablemente empleada pero, a la vista de los comentarios anteriores, cabría preguntarse si el uso de otras el medio en el que tiene lugar la fecundación in vivo, es un objetivo hoy día inconcluso. No sólo resulta compleja la obtención del fluido in vivo (durante intervenciones quirúrgicas en mujeres o canulaciones directas del oviducto en animales de experimentación) o in vitro (mediante la escisión del oviducto tras el sacrificio de animales de abasto o mediante perfusión vascular y luminal, Leese et al., 2008) sino que los datos obtenidos tras el análisis de las muestras pueden verse alterados por el método de recogida utilizado (Leese et al., 2008). Además, hay que tener en cuenta que el fluido oviductal no tiene una composición estática, ya que la secreción de las células epiteliales del oviducto está regulada hormonalmente y, precisamente tras la ovulación, los niveles de estrógenos y progesterona se ven significativamente afectados. Esto implica que desde el momento en que el ovocito es ovulado hasta que ocurre la fecundación y durante las siguientes horas, la composición del fluido sufre variaciones que aún hoy día no han sido determinadas con precisión (Hunter, 2011). Ésta es la razón última de la oferta comercial de medios de cultivo secuenciales, que teóricamente se adaptan a la composición del fluido oviductal en cada etapa.
En tercer y último lugar, porque aun conociendo con exactitud la composición del fluido oviductal en condiciones fisiológicas en cada una de las etapas cercanas al momento de la fecundación, el número de componentes es tan elevado que resultaría enormemente costoso fabricar un medio que los incluyera a todos. Dejando a un lado otros componentes, y centrándonos exclusivamente en las proteínas, podemos entender mejor esta última afirmación. Gracias al desarrollo de la Biología Molecular y, más concretamente, de las técnicas de proteómica o genómica funcional estamos asistiendo en los últimos años a un incremento gigantesco en el número de datos existentes sobre las proteínas que están presentes en un determinado tejido en una situación concreta. Así, hoy disponemos por ejemplo de estudios realizados con células del epitelio oviductal humano (Tone et al., 2008) en las que se han determinado los genes que se expresan diferencialmente en la fase luteínica de mujeres portadoras de una mutación génica frente a mujeres normales. En este estudio se identifican 21 genes regulados a la baja en mujeres sanas en fase luteal y 322 genes regulados a la baja en esta misma fase en mujeres portadoras, siendo 3 genes de éstos coincidentes en ambos grupos. De modo similar, y utilizando la misma tecnología de microarrays de este estudio, es posible conocer las diferencias en la expresión génica de las células del oviducto entre las fases folicular y luteínica. Teniendo en cuenta que el número total de genes expresados en este tipo celular es de varios miles, se puede entender que la información que se maneja es muy difícil de trasladar a la práctica. En cualquier caso, esta información nos ofrecería una primera aproximación a las posibles proteínas que podrían estar jugando un papel clave durante los momentos previos a la fecundación, durante la fecundación propiamente dicha y tras la formación del cigoto, ya que sus correspondientes genes se estarían expresando diferencialmente en cada etapa.
Para concretar más estos datos, y conocer las proteínas candidatas a ser incluidas en los medios para la fecundación o para las etapas iniciales del desarrollo embrionario, es necesario complementar los estudios de genómica funcional en las células epiteliales con los de proteómica en el fluido oviductal. De este modo, sólo aquellos genes que se expresaran diferencialmente en cada fase y que se tradujeran en proteínas secretadas a la luz oviductal serían de interés para estudiar su efecto sobre los resultados de fecundación. Los datos sobre las proteínas presentes en el fluido oviductal humano no son muy abundantes, pero una revisión reciente que incluye las referencias publicadas sobre proteínas identificadas en el oviducto de diferentes mamíferos indica que son, al menos, 160 (Avilés, Gutiérrez-Adán & Coy, 2010). De ellas, hay algunas cuya función es ampliamente conocida y otras de las que aún se sabe muy poco, pero lo que resulta evidente es que si el epitelio oviductal secreta activamente unos componentes determinados en momentos muy concretos del proceso de fecundación y primeras divisiones embrionarias, es porque dichos componentes tienen una función que realizar. En este sentido, se ha comprobado que la presencia de los gametos en el oviducto modifica la expresión de determinadas proteínas, siendo algunas de ellas exclusivamente reguladas por los ovocitos, otras por los espermatozoides y otras por ambos (Georgiou et al., 2005).
Entre los procesos que tienen lugar en el oviducto y que pueden estar modulados por las moléculas presentes en el fluido oviductal podemos mencionar la maduración final de los gametos, incluyendo la maduración zonal del ovocito (Coy & Avilés, 2010) y las últimas etapas de la capacitación espermática (Suarez, 2007); el reconocimiento y unión entre espermatozoides y ovocitos, o fecundación propiamente dicha; las primeras divisiones embrionarias, ya que se han descrito diversos factores embriotróficos en el oviducto (Lee & Yeung, 2006), o la protección del embrión frente a efectos adversos sobre la transcripción/replicación del DNA mitocondrial y apoptosis (Lloyd et al., 2009).
A modo de resumen, podríamos decir que para mejorar la eficacia de los medios de FIV humana actuales sería necesario seleccionar aquellas moléculas del fluido oviductal que hubieran demostrado previamente, en modelos animales,unefectobeneficiosoenel éxito final del proceso. Dos proteínas candidatas que cumplen estos requisitos y no están incluidas en los medios de FIV actualmente son la proteína específica del oviducto OVGP1 u oviductina y el plasminógeno, y a ellas dedicaremos el último apartado de este artículo.
4. NUEVOS COMPONENTES ¿SE INCORPORARÁN ALGÚN DÍA?
4.1. GLICOPROTEÍNA ESPECÍFICA DEL OVIDUCTO U OVIDUCTINA (OVGP1)
La OVGP1 ha sido identificada en varias especies de mamíferos incluyendo a la mujer, ratona, hámster, vaca, cerda, y babuina (Arias, Verhage & Jaffe, 1994; Buhi et al., 1996; Donnelly et al., 1991; Sendai et al., 1994; Sendai et al., 1995; Suzuki et al., 1995). Su secreción depende de las concentraciones séricas de estrógenos y se ha demostrado su unión a la ZP de los ovocitos tras la llegada de éstos al oviducto en algunas especies. En la mujer, aunque no hay evidencias directas de ello, sí hay datos indirectos que así lo sugieren (O’Day- Bowman et al., 1996).
Entre sus funciones, se le ha atribuido una mejora de los resultados de fecundación y desarrollo embrionario (McCauley et al., 2003) mediada por la modulación de la unión de los espermatozoides a la ZP. Recientemente, se ha avanzado en la descripción de su mecanismo de acción
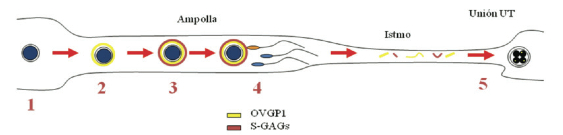
y se ha podido demostrar que interviene en el aumento de la resistencia de la ZP a la digestión enzimática tras su contacto con el fluido oviductal (Coy et al., 2008). Este hecho conlleva que la zona, a su vez, se hace más resistente a la unión de espermatozoides, por lo que la OVGP1 contribuye al control de la polispermia. Hasta hace unos años, y sobre la base de estudios en roedores, se consideraba que este fenómeno, denominado “hardening” o endurecimiento de la ZP, era debido a la liberación del contenido de los gránulos corticales del ovocito tras la entrada del primer espermatozoide (Barros &Yanagimachi,1971;Gulyas&Yuan, 1985). Sin embargo, al menos en la vaca y la cerda se ha podido comprobar que el endurecimiento de la ZP es un fenómeno previo a la fecundación, tiene lugar en el oviducto y se debe a la unión de OVGP1 y glicosaminoglicanos tipo heparina a la ZP (Coy et al., 2008). El mecanismo es reversible, es decir, los ovocitos presentan la ZP “endurecida” cuando se encuentran en la ampolla oviductal listos para contactar con los espermatozoides. Si los situamos en un medio carente de heparina, la resistencia de la ZP desaparece (Coy et al., 2008). Es más, en los cigotos recogidos del istmo o en los embriones recién llegados al útero, la ZP recupera su baja resistencia inicial a la digestión proteolítica (Kolbe & Holtz, 2005), lo quefacilitaríaelprocesodeeclosión del blastocisto. Una representación esquemática de este mecanismo podemos observarla en la Figura 3.
Figura 3 (modificada de Coy & Avilés, 2010). Descripción del mecanismo pre-fecundación propuesto para la prevención de la polispermia en ungulados. Cuando el ovocito es liberado en la ampolla (1) poco después de la ovulación, la glicoproteína específica del oviducto (OVGP1) lo rodea formando una “cubierta” que es responsable de la resistencia de la ZP a la proteolísis (2). Los glicosaminoglicanos tipo heparina (S-GAGs) del fluido oviductal estabilizan y refuerzan la union OVGP1con la ZP (3), afectando su interacción con los espermatozoides seleccionados (4). Durante el tránsito del ovocito fecundado hacia el útero, el sistema se desestabiliza y la OVGP1 es desprendida parcialmente o introducida en el interior del cigoto (5).
Todos los datos anteriores indican claramente que la OVGP1 está implicada en el éxito de la fecundación y, sin embargo, no forma parte de los componentes de los medios de FIV. En la actualidad, del mismo modo que se ha introducido la BSA recombinante o el hilauronano en los medios comerciales, la producción de OVGP1 recombinante y su inclusión en los mismos redundaría muy probablemente en beneficio de las pacientes.
4.2. SISTEMA PLASMINÓGENO PLASMINA
El plasminógeno es un zimógeno secretado mayoritariamente por el hígado que participa en la resolución de los coágulos sanguíneos tras su activación en la enzima proteolítica plasmina (Collen & Lijnen, 1995). Dicha activación está mediada por activadores denominados tPA, o
activador del plasminógeno tipo tisular y uPA, o activador del plasminógeno tipo uroquinasa. En general, el sistema plasminógeno-plasmina está presente en numerosos tejidos orgánicos y su función principal consiste en degradar la matriz extracelular. Por ello, se ha demostrado su intervención en procesos como la invasión de tejidos por las células tumorales (Andreasen, Egelund & Petersen, 2000), la implantación del embrión en el endometrio (Menino et al., 1997) o la rotura de la pared folicular durante la ovulación (Liu, 2004).
Recientemente, se ha determinado la presencia de plasminógeno en el fluido oviductal de cerda y de vaca, cuantificando su concentración, que está muy próxima a los niveles encontrados en el plasma sanguíneo humano (Mondéjar et al., 2011).
Por lo tanto, es muy probable que el plasminógeno también se encuentre en el fluido oviductal de la mujer. En el estudio de Mondéjar et al. (2011) se observó que el plasminógeno se une a la ZP y al oolema de los ovocitos y que tras el contacto con el espermatozoide su presencia es menor. Esto coincidió con la liberación total o parcial de los activadores de plasminógeno (tPA y uPA) que también estaban presentes en el ovocito. En cuanto a los resultados de FIV, la adición de plasminógeno disminuyó el número de espermatozoides que penetraron en los ovocitos lo cual, en algunas especies como la cerda, donde la polispermia es muy elevada, puede suponer una ventaja. Lo más importante de este estudio es que sugiere que el sistema plasminógeno-plasmina se activa en los ovocitos durante su interacción con los espermatozoides y, por lo tanto, si lo regulamos al alza o a la baja añadiendo activadores o inhibidores en los medios de cultivo podemos aumentar o disminuir la penetración espermática según nos interese en la especie en la que estemos trabajando.
De gran interés también es el hecho de que los activadores del plasminógeno se han detectado en los espermatozoides humanos y de varias especies animales (Smokovitis et al., 1987) y que su influencia sobre la reacción acrosómica y la motilidad espermática parece demostrada (Hong et al., 1985). Por ello, su inclusión en los medios de FIV humana podría resultar beneficiosa para favorecer la funcionalidad de los espermatozoides.
Finalmente, el hecho de que el sistema plasminógeno-plasmina intervenga en la invasión del endometrio por parte del embrión (Aflalo et al., 2004) lo convierte en un buen candidato para ser utilizado en los medios de transferencia de embriones y disminuir de este modo los fallos de implantación.
CONCLUSIONES
La variada composición del fluido oviductal y su enorme dinamicidad espacio-temporal hacen muy complicado el diseño de medios para FIV que reflejen fielmente las características de este fluido. Sin embargo, la investigación basada en estudios de proteómica y genómica puede aportar interesantes datos sobre moléculas, nuevas o ya conocidas, que podrían incrementar la eficacia de las ARTs si se incluyeran en los medios de cultivo comerciales. Es labor de todas las personas que trabajan en las clínicas de reproducción asistida contribuir al desarrollo de estos medios de cultivo futuros para mejorar el servicio que se ofrece a las parejas con problemas de fertilidad.
Referencias
Aflalo, E. D., Sod-moriah, U. A., Potashnik, G. & Har-Vardi, I. (2004). Differences in the implantation rates of rat embryos developed in vivo and in vitro: possible role for plasminogen activators. Fertil Steril 81 Suppl 1, 780-785.
Andreasen, P., Egelund, R. & Petersen, H. (2000). The plasminogen activation system intumorgrowth,invasion,andmetastasis. Cell Mol Life Sci 57, 25-40.
Arias, E. B., Verhage, H. G. & Jaffe, R. C. (1994). Complementary deoxyribonucleic acid cloning and molecular characterization of an estrogen-dependent human oviductal glycoprotein. Biol Reprod 51, 685-694.
Avilés, M., Gutiérrez-Adán, A. & Coy, P. (2010). Oviductal secretions: Will they be key factors for the future ARTs? Mol Hum Reprod 16, 896-906
Barak, Y., Goldman, S., Gonen, Y., Nevo, Z., Bartoov, B. & Kogosowski, A. (1998). Does glucose affect fertilization, development and pregnancy rates of human in-vitro fertilized oocytes? Hum Reprod 13 Suppl 4, 203-211.
Barros, C. & Yanagimachi, R. (1971). Induction of zona reaction in golden hamster eggs by cortical granule material. Nature 233, 268-269.
Bleil, J. & Wassarman, P. (1980). Structure and function of the zona pellucida: identification and characterization of the proteins of the mouse oocyte’s zona pellucida. Dev Biol 76, 185-202.
Brackett, B. G., Bousquet, D., Boicet, M. L., Donawick, W. J., Evans, J. F. & Dressel, M. A. (1982). Normal development following in vitro fertilization in the cow. Biol Reprod 27, 147-158.
Buhi, W. C., Alvarez, I. M., Choi, I., Cleaver, B. D. & Simmen, F. A. (1996). Molecular cloning and characterization of an estrogen- dependent porcine oviductal secretory glycoprotein. Biol Reprod 55, 1305-1314.
Calvete, J. J. & Sanz, L. (2007). Insights into structure-function correlations of ungulate seminal plasma proteins. Soc Reprod Fertil Suppl 65, 201-215.
Campos, I., Coy, P., Romar, R., Ruiz, S. & Gadea, J. (2001). Effects of maturational stage, cumulus cells and coincubation of mature and immature cumulus-oocyte complexes on in vitro penetrability of porcine oocytes. Theriogenology 55, 1489-500.
Chang, M. C. (1959). Fertilization of rabbit ova in vitro. Nature 184(Suppl 7), 466-467.
Collen, D. & Lijnen, H. (1995). Molecular basis of fibrinolysis, as relevant for thrombolytic therapy.ThrombHaemost74,167-171.
Coy, P. & Avilés, M. (2010). What controls polyspermy in mammals, the oviduct or the oocyte? Biol Rev
Camb Philos Soc 85, 593-605.
Coy, P., Cánovas, S., Mondéjar, I., Saavedra, M., Romar, R., Grullón, L., Matás, C. & Avilés, M. (2008). Oviduct-specific glycoprotein and heparin modulate sperm-zona pellucida interaction during fertilization and contribute to the control of polyspermy. Proc Natl Acad Sci U S A 105, 15809-15814.
Donnelly, K., Fazleabas, A., Verhage, H., Mavrogianis, P. & Jaffe, R. (1991). Cloning of a recombinant complementary DNA to a baboon (Papio anubis) estradiol- dependent oviduct-specific glycoprotein. Mol Endocrinol 5, 356-364.
Fraser, L. R., Adeoya-Osiguwa, S. A., Baxendale, R. W. & Gibbons, R. (2006). Regulation of mammalian sperm capacitation by endogenous molecules. Front Biosci 11, 1636-1645.
Gardner, D. (2008). Dissection of culture media for embryos: the most important and less important components and characteristics. Reprod Fertil Dev 20, 9-18.
Georgiou, A. S., Sostaric, E., Wong, C. H., Snijders, A. P., Wright, P. C., Moore, H. D. & Fazeli, A. (2005).
Gametes alter the oviductal secretory proteome. MolCell Proteom : MCP 4, 1785-1796.
Gomes Sobrinho, D. B., Oliveira, J. B., Petersen, C. G., Mauri, A. L., Silva, L. F., Massaro, F. C., Baruffi, R.
L., Cavagna, M. & Franco, J. G. (2011). IVF/ICSI outcomes after culture of human embryos at low oxygen tension: a meta-analysis. Reprod Biol Endocrinol 9, 143.
Goovaerts, I. G., Leroy, J. L., Van Soom, A., De Clerq, J. B., Andries, S. & Bols, P. E. (2009). Effect of cumulus cell coculture and oxygen tension on the in vitro developmental competence of bovine zygotes cultured singly. Theriogenology 71, 729-738.
Gulyas, B. J. & Yuan, L. C. (1985). Cortical reaction and zona hardening in mouse oocytes following exposure to ethanol. J Exp Zool 233, 269-276.
Hong, C., Chiang, B., Huang, J. & Wu, P. (1985). Two plasminogen activators, streptokinase and urokinase, stimulate human sperm motility. Andrologia 17, 317-320.
Hunter, R. H. (2011). Components of oviduct physiology in eutherian mammals. Biol Rev Camb Philos Soc 87, 244-255.
Hunter, R. H., Coy, P., Gadea, J. & Rath, D. (2011). Considerations of viscosity in the preliminaries to mammalian fertilisation. J Assist Reprod Genet 28, 191-197.
Kattera, S. & Chen, C. (2004). Developmental potential of human pronuclear zygotes in relation to their pronuclear orientation. Hum Reprod 19, 294-9.
Kirkman-Brown, J. C. & Smith, D. J. (2011). Sperm motility: is viscosity fundamental to progress? Mol Hum Reprod 17, 539-544.
Kolbe, T. & Holtz, W. (2005). Differences in proteinase digestibility of the zona pellucida of in vivo and in vitro derived porcine oocytes and embryos. Theriogenology 63, 1695-1705.
Lazzari, G., Colleoni, S., Lagutina, I., Crotti, G., Turini, P., Tessaro, I., Brunetti, D., Duchi, R. & Galli, C. (2010). Short-term and long-term effects of embryo culture in the surrogate sheep oviduct versus in vitro culture for different domestic species. Theriogenology 73, 748-757.
Lee, K. F. & Yeung, W. S. (2006). Gamete/ embryo - oviduct interactions: implications on in vitro culture. Hum.Fertil. 9, 137-143.
Leese, H., Hugentobler, S., Gray, S., Morris, D., Sturmey, R., Whitear, S. & Sreenan, J. (2008). Female reproductive tract fluids: composition, mechanism of formation and potential role in the developmental origins of health and disease. Reprod Fertil Dev 20, 1-8.
Lefievre, L., Conner, S. J., Salpekar, A., Olufowobi, O., Ashton, P., Pavlovic, B., Lenton, W., Afnan, M., Brewis, I. A., Monk, M., Hughes, D. C. & Barratt, C. L. (2004). Four zona pellucida glycoproteins are expressed in the human. Hum Reprod 19, 15 8 0 -15 8 6 .
Liu, Y. X. (2004). Plasminogen activator/ plasminogen activator inhibitors in ovarian
physiology. Front Bios 9, 3356-3373.
Lloyd, R. E., Romar, R., Matas, C., Gutierrez- Adan, A., Holt, W. V. & Coy, P. (2009). Effects of oviductal fluid on the development, quality and gene expression of porcine blastocyst produced in vitro. Reproduction 137, 679-687.
Mansour, S. L., Thomas, K. R. & Capecchi, M. R. (1988). Disruption of the proto- oncogene int-2 in mouse embryo-derived stem cells: a general strategy for targeting mutations to non-selectable genes. Nature 336, 348-352.
Maccauley, T. C., Buhi, W. C., Wu, G. M., Mao, J., Caamano, J. N., Didion, B. A. & Day, B. N. (2003). Oviduct-specific glycoprotein modulates sperm-zona binding and improves efficiency of porcine fertilization in vitro. Biol Reprod 69, 828-834.
Menino, A. J., Hogan, A., Schultz, G., Novak, S., Dixon, W. & Foxcroft, G. (1997). Expression of proteinases and proteinase inhibitors during embryo-uterine contact in the pig. Dev Genet 21, 68-74.
Mondéjar, I., Grullón, L. A., García-Vázquez, F. A., Romar, R. & Coy, P. (2011). Fertilization outcome could be regulated by binding of oviductal plasminogen to oocytes and by releasing of plasminogen activators during interplay between gametes. Fertil Steril 2011 Dec 16. [Epub ahead of print]. PMID:22177313
O’day-Bowman, M. B., Mavrogianis, P. A., Reuter, L. M., Johnson, D. E., Fazleabas, A. T. & Verhage, H. G. (1996). Association of oviduct-specific glycoproteins with human and baboon (Papio anubis) ovarian oocytes and enhancement of human sperm binding to human hemizonae following in vitro incubation. Biol Reprod 54, 60-69.
Palmer, E., Bézard, J., Magistrini, M. & Duchamp, G. (1991). In vitro fertilization in the horse. A retrospective study. J Reprod Fertil Suppl 44, 375-384.
Romar, R., Coy, P., Ruiz, S., Gadea, J. & Rath, D. (2003). Effects of oviductal and cumulus cells on in vitro fertilization and embryo development of porcine oocytes fertilized with epididymal spermatozoa. Theriogenology 59, 975-986.
Sendai, Y., Abe, H., Kikuchi, M., Satoh, T. & Hoshi, H. (1994). Purification and molecular cloning of bovine oviduct- specific glycoprotein. Biol.Reprod. 50, 927- 934.
Sendai, Y., Komiya, H., Suzuki, K., Onuma, T., Kikuchi, M., Hoshi, H. & Araki, Y. (1995). Molecular cloning and characterization of a mouse oviduct-specific glycoprotein. Biol. Reprod. 53, 285-294.
Smokovitis, A., Kokolis, N., Alexopoulos, C., Alexaki, E. & Eleftheriou, E. (1987). Plasminogen activator activity, plasminogen activator inhibition and plasmin inhibition in spermatozoa and seminal plasma of man and various animal species, Effect of plasmin on sperm motility. Fibrinolysis 1, 253-257.
Suarez, S. S. (2007). Interactions of spermatozoa with the female reproductive tract: inspiration for assisted reproduction. Repro Fert Dev 19, 103-110.
Suzuki, K., Sendai, Y., Onuma, T., Hoshi, H., Hiroi, M. & Araki, Y. (1995). Molecular characterization of a hamster oviduct- specific glycoprotein. Biol Reprod 53, 345- 354.
Tone, A., Begley, H., Sharma, M., Murphy, J., Rosen, B., Brown, T. & Shaw, P. (2008). Gene expression profiles of luteal phase fallopian tube epithelium from BRCA mutation carriers resemble high-grade serous carcinoma. Clin Cancer Res 14, 4067-4078.
Way, A. L., Griel, L. C. & Killian, G. J. (2000). Effects of accessory sex gland fluid on viability, capacitation, and the acrosome reaction of cauda epididymal bull spermatozoa. J Androl 21, 213-219.
Xella, S., Marsella, T., Tagliasacchi, D., Giulini, S., La Marca, A., Tirelli, A. & Volpe, A. (2010). Embryo quality and implantation rate in two different culture media: ISM1 versus Universal IVF Medium. Fertil Steril 93, 1859-1863.