PAPEL DE LOS FACTORES SOLUBLES EN FOLICULOGÉNESIS
Paloma Sánchez-Aparicio1, Sierra Muñoz-García2, Jorge Cuadros1
1Clínica de Medicina de la Reproducción y Ginecología, FivMadrid, Madrid, Spain
2Unidad de Genómica, Parque Científico, Universidad Autónoma, Madrid, Spain
aparicio@fivmadrid.es
Resumen: La foliculogénesis es el proceso de crecimiento y maduración folicular que culmina con la ovulación. Este proceso está sujeto a complejos mecanismos de regulación endocrina, autocrina y paracrina que conjuntamente garantizan la formación de oocitos maduros. En este contexto, los factores solubles desempeñan un papel clave actuando de forma coordinada con los mecanismos de comunicación e interacción celular. En este trabajo llevamos a cabo una revisión exhaustiva de aquellos mediadores solubles que están involucrados en el proceso de la foliculogénesis.
Palabras Clave: hormonas, factores de crecimiento, citoquinas, foliculogénesis
THE ROLE PLAYED BY SOLUBLE FACTORS IN FOLLICULOGENESIS
Summary: The folliculogenesis is the process of follicular development and maturation which leads to ovulation. This process is subject to complex mechanisms of endocrin, autocrin and paracrin regulation which all together ensure the formation of mature oocytes. In this context, soluble factors play a key role, operating in a coordinated fashion with the mechanisms of cell communication and interaction. In this work we review in detail those soluble factors involved in the process of folliculogenesis.
Key Words: hormones, growth factors, cytokines, folliculogenesis
REGULACIÓN ENDOCRINA, AUTOCRINA Y PARACRINA DEL OVARIO
Los ovarios, son los órganos portadores de la línea germinal y se caracterizan por la sencillez de su arquitectura tisular pese a su complejidad funcional; están constituidos por un estroma medular central y una región cortical periférica en la que se disponen los folículos ováricos.
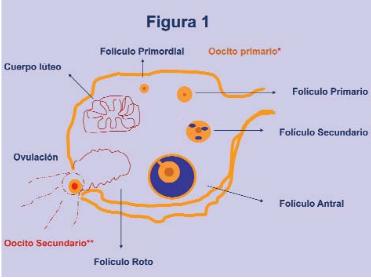
Los folículos ováricos están en continuo cambio durante la vida reproductiva de la mujer y evolucionan desde el estadio de folículo primordial hasta el de folículo maduro. Los folículos primordiales quedan constituidos en el periodo prenatal y están formados por una célula germinal rodeada de una capa de células somáticas planas.
Por tanto, a nivel celular, el ovario está formado por células germinales y por células somáticas de funcionalidad diversa que incluyen células epiteliales y células estromales.
Estas últimas se clasifican en células de tejido conectivo y células productoras de hormonas. Todas ellas establecen procesos de interacción y adhesión celular con otras células vecinas y/o con los componentes de la matriz extracelular (MEC).
La MEC forma un entramado de proteínas, secretado por las propias células del entorno, que se disponen entre las células del folículo y forman parte de la lámina basal. Además, algunas proteínas de MEC se encuentran en suspensión en el líquido folicular.
Todo ello da lugar a un soporte celular adecuado que garantiza una arquitectura tisular óptima para el desarrollo de gametos femeninos funcionales.
Aunque la función principal del ovario es la producción de oocitos maduros, desempeña además, una función endocrina adicional mediante la producción de hormonas esteroideas que, a su vez, juegan un papel esencial en la generación de oocitos por parte del propio ovario (revisado en Oktem and Oktay, 2008).
La actividad del ovario es cíclica y está bajo el control del eje hipotálamohipofisario. Por tanto, la función del ovario está sujeta a regulación endocrina, a través de dos hormonas hipofisarias: la FSH (hormona folículo estimulante) y la LH (hormona luteinizante). Estas dos hormonas están directamente implicadas en el crecimiento y la diferenciación folicular y su papel estimulador sobre el ovario garantiza la producción de hormonas esteroideas (progesterona, estradiol) que, a su vez, ejercen un efecto feedback sobre la hipófisis (revisado en Palermo, 2007).
Durante las etapas iniciales de un ciclo ovárico, la producción de hormonas esteroideas está disminuida, haciendo posible la liberación de FSH. Esta hormona estimula el crecimiento folicular, y la presencia adicional de la hormona LH hace posible la producción de hormonas esteroideas por parte de dichos folículos. Cuando el nivel de la hormona esteroidea estradiol se ve aumentado, se produce un efecto feedback negativo sobre la producción de gonadotropinas hipofisarias. Sin embargo, cuando se llega a alcanzar un nivel crítico de estradiol, este efecto feedback negativo cesa. Comienza entonces un efecto feedback positivo, que permite alcanzar un pico máximo de concentración de la hormona LH. Esta elevación de LH es la inductora final de la ovulación.
Además de la regulación endocrina descrita, el ovario dispone de sistemas de regulación locales; algunas células especializadas producen factores que participan en el control de células vecinas de la misma gónada (regulación paracrina), al igual que las secreciones generadas por otras células permiten la autorregulación (regulación autocrina). Estos factores intra-ovario son capaces de modular, amplificando o atenuando, la acción hormonal sobre el propio ovario.
Aunque la regulación funcional del ovario está controlada fundamentalmente por las gonadotropinas hipofisarias, los elementos paracrinos y autocrinos participan en el complejo entramado de factores que hacen posible el desempeño de la función ovárica.
FOLICULOGÉNESIS
La foliculogénesis es el proceso de crecimiento y maduración folicular que culmina con la ovulación y permite la formación de oocitos maduros. Este proceso garantiza la producción de células especializadas de forma única para transmitir el genoma a generaciones sucesivas. Por tanto, la meiosis constituye un mecanismo obligado que garantiza la constitución de gametos haploides a partir de células germinales diploides.
Durante el desarrollo embrionario, los folículos primordiales quedan constituidos, iniciándose este proceso hacia la semana 16 de la vida fetal, y finalizando antes de terminar la gestación. Estos folículos están formados por un oocito detenido en la profase de la primera división meiótica, rodeado por una capa única de células planas de la granulosa y una membrana basal que aísla el conjunto del tejido adyacente.
Estudios llevados a cabo con animales experimentales demuestran la implicación de un factor clave e imprescindible en el proceso de constitución de los folículos primordiales. Se trata del factor de transcripción específico de oocitos FIG (factor de la línea germinal) (Soyal et al., 2000). Este factor determina el perfil de expresión génica propia del ovocito y controla la regulación transcripcional de aquellos genes implicados en la iniciación del desarrollo folicular, así como otros relacionados con la formación de la zona pelúcida (Dean, 2002).
Por tanto, al nacer, el ovario dispone de una población finita de folículos primordiales que permanecen en estado quiescente durante un periodo de tiempo extenso. Una vez alcanzada la edad reproductiva, un número determinado de folículos primordiales reciben la señalización adecuada que les hace abandonar su estado de reposo y entrar en fase de crecimiento y diferenciación celular. El destino de la mayor parte de los folículos reclutados en este proceso es la apoptosis, y sólo unos pocos llegan a competir por ser el folículo dominante. El tiempo estimado hasta alcanzar la ovulación a partir de un folículo primordial es aproximadamente de 90 días.
Durante el desarrollo folicular, los folículos primordiales evolucionan y dan lugar a los folículos primarios. Estos últimos están constituidos por un oocito que permanece detenido en la profase de la primera división meiótica, y está rodeado por una capa de células de la granulosa que han cambiado su morfología y presentan ya un aspecto cúbico (Fortune et al., 2000).
En esta fase se establecen uniones intercelulares tipo gap junctions entre las células de la granulosa y entre estas últimas y el oocito. Estas uniones establecen una comunicación citoplasmática directa entre células adyacentes que permite el intercambio de nutrientes, metabolitos y pequeñas moléculas mediadoras. La señalización resulta ser bidireccional, de forma que las células de la granulosa producen sustancias que mantienen el oocito detenido en meiosis y, simultáneamente, el oocito libera factores que controlan el crecimiento y la diferenciación de las células de la granulosa circundantes (Gershon et al., 2008).
A continuación, las células de la granulosa entran en mitosis sucesivas y van disponiéndose en capas concéntricas que están separadas del resto de las células estromales por la lámina basal. Cuando el número de capas concéntricas es superior a tres, las células estromales circundantes se diferencian y reciben el nombre de teca interna. A su vez, las más alejadas, en contacto directo con la lámina basal, se llaman teca externa. El folículo recibe, entonces, la denominación de folículo secundario.
El proceso de crecimiento folicular descrito hasta ahora es independiente de la estimulación de las gonadotropinas hipofisarias. Por tanto, estas etapas iniciales no están sujetas a regulación endocrina. Este patrón de crecimiento cambia cuando las células de la granulosa de algunos folículos empiezan a expresar receptores de membrana para la hormona FSH. De este modo, una cohorte de folículos responde a la estimulación inducida por esta hormona. Este momento se asocia a un incremento de los niveles de FSH subsiguientes a la disminución de la producción de hormonas esteroideas por parte del ovario.
En su evolución, el oocito aumenta de tamaño y se rodea de la zona pelúcida, las células de la granulosa continúan proliferando y aumentando el número de capas, y la teca sigue organizándose a partir de las células estromales.
Las células de la granulosa expresan ya un número considerable de receptores para la hormona FSH. La proliferación celular pasa a ser dependiente de FSH, y esta hormona se convierte en la responsable de la producción creciente de estrógenos por parte de las células de la granulosa. A su vez, la FSH actúa de forma sinergística con los estrógenos, promoviendo un aumento del número de receptores de la FSH y estimulando la proliferación celular.
Sin embargo, es la presencia precoz de estrógenos en el entorno folicular lo que hace posible que los folículos sean capaces de responder a cantidades reducidas de FSH. Este mecanismo justificaría la acción autocrina de los estrógenos en el ovario. Además, aunque sólo algunas células expresen en su membrana receptores para FSH, la cascada de señalización activada puede propagarse a otras células adyacentes, vía los canales intercelulares de las gap junctions, haciendo posible la sincronización del comportamiento celular dentro del folículo.
Simultáneamente al cambio experimentado por las células de la granulosa foliculares, las células del estroma ovárico continúan con su proceso de diferenciación y organización. Las células situadas alrededor de la membrana folicular, envolviendo las células de la granulosa, generarán la teca interna, y la capa de células más alejadas, con incipiente vascularización, generarán la teca externa. Cuando las células de la capa interna de la teca se especializan definitivamente se habla de folículos preantrales.
Además, en los folículos preantrales, como consecuencia de la acción sinergística FSH/estrógenos, se produce la acumulación de líquido folicular en los espacios intercelulares de la granulosa. El líquido folicular termina por acumularse en un espacio único denominado antrum, que divide las células de la granulosa en dos poblaciones distintas, espacial y funcionalmente. Las células más próximas al oocito se denominan células del cúmulo y aquellas que se encuentran delimitando la pared del antrum se llaman células de la granulosa murales. El líquido folicular acumulado permite la perfecta nutrición del oocito y las células del cúmulo. Una vez que la cavidad del antrum ha quedado completamente definida, se habla de folículos antrales. Estos últimos continúan su evolución aumentando de tamaño y recibiendo nutrientes y suplementos a través de los capilares sanguíneos que irrigan la teca.
Finalmente, un único folículo alcanza el estadio de madurez y la superficie del ovario, teniendo lugar la ovulación. Este proceso está mediado por los niveles elevados de la hormona LH, que conduce a la finalización de la primera división meiótica del oocito y a la liberación del primer corpúsculo polar, y al inicio inmediato de la segunda división meiótica. Sin embargo, la finalización de la segunda división meiótica y la expulsión del segundo corpúsculo polar sólo tendrá lugar si existe fecundación del oocito por un espermatozoide. Los restos foliculares tras la ovulación sufrirán ciertas modificaciones inducidas por la LH, dando lugar a la formación del cuerpo lúteo.
FACTORES SOLUBLES
Los factores solubles son elementos bioactivos, de pequeño tamaño y naturaleza proteica, que ejercen su acción biológica a través de receptores de membrana expresados en las células diana. Estos factores son sintetizados por diferentes tipos celulares y actúan como comunicadores químicos entre células y tejidos.
Estos factores son pleiotrópicos y desempeñan un papel relevante en el crecimiento, la diferenciación y la supervivencia celular. El grupo de factores solubles incluye, entre otros, las citoquinas, los factores de crecimiento y las hormonas.
Las citoquinas constituyen una familia de glicoproteínas hidrosolubles, muy diversas en origen y función, que desempeñan un papel clave en la comunicación celular. Esta familia engloba las linfoquinas, las interleuquinas y las chemoquinas. Cada citoquina se une a su receptor de membrana, activando una cascada de señalización intracelular que alcanza el núcleo y termina por activar o silenciar la expresión de determinados genes. Se caracterizan por su considerable redundancia, pudiendo actuar sobre la propia célula que las secreta (acción autocrina), sobre las células vecinas (acción paracrina), o sobre células de regiones dístales que alcanzan vía plasmática (acción endocrina).
Los factores de crecimiento son péptidos secretados por distintos tipos celulares, que ejercen su función biológica como señalizadores extracelulares, estimulando la proliferación de sus células diana. Dichas células deben expresar el receptor específico para poder responder a determinado factor de crecimiento que ejerce su función de forma autocrina o paracrina.
Las hormonas son sustancias que desarrollan su acción biológica en un número considerable de procesos que incluyen la reproducción y la diferenciación sexual. Una sola hormona puede desarrollar varias funciones, y cada función puede ser controlada por varias hormonas. La acción de las hormonas siempre tiene lugar a través de receptores específicos expresados en las células diana, y su efecto varía según su patrón de expresión y concentración.
La naturaleza de las hormonas es variable dependiendo de su origen, pudiendo derivar de amino ácidos, colesterol o fosfolípidos. Las más abundantes son las hormonas proteicas como la FSH, la LH y la TSH, seguidas de las derivadas del colesterol como las hormonas esteroideas, producidas por la corteza adrenal y las gónadas.
Las hormonas de naturaleza proteica dependen de la expresión génica inmediata, mientras que las derivadas del colesterol requieren más bien de la presencia de enzimas específicas capaces de convertir el colesterol en el esteroide apropiado. Esta últimas son menos solubles en agua que las primeras, de forma que circulan unidas a una proteína transportadora tipo albúmina o globulina plasmática.
El tercer grupo de hormonas son aquellas derivadas de la tyrosina o el tryptófano; una simple molécula de tyrosina produce catecolaminas, epinefrina y norepinefrina.
FACTORES SOLUBLES IMPLICADOS EN LA FOLICULOGÉNESIS
Las etapas iniciales del proceso de la foliculogénesis son independientes de la estimulación de las gonadotropinas hipofisarias y, sin embargo, dependen de los factores autocrinos y paracrinos producidos localmente dentro del ovario o incluso en el propio folículo. La bidireccionalidad de la señalización oocito-células somáticas circundantes resulta esencial para la funcionalidad de ambos tipos celulares.
Durante la etapa reproductiva, los folículos primordiales reciben la estimulación adecuada y abandonan su estado de quiescencia. Las células de la granulosa adquieren morfología cuboidal y se habla de folículos primarios. A continuación, entran en intensa actividad mitótica y se van disponiendo en capas concéntricas alrededor del oocito. Se habla entonces de folículos secundarios.
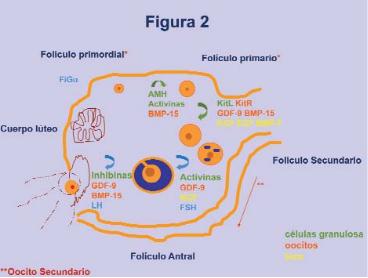
Aunque los mecanismos precisos que inician el proceso de desarrollo y diferenciación de los folículos primordiales no se han establecido con exactitud, hasta la fecha se ha descrito la implicación de tres factores intraovario:
Hormona anti-mülleriana (AMH). Sustancia producida por las células de la granulosa, con un papel esencial en el desarrollo folicular inicial. El nivel sérico de AMH se correlaciona con el número de folículos en el ovario, y algunos autores han sugerido la utilidad de la AMH como marcador de la reserva ovárica en casos de subfertilidad asociada a edad avanzada (Broekmans et al., 2008).
Activinas. Péptidos sintetizados por las células de la granulosa, de los que se conocen tres formas. Las activinas están formadas por dos cadenas idénticas a la unidad de las inhibinas, cuya actividad es inversa a las activinas.
BMP-15 (bone morphogenetic protein 15). Proteína que pertenece a la superfamilia de factores de crecimiento del TGF Expresada por los oocitos de los folículos primordiales, actúa sobre las células de la granulosa promoviendo su actividad mitótica. Su expresión se mantiene en el oocito hasta el momento de la ovulación.
Asimismo, se han reportado otros factores sintetizados por el propio oocito, que actuarían como potentes reguladores de la proliferación y la diferenciación de las células de la granulosa. Entre ellos:
GDF-9 (growth differentiation factor 9). Factor de crecimiento que pertenece a superfamilia del TGF. Es de naturaleza proteica y es secretada por el propio oocito, y actúa sobre las células de la granulosa alterando su expresión génica, estimulando su actividad mitótica, su proliferación y diferenciación. Determina el número de folículos destinados a desarrollarse y participa en la formación de gap junctions de Cx43, que permiten la comunicación citoplasmática directa entre las células de la granulosa adyacentes. Parece que desempeña un papel clave en la evolución del folículo primario a secundario, dado que en el ratón knockout para GDF-9 el desarrollo folicular se paraliza antes de alcanzar el estadio de folículos preantrales. Otros autores han descrito que el gradiente de GDF-9, sintetizado desde el oocito, sería responsable de la estratificación de las células de la granulosa en el cúmulo de los folículos preantrales, promoviendo, a su vez, la formación y la integridad del complejo cúmulo-oocito induciendo – hyaluronan syntasa 2, pentraxin 3, TNF- e inhibiendo el activador de plasminógeno urokinasa.
BMP-6 (bone morphogenetic proteins 6). Secretado por el oocito, su papel es importante pero no imprescindible según demuestra el análisis del knockout de este factor.
Otros elementos implicados en la formación de los folículos secundarios son los procesos mediados por la interacción kit-kit ligand (Driancourt et al., 2000; Hutt et al., 2006; Thomas and Vanderhyden, 2006) así como Kit ligand a través de la interacción con GDF9 y BMP15.
El receptor de c-kit se expresa en la superficie de los oocitos mientras que kit ligand se expresa en la membrana de las células de la granulosa. En este estadio también desempeñan un papel relevante otros factores secretados por las células de la teca como KGF (keratinocyte growth factor), EGF (Epidermal growth factor) y BMP-7 (bone morphogenetic proteins 7).
Es importante recordar que en la transición de folículos preantrales a antrales es cuando el oocito adquiere la capacidad de reanudar el proceso de meiosis, hasta ese momento detenido en profase de la primera división meiótica, e incorporar, a su vez, modificaciones epigenéticas esenciales.
Tanto en el caso de folículos preantrales, como en el de folículos antrales, las células de la granulosa expresan ya receptores para la hormona hipofisaria FSH, siendo a partir del estadio de folículo antral cuando las células de la granulosa expresan en su membrana receptores para la LH. La expresión de estos receptores hace posible el efecto de la hormona LH sobre estas células, induciendo cambios esenciales en la expresión génica preovulatoria e indirectamente promoviendo la finalización de la primera división meiótica y la ovulación de un oocito maduro que ha iniciado ya la segunda división meiótica.
En definitiva, el desarrollo hasta folículos preantrales depende exclusivamente de la acción de factores intra-foliculares de crecimiento y diferenciación y, a partir de esta etapa, el desarrollo folicular pasa a ser dependiente de las gonadotropinas hipofisarias. A medida que el desarrollo folicular avanza, la acción de la hormona FSH vía receptores de membrana va adquiriendo una importancia creciente, siendo responsable de la proliferación de las células de la granulosa y de la producción de la hormona esteroidea estradiol. Actuaría pues como potente factor de crecimiento y diferenciación para los folículos pre-antrales y como factor de supervivencia para los folículos antrales.
Sin embargo, pese a la influencia prioritaria de las gonadotropinas en estas etapas del desarrollo, durante el estadio preantral también se han descrito factores intra-ovario de especial relevancia. Es el caso de las activinas, que actuarían como factor de crecimiento en el estadio de folículo preantral estimulando la liberación de FSH así como su acción en el ovario.
Durante la fase lútea temprana de un ciclo ovárico existen folículos preantrales procedentes de ciclos previos que se convierten en folículos antrales. En un ciclo posterior, aquellos folículos no degenerados alcanzan la fase de selección y optan al reclutamiento folicular; una cohorte de folículos avanza en su desarrollo, aunque sólo uno de ellos será finalmente seleccionado para alcanzar la madurez.
Los mecanismos responsables de la selección del folículo dominante vienen determinados por el número de receptores de FSH, la concentración de hormonas esteroideas y la presencia de factores de crecimiento específicos.
Durante las etapas más avanzadas del desarrollo folicular, el número de receptores de la LH se ve muy incrementado en las células de la teca y aparece de novo en las células de la granulosa. Las inhibinas, a su vez, potencian el efecto de la hormona LH sobre las células de la teca y promueven además la síntesis de andrógenos.
En la última etapa del desarrollo folicular, el folículo dominante llega a alcanzar un tamaño de 20 mm, siendo creciente su producción de estradiol. Más aún, se produce la diferenciación final de las células de la teca y la expansión del cúmulo por acción de los factores GDF-9 y BMP-15, producidos por el oocito.
Por último, se produce la ovulación, después de la culminación de la primera división meiótica, en la que desempeña un papel relevante el factor BMP-15 que promueve la separación de los cromosomas homólogos con la extrusión del primer corpúsculo polar, y del inicio de la segunda división meiótica. El folículo residual dará lugar al cuerpo lúteo con la participación de la LH.
CONCLUSIONES
La foliculogénesis es un proceso de una extraordinaria complejidad, que está sujeto a una estricta regulación en la que están implicados factores extraovario e intra-ovario, siendo su contribución relativa, variable y dependiente del estadio del desarrollo folicular. A su vez, las rutas reguladoras de estos factores concurren y se imbrican en los procesos directamente relacionados con los mecanismos de comunicación e interacción celular.
Referencias
.- Broekmans FJ, Visser JA, Laven JS, Broer SL, Themmen AP, Fauser BC. Anti-Müllerian hormone and ovarian dysfunction. Trends Endocrinol Metab 2008 ; 19 :340-347.
.- Dean J. Oocyte-specific genes regulate follicle formation, fertility and early mouse development. J Reprod Immunol 2002 ; 53: 171-180.
.- Driancourt MA, Reynaud K, Cortvrindt R, Smitz J. Roles of KIT and KIT LIGAND in ovarian function. Reproduction 2000; 5:143-152.
.- Fortune JE, Cishman RA, Kito WS. The primordial to primary follicle transition. Mol Cell Endocrinol 2000; 163: 53-60.
.- Gershon E, Plaks V, Dekel N. Gap junctions in the ovary: expression, localization, and funciton. Mol Cell Endocrinol 2008 ; 282:18-25.
.- Hutt KJ, Mc Laughlin EA, Holland MK. Kit/Kit ligand in mammalian oogenesis and folliculogenesis: roles in rabbit and murine ovarian follicule activation and oocyte growth. Biol Reprod 2006; 75:421-433.
.- Oktem O, Oktay K. The ovary: anatomy and function throughout human life. Ann N Y Acad Sci 2008 ; 1127:1-9.
.- Palermo R. Differential actions of FSH and LH during folliculogenesis. Reprod Biomed Online 2007 ; 15:326-337.
.- Soyal SM, Amleh A, Dean J. FIGalpha, a germ cell-specific transcription factor required for ovarian follicle formation. Development 2000 ; 127:4645-4654.
.- Thomas FH, Vanderhyden BC. Oocytegranulosa cell interactions during mouse follicular development: regulation of kit ligand expression and its role in oocyte growth. Reprod Biol Endocrinol 2006; 12:19.


 l
l