PATRÓN DE MOVILIZACIÓN DEL [Ca2+]i , APOPTOSIS Y PAPEL DE LA ACTINA EN PACIENTES ASTENOZOOSPÉRMICOS
Graciela M. Lozano, Águeda Ortiz, Fabián Monllor, Ma Isabel Jiménez, Juan Francisco García.
Hospital Materno Infantil. Centro Extremeño de Reproducción Humana Asistida (C.E.R.H.A). C/ Violeta SN. 06010. Badajoz
e-mail: laoliventina@hotmail.com
Fecha recepción: 30 Marzo 2012
Fecha aceptación: 12 Abril 2012
La astenozoospermia se caracteriza por la disminución o ausencia total de movilidad espermática y es una de las alteraciones más comunes en los pacientes estériles. La señalización de calcio intracelular es una importante llave reguladora de muchos procesos celulares, entre ellos el movimiento espermático.
El objetivo de este trabajo es analizar el papel del calcio en las muestras de pacientes astenozoospérmicos estimulando la señal de calcio intracelular con progesterona. Rev Asoc Est Biol Rep 2012; 17(1):17-25
INTRODUCCIÓN
Está bien establecido que la señalización del [Ca2+]i juega un papel importante en la fisiología del espermatozoide humano, estando íntimamente relacionado con muchos aspectos funcionales de los mismos (Félix, 2005; Jiménez-González et al.,2006), tales como el control de la movilidad, incluyendo hiperactivación y quimiotaxis, donde la señalización del [Ca2+]i es imprescindible para producir el movimiento del flagelo.
De hecho, una movilidad anormal podría estar relacionada con niveles bajos en la concentración de [Ca2+]i (Luconi, 2003), debido a alteraciones en la entrada capacitativa de calcio (ECC) a través de canales específicos pudiendo influir también en la reacción acrosómica (RA) de los espermatozoides (Rossato, 2001).
El aumento citosólico de calcio se puede favorecer con dosis micromolares de progesterona (Kirkman-Browm et al., 2002; Bedu-Addo et al., 2007) probablemente provocadas por la interacción de la progesterona con receptores de superficie presentes en los espermatozoides (Blackmore et al., 1994).
Esta habilidad de la progesterona para producir un aumento del [Ca2+]i en espermatozoides humanos ha sido directamente correlacionada con éxitos de fecundación in vitro (Krausz et al., 1996; Publicover et al., 2008).
La progesterona está presente en altas concentraciones en el líquido folicular y es sintetizada antes y después de la ovulación por células del cúmulo oóforo del ovocito. Aunque la capacidad de la progesterona para inducir la RA está bien establecida, parece ser que el aumento de[Ca2+]i que produce está relacionado con la regulación de la actividad flagelar y de la quimiotaxis (Ulher et al., 1992), resultando ser un potente quimioatrayente para el espermatozoide humano, pudiendo actuar sus receptores como receptores quimiotácticos (Eisenbach et al., 2006). Al mismo tiempo, aumentos en la señalización y concentración de [Ca2+]i pueden revelarse como señales apoptóticas que induzcan a la célula a una muerte programada. El equilibrio entre el aumento de la concentración de [Ca2+]i y la capacidad de la célula para responder a estos estímulos escrucialparalasupervivenciacelular.
La astenozoospermia es una causa común de esterilidad masculina caracterizada por una reducción o ausencia total de movilidad espermática. Alteraciones de los factores que regulan la movilidad espermática y su estructura celular y metabólica son los responsables de este defecto, de hecho, en los últimos años, se ha comprobado que en pacientes con astenozoospermia, hay una reducción de los receptores de progesterona (Gadkar et al., 2002), así como una relación entre la infertilidad masculina y la incapacidad de esos espermatozoides para responder a progesterona in vitro (Krausz et al., 1995).
MATERIALES Y MÉTODOS
Progesterona, albúmina bovina (BSA), medio de lavado RPMI-1640, dimetil BAPTA, RU-38486, etilenglicol-bis(2-aminoetileter)-N,N,N’,N’-acido tetraacético (EGTA) (Sigma, Madrid, España).
Fura-2 acetoximetil ester (fura-2/AM) y thapsigargina (Invitrogen, Barcelona, España).
citocalasina D y jasplakinolide (Calbiochem, Darmstadt, Alemania).
Receptor Anti-progesterona (PRc262) y anticuerpo monoclonal de ratón (RU -38486) (Santa Cruz Biotechnology, Alemania).
Sustrato de caspasa-3 (AC-DEVD-AMC) (Sigma, Madrid, España).
Las determinaciones de apoptosis se realizaron mediante el ensayo TUNEL (Terminal dUTP Nick-End Labeling ) (Boehringer Mannheim (Indianapolis, IN, USA).
PREPARACIÓN DEL SEMEN
Las muestras de semen se obtuvieron de 37 varones normozoospérmicos y 33 astenozoospérmicos que acudieron al Centro Extremeño de Reproducción Humana Asistida (C.E.R.H.A) en Badajoz, para estudio de esterilidad. Este trabajo fue aprobado por el comité ético del Hospital Infanta Cristina de Badajoz y por la Universidad de Extremadura de acuerdo con la declaración de Helsinki.
A cada paciente se le sometió a una completa anamnesis confirmando su buen estado de salud, no eran fumadores, ni bebían alcohol, ni estaban siguiendo ningún tratamiento médico.
Las muestras se obtuvieron por masturbación tras un periodo de abstinencia de entre 4 y 5 días y se dejaron licuar a 37oC durante 30 minutos.
Los parámetros básicos seminales que se analizaron, se realizaron de acuerdo a los criterios establecidos por la OMS (OMS, 1999). La concentración espermática y la movilidad se midieron mediante el sistema de imagen digitalizado CASA (Computer Assisted Sperm Analysis) que analiza 25 fotogramas en un campo magnificado de 100x en campo oscuro.
La normozoospermia se clasificó por una concentración espermática de ≥20 × 106 cels/ml(x±SD=62±30×106 cels/ml), una movilidad progresiva (grado a+b) ≥50% (x±SD=54.2±4.1%) y una morfología normal ≥14% ( x ± SD = 17 ± 3.6%).
El principal criterio de clasificación de muestras astenozoospérmicas fue una baja movilidad (Curi et al., 2002). La astenozoospermia se caracterizó por una concentración espermática de >20×106 cels/m l(x±SD=42±16× 106 cels/ml) y una movilidad reducida (gradoa+b) <50% (x±SD=23.3 ± 12.2%) o ausencia de movilidad, independientemente de los resultados morfológicos.
A continuación las muestras se lavaron en medio RPMI-1640 (250 g, 10 min), se retiraron los sobrenadantes y se resuspendieron en una solución de Na- HEPES que contiene (en mM): NaCl,140; KCl, 4.7; CaCl2, 1.2; MgCl2, 1.1; glucosa, 10; y HEPES, 10 (pH 7.4).
MEDIDA DE LA CONCENTRACIÓN DE CALCIO INTRACELULAR [Ca2+]i
Lascélulasseincubaroncon4μMfura-2 acetoximetil ester (Fura-2 AM) durante 30 minutos a temperatura ambiente, siguiendo protocolos publicados (Bejarano et al., 2008). Después se lavaron y se utilizaron en las siguientes 2-4 horas.
La fluorescencia se midió en suspensiones celulares (2 × 108 cels/ml) a 37°C usando un espectrofluorofotómetro Shimadzu con longitudes de onda de excitación de 340 y 380 nm y de emisión de 505 nm.
Los cambios en las concentraciones de [Ca2+]i se monitorizaron usando el ratio de fluorescencia fura-2 340/380 nm y se calibraron de acuerdo al método de Grynkiewicz (Grynkiewicz et al., 1985).
En los experimentos libres de calcio, se añadió etilenglicol-bis (2-aminoetileter)-N,N,N’,N’- acido tetraacético (EGTA) al medio.
La entrada capacitativa de calcio (ECC) así como su aumento y mantenimiento se midieron a los 2.5 minutos tras la adición de CaCl2 o progesterona + thapsigargina, respectivamente.
DETERMINACIÓN DE ACTIVIDAD CASPASA-3
Las células se incubaron con solución sustrato de caspasa-3 (AC-DEVD-AMC) unido a una sonda fluorescente durante 1 hora a 37oC. La actividad de la caspasa-3 se determinó por la fluorescencia producida al fragmentarse el sustrato con la ayuda de un espectrofluorímetro con una onda de excitación de 360 nm y emisión de 460 nm.
DETERMINACIÓN DE LA EXTERNALIZACIÓN DE FOSFATIDIL SERINA (PS)
Las células se fijaron en glutaraldehído e incubaron con Anexina-V unida a una sonda fluorescente de isotiocianato (Anexin-V-FITC). La fluorescencia se midió con ayuda de un espectrofluorímetro con una onda de excitación de 488 nm y emisión de 516 nm.
DETERMINACIÓN DE TUNEL
Las muestras sometidas a técnicas de TUNEL tras su incubación con progesterona se fijaron en paraformaldehído (PFA) al 4%. El ADN dañado se detectó por la TdT (deoxinucleotidil Transferasa Terminal) medida por dUDP aplicándose la técnica según protocolo de la casa comercial. Se revelaron con fluorescencia y los espermatozoides que presentaban su citoplasma con fluorescencia verde se contabilizaron como espermatozoides apoptóticos (TUNEL positivo).
ANÁLISIS ESTADÍSTICO
El análisis estadístico se realizó utilizando la prueba T de Student (p < 0.05 se considera estadísticamente significativo).
RESULTADOS
En ausencia de calcio extracelular, los espermatozoides se incubaron con la sonda fluorescente fura-2 y con 20 μM de progesterona.
Aunque la presencia de la ATPasa en el retículo endoplasmático (RE) del espermatozoide está sometida a debate, añadimos al cultivo 1 μM de thapsigargina, un inhibidor de la recaptación de [Ca2+]i por el RE, asegurándonos de que los depósitos celulares no se recargaban.
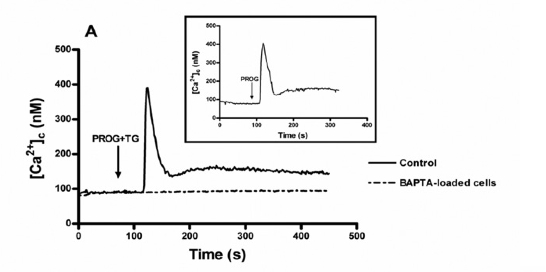
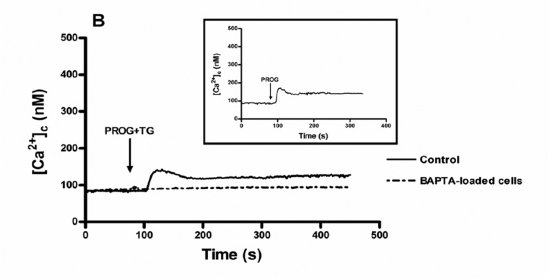
En la Figura 1 podemos ver cómo al incubar con progesterona y thapsigargina, se inducía un aumento en la concentración de [Ca2+]i que provenía de los depósitos intracelulares tanto en pacientes normozoospérmicos (Figura 1.A) como en astenozoospérmicos (Figura 1.B) aunque en esta segunda gráfica, este aumento de [Ca2+]i era menor siendo muy similar tanto si se añadía progesterona como si se añadía progesterona + thapsigargina.
Cuando se añadía Dimetil-Bapta (BAPTA), un quelante del [Ca2+]i en una concentración de 10 μM, 10 minutos a 37o C, no se producía ningún aumento del [Ca2+]i tras incubar con progesterona o con progesterona + thapsigargina.
Figura 1. Elevación de [Ca2+]i tras incubar con progesterona en un medio libre de calcio. En ambos casos, el aumento de calcio es independiente de thapsigargina y en presencia de un quelante del calcio (BAPTA), este aumento no se produce.
Figura 1.A. Aumento de [Ca2+]i en pacientes normozoospérmicos.
Figura 1.B. Aumento de [Ca2+]i en pacientes astenozoospérmicos, claramente inferior. En ambos casos, los espermatozoides cargados con fura-2 eran estimulados con 20 μM de progesterona y con progesterona + 1 μM de thapsigargina en un medio libre de calcio (+ 1mM EGTA), en ausencia (control) o en presencia de BAPTA (10 μM durante 30 minutos). Las trazas son representativas de 5 experimentos diferentes.
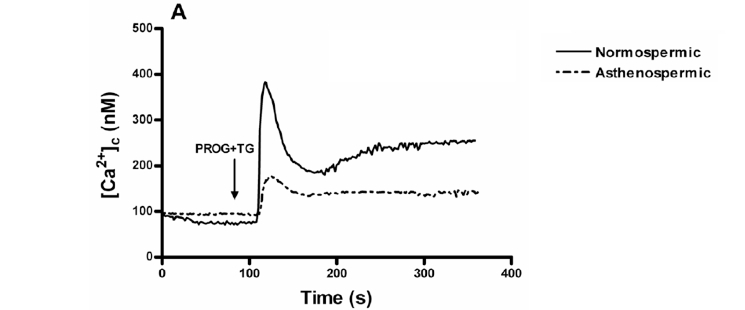
En presencia de calcio extracelular, tras incubar las células con progesterona y con progesterona + thapsigargina, también aumentaba la concentración de [Ca2+]i (Figura 2.A), siendo similar en presencia o ausencia de thapsigargina.
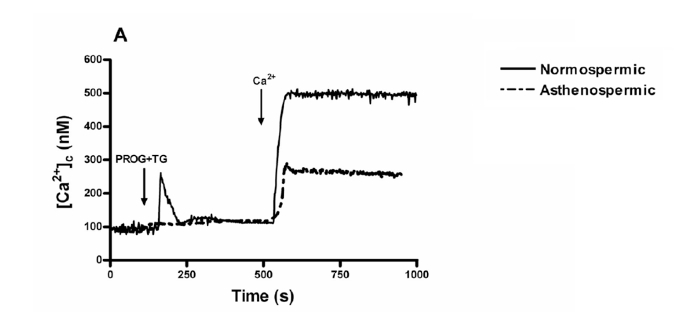
Tras añadir progesterona + thapsigargina, para inducir aumento de [Ca2+]i sin recaptación de los depósitos intracelulares, durante 6 minutos, en un medio libre de calcio, añadimos calcio al medio (300 μM de CaCl2) y se pudo comprobar como se producía una ECC en ambos grupos de pacientes, normozoospérmicos y astenozoospérmicos siendo claramente menor en este último (Figura 3.A).
Figura 2.A. Al añadir calcio al medio extracelular, también se produce un aumento de [Ca2+]i que continúa siendo menor en pacientesa stenozoospérmicos y que también sigue siendo independiente de la thapsigargina. En ambos casos, los espermatozoides cargados con fura-2 eran estimulados con 20 μM de progesterona + 1 μM de thapsigargina en un medio con calcio (1.2 mM [Ca2+]0). Las trazas son representativas de 4 experimentos.
Figura 3.A. ECC tras añadir calcio al medio extracelular era menor en pacientes astenozoospérmicos. En ambos casos, los espermatozoides cargados con fura-2 eran estimulados con 20 μM de progesterona + 1 μM de thapsigargina durante 6 minutos en un medio libre de calcio (+ 100 μM EGTA) seguido de la adición de calcio al medio con 300 μM de CaCl2 para iniciar la entrada de calcio. Las trazas son representativas de siete experimentos distintos
Analizamos el efecto de 20 μM de progesterona en la incubación de espermatozoides sobre su movilidad progresiva midiéndola con CASA tras 30 minutos de incubación. (Tabla I)
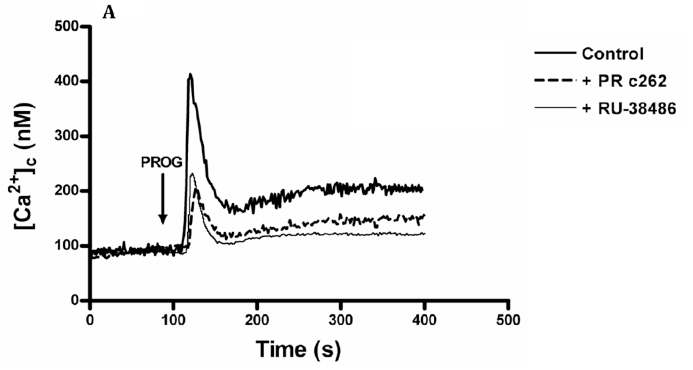
También se analizó si los receptores para la progesterona presentes en los espermatozoides de pacientes normozoospérmicos estaban implicados en la estimulación que la progesterona realiza para aumentar la [Ca2+]i. Para ello, se incubaron las muestras con receptores agonistas de la progesterona (PRc262) (100 μg/ ml 30min) y antagonistas de estos mismos receptores (RU-38486) (50 μM 30 min) y se comprobó cómo el aumento de [Ca2+]i se reducía en ambos casos, resultando un comportamiento similar al observado en pacientes astenozoospérmicos incubados con progesterona sin bloqueo de receptores (Figura 4.A).
Tabla I. La incubación con progesterona de muestras de pacientes normozoospérmicos parece mejorar su movilidad de manera significativa, mientras que las muestras correspondientes a pacientes astenozoospérmicos no ven modificado su patrón de movilidad.
Figura 4.A. Al bloquear en muestras de pacientes normozoospérmicos los receptores de progesterona, el aumento de calcio es menor y muy similar al producido en pacientes astenozoospérmicos a los que no se les ha realizado bloqueo de receptores de progesterona (ver Fig.1B). Los espermatozoides cargados con fura-2 de pacientes normozoospérmicos fueron tratados previamente con PRc262 (1:10 de concentración final 100 μg/ml durante 30 minutos) o con RU-384886 (50 μM durante 30 minutos) eran estimulados con 20 μM de progesterona en un medio con calcio (1.2 mM progesterona [Ca2+]0). Las trazas son representativas de 4 experimentos.
La citocalasina D es un potente inhibidor de la polimerización de la actina y el jasplakinolide estabiliza los filamentos de actina in vitro, pero in vivo, produce la organización de actina en masas amorfas.
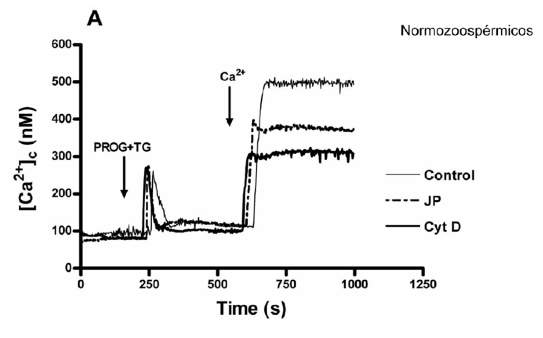
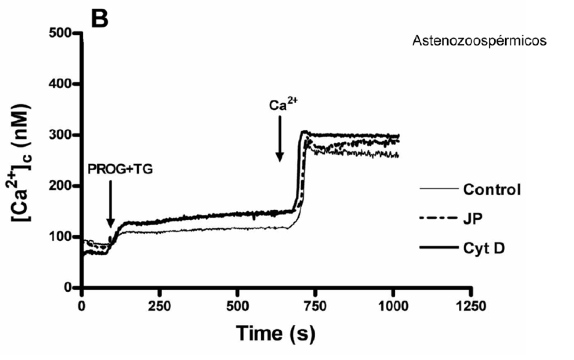
En pacientes normozoospérmicos, cuando se incubaron los espermatozoides en un medio libre de calcio con progesterona + thapsigargina, citocalasina D y jasplakinolide y tras 6 minutos de incubación se añadía calcio al medio, la ECC tuvo lugar por vaciamiento de los depósitos celulares en menor medida que sin la incubación de citocalasina D y jasplakinolide, vaciamiento que no ocurrió en pacientes astenozoospérmicos y por lo tanto no se produjo la ECC. (Figura 5.A y Figura 5.B).
Figura 5. En ambos casos, los espermatozoides cargados con fura-2 fueron tratados previamente a temperatura ambiente con 10 μM de citocalasina D durante 40 minutos o con 10 μM de Jasplakinolide durante 30 minutos. Después, eran estimuladas con 20 μM de progesterona + 1 μM de thapsigargina en un medio libre de calcio (+ 100 μM EGTA) durante 6 minutos seguido de la adición de calcio al medio con 300 μM de CaCl2 para iniciar la entrada de calcio. Las trazas son representativas de siete experimentos.
Figura 5.A. Los espermatozoides de pacientes normozoospérmicos tratados con citocalasina D y jasplakinolide, presentan una disminución en su ECC provocada por el vaciamiento de los depósitos celulares evocados por la incubación previa con progesterona.
Figura 5.B. El mismo experimento en pacientes astenozoospérmicos parece ser totalmente inefectivo deduciéndose que la incubación con citocalasina D y jasplakinolide no parece afectar a la ECC tras la estimulación con progesterona en espermatozoides de pacientes astenozoospérmicos
Se comprobó el efecto de la progesterona en pacientes normozoospérmicos y astenozoospérmicos y su efecto en la aparición de apoptosis.
Para ello, quisimos comprobar en pacientes normozoospérmicos si la incubación de las muestras con progesterona durante 1 hora a 20 μM, en las que habíamos comprobado un aumento de [Ca2+]i con menor tiempo de incubación previamente, también se podría ver modificado su patrón de muerte celular programada determinado por la inducción de actividad caspasa-3, externalización de PS y aparición de espermatozoides TUNEL positivas. (Figuras 6.A.B.C).
Tras ratificar que estas condiciones no fisiológicas de incubación con progesterona inducían apoptosis, analizamos mediante la técnica de TUNEL muestras de pacientes normozoospérmicos y astenozoospérmicos tras una hora de incubación con progesterona.
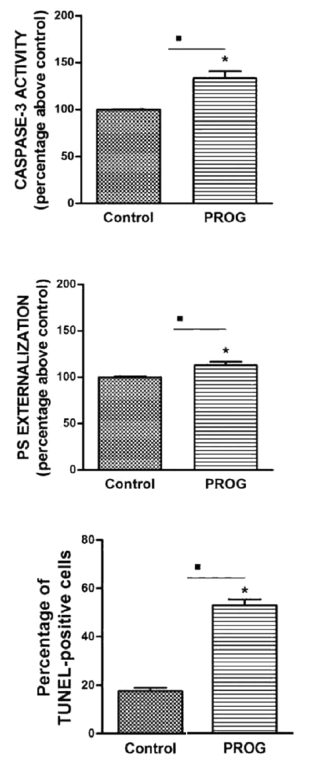
Figura 6. Patrón de apoptosis en muestras normozoospérmicas incubadas con progesterona. En todos los casos, los espermatozoides eran incubados con 20 μM de progesterona durante 1 hora. El control corresponde a la medición de actividad caspasa-3, externalización de PS y figuras TUNEL positivas en espermatozoides sin incubar previamente con progesterona.
Figura 6.A. Determinación de actividad caspasa-3 positiva. (33.5 ± 7.2% con progesterona sobre las células control). (*P<0.05).
Figura 6. B. Determinación de externalización de PS. Medida por el porcentaje de células anexina-V positivas (12.9 ± 3.7% con progesterona sobre las células control). (*P<0.05).
Figura 6. C. Determinación de apoptosis (TUNEL positivas). (52.9 ± 2.4% con progesterona sobre las células control). (*P<0.05).
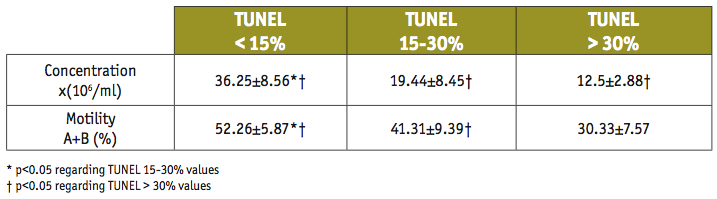
Pudimos comprobar que la proporción de espermatozoides apoptóticos medidos por la técnica de TUNEL era significativamente mayor en muestras de pacientes astenozoospérmicos. (Tabla II).
DISCUSIÓN
La progesterona es el agonista movilizador de [Ca2+]i más estudiado en los espermatozoides humanos, provocando aumentos sostenidos en el tiempo de [Ca2+]i .
Los experimentos en los que se incubaron con progesterona + thapsigargina, parecían ser idénticos a los experimentos en los que se incubaron sólo con progesterona. Al no mostrar sensibilidad a la thapsigargina, ésta parece no contribuir al relleno de calcio de los depósitos celulares al incubar con progesterona (Espino et al., 2009).
TABLA II. El mayor porcentaje de apoptosis se encuentra en muestras con peor concentración y movilidad
Por otro lado, la ECC parece estar relacionada en varios trabajos recientes con la regulación del movimiento espermático. Esta ECC se ve favorecida al añadir calcio al medio extracelular en pacientes normozoospérmicos, jugando un papel muy importante las concentraciones de calcio extracelulares en la movilidad espermática (Bedu-Addo et al., 2008).
Sin embargo, en pacientes astenozoospérmicos, la ECC es casi indetectable con o sin calcio en el medio extracelular. La incubación con progesterona no induce aumento de [Ca2+]i ni por ECC ni por vaciamiento de los depósitos celulares, comportamiento similar observado en los pacientes normozoospérmicos a los que se les había bloqueado los receptores de progesterona.
Cuando se añadía en el cultivo citocalasina D (inhibidor de la polimerización de actina) y jasplakinolide (reorganizador de los filamentos de actina en masa amorfa) (Bubb et al., 1994; Bubb et al., 2000), comprobamos que la ECC se veía afectada de forma significativa en pacientes normozoospérmicos, ECC que sin la incubación previa de citocalasina D y jasplakinolide sí se producía. Esto nos hace pensar que los movimientos y estados de los depósitos celulares son fundamentales en la homeostasis del calcio, dando importancia al citoesqueleto celular para una correcta ECC.
Del mismo modo, cuando se incubaron con progesterona en condiciones no fisiológicas, se desencadenó apoptosis en los espermatozoides cursando también aumento de [Ca2+]i. En este caso, la apoptosis intrínseca (Bejarano et al., 2009) inducida en los espermatozoides producía la externalización de PS, actividad caspasa-3 y se podía detectar mediante técnica de TUNEL (Lozano et al., 2009; Lozano et al., 2009).
A pesar de que la dosis y el tiempo de incubación eran no fisiológicos y los mismos en espermatozoides de pacientes normozoospérmicos y astenozoospérmicos, la apoptosis medida por TUNEL producida en estos últimos era significativamente mayor, no disponiendo de mecanismos para responder a la progesterona in vitro para estimular el movimiento, como observamos en la primera parte de los experimentos, ni tampoco de mecanismos de protección frente a la actividad caspasa y desencadenamiento de la apoptosis.
CONCLUSIÓN
Los espermatozoides provenientes de pacientes astenozoospérmicos disponen de una maquinaria dañada incapaz de responder a los estímulos positivos de la progesterona para movilizar sus reservas de calcio y generar movimiento, y también incapaz de protegerse en la misma medida de los daños celulares inducidos, como lo hacen las muestras normozoospérmicas
Este trabajo ha sido subvencionado por Merck Farma y Química, S.L (Merck Serono), apoyados por Salud 2000 y la Junta de Extremadura.
Referencias
Bedu-Addo K, Barrat CL, Kirkman-Brown JC, Publicover SJ. Patterns of [Ca2+]i mobilization and cell response in human spermatozoa exposed to progesterone. Dev Biol 2007; 302: 324- 332.
Bedu-Addo K, Costello S, Harper C, Machado- Oliveira G, Lefievre L, Ford C, Barrat C, Publicover S. Mobilisation of the stored calcium in the neck region of the human sperm-a mechanism for regulation of flagellar activity. Int Dev Biol 2008; 52: 615-626.
Bejarano I, Lozano GM, Ortiz A, García JF, Paredes SD, Rodriguez AB, Pariente JA. Caspase 3 activation in human spermatozoa response to Hydrogen Peroxide and Progesterone. Fertil Steril 2008; 90: 1340-1347.
Blackmore PF, Im WB, Bleasdale JE. The cell surface progesterone receptor wich simulat esinfluxin human sperm isunlike the A ring reduced steroid site on the GABAa receptor/chloride channel. Mol Cell Endocrinol 1994; 104: 237-243.
Bubb MR, Senderowicz AM, Sausville EA, Dunacan KL, Korn ED. Jasplakinolide, a cytotoxic natural product, induces actin polimerization and competitively inhibits the binding of phalloidin to F-actin. J Biol Chem 1994; 269:14869-14871.
Bubb MR, Spector I, Beyer BB, Fosen KM. Effects of Jasplakinolide on the kinetics of actin polymerization. An explanation for certain in vivo observations. J Biol Chem 2000; 275: 5163-5170.
Curi S, Ariagno J, Repetto H, Chenlo P, MendelukG,PuglieseN,SardiM,BlancoA. Laboratory methods for the diagnosis of Asthenozoospermia. Arch Androl 2002; 48: 177-180.
Eisenbach M, Giojalas LC. Sperm guidance in mammals-an unpaved road to the egg. Nat Rev Mol Cell Biol 2006; 7: 276-285.
Espino J, Mediero M, Lozano GM, Bejarano I, Ortiz A, García JF, Pariente JA, Rodriguez AB. Reduced levels of intracellular calcium releasing in spermatozoa from Asthenozoospermic patients. Reprod Biol Endocrinol 2009; 7: 11.
Felix R. Molecular physiology and phatology of [Ca2+]i -conducting channels in the plasma membrane of mammalian sperm. Reproduction 2005; 129: 251-262.
Gadkar S, Shah CA, Sachdeva G, Samant U, Puri PC. Progesterone receptor as an indicator of sperm
function. Biol Reprod 2002; 67: 1327-1336.
Grynkiewicz G, Poenie M, Tsien RY. A new generation of [Ca2+]i indicators with greatly improved fluorescence properties. J Biol Chem 1985; 260: 3440-3450.
Jimenez-González C, Michelangeli F, Harper CV, Barrat CL, Publicover SJ. Calcium signalling in human spermatozoa: A specialized “toolkit” of channels, transporters and stores. Hum Reprod Update 2006; 12: 253-267.
Kirkman-Brown JC, Punt EL, Barrat CL, Publicover SJ. Zona pellucida and progesterone-induced [Ca2+]i signalling and acrosome reaction in human spermatozoa. L Androl 2002; 23: 306-315.
Krausz C, Bonaccorsi L, Luconi M, Fuzzi B, Criscuoli L, Pellegrini S, Forti G, Baldi E. Intracellular calcium increase and acrosome reaction in response to Progesterone in human spermatozoa are correlated with in vitro fertilization. Hum Reprod 1995; 10: 122-124.
Krausz C, Bonaccorsi L, Maggio P, Luconi M, Criscuoli L, Fuzzi B, Pellegrini S, Forti G, Baldi E. Two functional assays of sperm responsiveness to progesterone and their predictive values in in-vitro fertilisation. Human Reprod 1996; 11: 661-667.
Lozano GM, Bejarano I, Espino J, Gonzalez D, Ortiz A, García JF, Rodriguez AB, Pariente JA. Relationship between Caspase activity and Apoptotic Markers in human sperm in response to Hydrogen Peroxide and Progesterone. J Reprod Dev 2009; 55:1-7.
Lozano GM, Bejarano I, Espino J, Gonzalez D, Ortíz A, García JF, Rodriguez AB, Pariente JA. Density gradient capacitation is the most suitable method to improve fertilization and to reduce DNA fragmentation positive spermatozoa of infertile men. Anatol J Obstet Gynecol 2009; 3: 1.
Luconi M, Baldi E. How do sperm swim? Molecular mechanisms underlying sperm motility. Cell Mol Biol 2003; 49: 357-369.
Publicover SJ, Giojalas LC, Teves ME, de Oliveira GS, García AA, Barrat CL, Harper CV. Ca2+ signalling in the control of motility and guidance in mammalian sperm. Front Biosci 2008; 13: 5623-5637.
Rossato M, Di Virgilio F, Rizzuto R, Galeazzi C, Foresta C. Intracellular calcium store depletion and acrosome reaction in human spermatozoa: Role of calcium and plasma membrane potential. Mol Hum Reprod 2001; 7: 119-128.
Uhler ML, Leung A, Chan SY, Wang C. Direct effects of progesterone and antiprogesterone on human sperm hyperactivated motility and acrosome reaction. Fertil Steril 1992; 58: 1191-1198.
World Health Organization: WHO laboratory manual for the examination of human semen and semen-cervical mucus interaction 4oed.New York: Cambridge University Press; 1999.