¿PODEMOS OPTIMIZAR LA CONGELACIÓN LENTA DE TEJIDO OVÁRICO HUMANO? RESULTADOS DE UN NUEVO PROTOCOLO CON 20% DE ME2SO.
Centro donde ha realizado la estancia: Department of Gynecology , Université Catholique de Louvain, Bruselas, Bélgica
Autores participantes en el proyecto:
M Gallardo Clínicas Ginemed, Universidad de Sevilla
F Paulini University of Brasilia
A Corral Centro Nacional de Aceleradores, Universidad de Sevilla
M Balcerzyk Centro Nacional de Aceleradores, Universidad de Sevilla
R Risco Centro Nacional de Aceleradores, Universidad de Sevilla
MM Dolmans Universite Catholique de Louvain, Institut de Recherche Experimentale et Clinique, Department of Gynecology
CA Amorim Universite Catholique de Louvain, Institut de Recherche Experimentale et Clinique, Department of Gynecology
Los fragmentos de tejido ovárico humano criopreservados para preservación de la fertilidad son voluminosos (5-10 mm2 y 1 mm de grosor), compactos y compuestos por una gran diversidad celular (estroma, teca, granulosa). Esto se traduce un una permeación pobre y heterogénea de los crioprotectores, y resulta en dos posibles fuentes de daño durante la congelación: 1) daño resultante de un estrés osmótico y deshidratación excesivas en las zonas superficiales del tejido, y 2) insuficiente deshidratación y contenido acuoso intracelular excesivo en las zonas profundas, que da lugar a la formación de hielo. A estos factores se ha de sumar la heterogeneidad del enfriamiento y recalentamiento por la masa térmica del tejido.
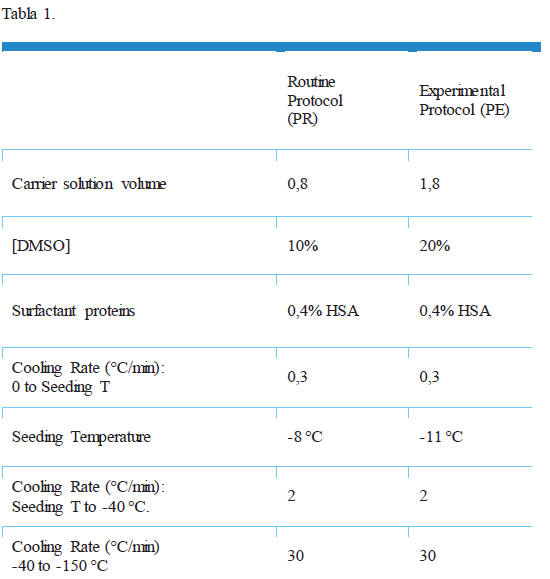
En el presente estudio se compara la crioprotección y eficacia de un protocolo de congelación lenta empleado de rutina en la práctica clínica, con un nuevo protocolo experimental, desarrollado con el fin de aumentar la permeación de crioprotector en el tejido ovárico.
14 muestras de córtex de tejido ovárico fueron donadas para investigación por pacientes menores de 35 años. Cada muestra fue dividida en fragmentos de 5x5x1 mm y asignada aleatoriamente a una de las intervenciones: congelada con el protocolo de rutina (PR), o congelada con el protocolo experimental (PE) (Tabla 1). De cada muestra se realizó un control en fresco.
Los crioviales son recalentados 3 minutos a temperatura ambiente y 3 minutos en agua a 37ºC. La muestra de tejido es lavada 3×5 minutos en medio DMEM y conservada a 4 ºC hasta su xenotransplante en la cavidad intraperitoneal en ratones SCID. Tras 3 semanas, tras lo cual las muestras son retiradas y fijadas en parafina para su análisis histológico e inmunohistoquimico. 4 de las muestras de cada grupo fueron analizadas por tomografía computerizada a temperatura criogénica tras su congelación para determinar el nivel de permeación del crioprotector alcanzado con cada protocolo, siendo la atenuación de la señal correspondiente a la concentración de crioprotector, según descrito por Corral y cols (2015).
El nivel medio de Me2SO observado en el tejido congelado con PR era del 10.9%, respecto al 19.2% obtenido con el PE (p=0.028)
En términos de supervivencia, la congelación lenta del tejido con ambos protocolos no disminuyó la densidad folicular observada, ni el porcentaje de folículos atréticos, pero aumentó el porcentaje de folículos crecientes (primarios, secundarios y terciarios) positivos para el marcador de apoptosis Caspase-3 (0.015). La proporción de folículos primordiales disminuyó de forma similar tras la congelación con ambos protocolos (p=0.031), y aumentó el número de folículos crecientes positivos para Ki-67 (p=0.001). La expresión de AMH por los folículos crecientes no se vio afectada por la congelación (p=0.081), pero la expresión del marcador C-Kit disminuyó tras la congelación exclusivamente en el PE (p=0.028). La vascularización (CD-34) estaba restablecida, con niveles similares al tejido fresco, pero los tejidos congelados presentaban un aumento en la fibrosis (p<0.001).
A pesar de observar una mayor permeación del Me2SO en el tejido congelado con PE, no se observa en base al análisis realizado una mejor crioprotección del tejido con dicho protocolo, comparado con el protocolo de rutina que contiene una concentración menor de agente crioprotector. Serían necesarios estudios con un xenotransplante más prolongado, en los que se complete el desarrollo folicular hasta el estadío antral u ovulatorio, y que permitan el estudio de la funcionalidad e integridad de los orgánulos y ultraestrucuturas de dichos ovocitos para determinar si existe un beneficio en el uso de este protocolo experimental para la congelación de tejido ovárico humano.
Agradezco encarecidamente la ayuda proporcionada por la Asociación para el Estudio de Biología de la Reproducción en el marco de la ‘Bolsa de viaje para estancias en el extranjero’, a todo el grupo de investigación de ginecología del IREC (Universidad Católica de Louvain); y en especial a la Dra. Amorim, promotora de la estancia.