PROTEÓMICA DEL ESPERMATOZOIDE HUMANO
Rafael Oliva Virgili1, Josep Maria Estanyol2, Sara de Mateo López1, Judit Castillo Corullón1, José Luis Ballescà Lagarda3
1Servicio de Bioquímica y Genética Molecular, Centre de Diagnòstic Biomèdic, Hospital Clínic de Barcelona, y Laboratorio de Genética Humana, Facultad de Medicina, Universidad de Barcelona.
2Unitat de Proteòmica, Serveis de Suport a la Recerca, Facultad de Medicina, Universidad de Barcelona
3Institut Clínic de Ginecología Obstetricia i Ginecologia, Hospital Universitari Clínic de Barcelona.
email:roliva@ub.edu
Fecha recepción: 16 abril 2010
Fecha aceptación: 18 abril 2010
LA TRANSICIÓN NUCLEOHISTONA- NUCLEOPROTAMINA Y ORGANIZACIÓN DEL DNA EN EL NÚCLEO DEL ESPERMATOZOIDE
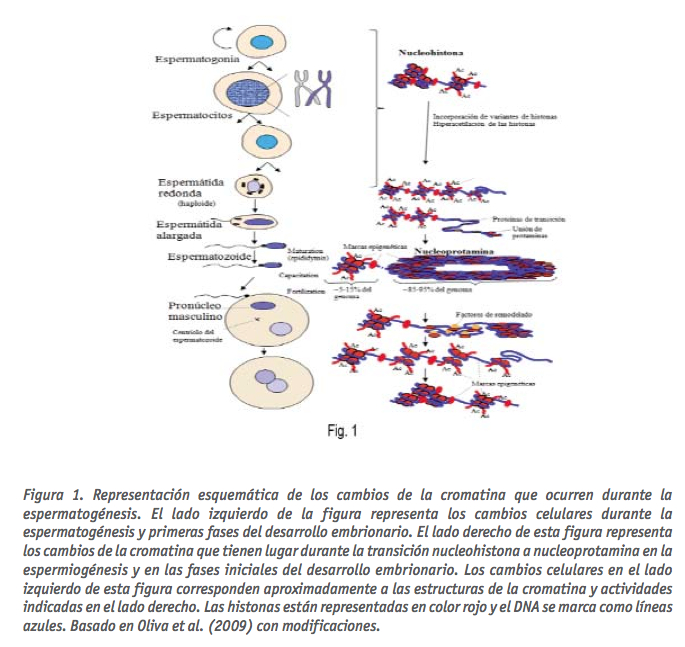
La espermatogénesis es uno de los procesos que conlleva cambios más radicales en la estructura de la cromatina hasta dar lugar al espermatozoide maduro (Mezquita, 1985; Oliva and Dixon, 1991). De forma progresiva primero se desensambla la estructura nucleosómica presente en las espermatogonias, espermatocitos y espermátidas redondas, y es reemplazada transitoriamente por las proteínas de transición y por último por las protaminas (Mezquita, 1985; Oliva and Dixon, 1991; Oliva, 2006; Balhorn, 2007) (Fig. 1).
Mientras que la mayor parte del genoma de espermatozoide (alrededor de 85- 95%) está fuertemente empaquetado en forma de estructuras toroidales, también es importante tener en cuenta que alrededor del 5-15% del DNA de los espermatozoides está organizado por proteínas histonas, muchas de las cuales son variantes específicas del espermatozoide (Fig. 1) (Gatewood et al., 1987; Oliva, 2006; Balhorn, 2007). Se ha propuesto que las estructuras toroidales de la nucleoprotamina, cada una con aproximadamente 50 kb de ADN, podrían estar ancladas a la matriz nuclear a través del DNA entre toroide y toroide (Shaman et al., 2007). Actualmente se sabe que la distribución de los genes en las regiones genómicas organizados por protamina y en las regiones genómicas organizadas por las histonas no es al azar. Estudios recientes basados en el análisis del genoma paterno asociado a cada uno de estos dominios mediante microarrays, han permitido llegar a la conclusión básica de que las regiones asociadas a nucleohistona se hallan asociadas con las regiones reguladoras de genes, lo que implica la existencia de marcas epigenéticas con una función potencial en el desarrollo embrionario (Arpanahi et al., 2009). En otro estudio reciente, basado en secuenciación genómica masiva, se ha detectado que las regiones asociadas a nucleosomas están significativamente enriquecidas en los genes importantes para el desarrollo, incluidos los genes imprintados, los microRNAs, los genes Hox, y los promotores de la transcripción de genes del desarrollo y de factores de señalización (Hammoud et al., 2009). Además, se ha demostrado que las modificaciones de histonas (H3K4me2, H3K27me3) se localizan en determinados loci correspondientes con genes del desarrollo, y que los promotores asociados a genes del desarrollo se hallan hipometilados en el espermatozoide, pero son metilados durante la maduración (Hammoud et al., 2009).
Además de estas marcas epigenéticas determinadas por la distribución diferencial de los genes en los dominios asociados a la nucleohistona y a la nucleoprotamina, hay otros tipos de información epigenética potencialmente transmitida por el núcleo del espermatozoide. Una de las más conocidas y contrastadas es la metilación del DNA (Reik et al., 2001). Más recientemente, la identificación de los RNAs presentes en el espermatozoide y la demostración de su transferencia al oocito abren la posibilidad de un papel de éstos en la fecundación (Ostenmeyer et al., 2004). Otra fuente de información epigenética potencial podría ser la presencia de otras proteínas en el núcleo del espermatozoide, además de las histonas y de las protaminas (Oliva et al., 2009).
La primera evidencia de la presencia de proteínas en el espermatozoide que podían resultar cruciales para el desarrollo del embrión fue el hallazgo de que en los seres humanos y en la mayoría de los mamíferos (con la excepción del ratón), el centrosoma se hereda de forma paterna (Chatzimeletiou et al., 2008). También se ha demostrado que variantes de histonas presentes en el espermatozoide contribuyen a la formación de la cromatina cigótica en humanos y que los procesos epigenéticos, implementados durante la espermatogénesis, permiten distinguir el pronúcleo paterno en el embrión (van der Heijden et al., 2008; de Mateo et al., 2010). Diversas proteínas adicionales presentes en los espermatozoides podrían estar también relacionadas con el desarrollo embrionario (Martínez- Heredia et al., 2006; de Mateo et al., 2007).
Más recientemente, el análisis proteómico de las proteínas identificadas en los espermatozoides maduros ha proporcionado algunos resultados inesperados. Por ejemplo, hay factores de transcripción, proteínas de unión al DNA y proteínas implicadas en el metabolismo de la cromatina en células que son transcripcionalmente inactivas (Oliva et al., 2008; 2009). Los catálogos correspondientes a los proteomas de espermatozoide humano ya están disponibles (Martínez-Heredia et al., 2006; Baker et al., 2007; Oliva et al., 2009). Es notable la presencia de proteínas como la histona acetiltransferasa y deacetilasa, histona metiltransferasa, metiltransferasa del ADN, la topoisomerasa, helicasa, factores de transcripción, zinc fingers, proteínas homeobox, proteínas cromodominio, proteínas centrosómicas, y la telomerasa en las células que son transcripcionalmente inertes y que tienen al menos el 85% de su DNA empaquetado por protaminas (Oliva et al., 2008; 2009). Una cuestión crucial es si estos factores de transcripción y las proteínas recientemente identificados en los núcleos representan vestigios del proceso de la espermatogénesis o bien están marcando algunas regiones del genoma paterno y poseen una función epigenética (Oliva et al., 2008; 2009; Rousseaux et al., 2008).
Anomalías en el contenido de protamina en pacientes subfértiles fueron ya descritas hace más de 20 años (Balhorn et al., 1988). Posteriormente, otros estudios confirmaron la relación entre un contenido anormal de protaminas y alteraciones en los parámetros seminales en estos pacientes infértiles (de Yebra et al., 1993; Mengual et al., 2003; Aoki et al., 2005). Una de las causas potenciales de alteraciones en la relación de protaminas (P1/P2) puede encontrarse en un procesamiento anormal de protamina 2 e incremento de los precursores de protamina en un subconjunto de los pacientes (de Yebra et al., 1998; Bench et al., 1998). Además de estos estudios en pacientes subfértiles, la expresión de protaminas también se ha estudiado en respuesta al estrés térmico y se ha descrito que episodios de fiebre alta se correlacionan con la aparición de precursores de protamina P2 y con un aumento en la proporción de las histonas entre los 33 y 39 días después de la hipertermia (Evenson et al., 2000).
Los resultados del contenido de protaminas y de histonas se han correlacionado con alteraciones en la integridad del DNA y con los resultados de reproducción asistida (Bizarro et al., 1998; Nasr-Esfahani et al., 2005; Aoki et al., 2006; Torregrosa et al., 2006; Domínguez-Fandos et al., 2007; de Mateo et al., 2008; Aitken and de Yuliis et al., 2010).
Identificación de proteínas del espermatozoide y de sus alteraciones a través de técnicas proteómicas.
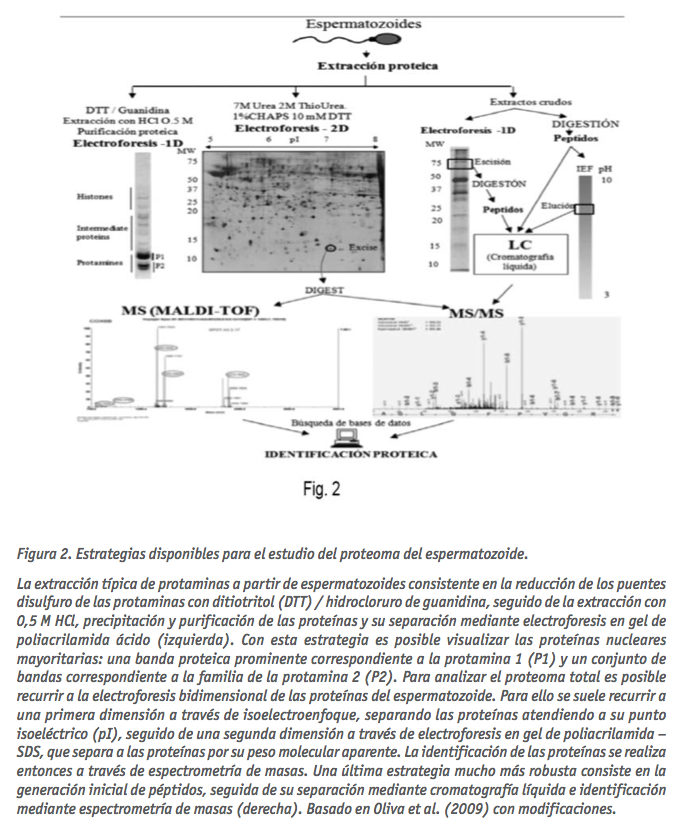
Esencialmente se han utilizado dos alternativas diferentes para el estudio proteómico de los espermatozoides a través de espectrometría de masas (MS): 1) electroforesis bidimensional (2D) seguida de la identif icación por MALDI- MS o cromatografía líquida LC-MS/MS, y 2) la digestión inicial de proteínas para generar péptidos, seguido por su separación y análisis LC-MS/MS (Oliva et al., 2009; Baker and Aitken et al., 2009). La primera alternativa implica generalmente la separación de las proteínas utilizando isoelectroenfoque y es seguida por una electroforesis en gel de poliacrilamida en presencia de SDS (SDS-PAGE) para separar las proteínas en una segunda dimensión en función de su peso molecular (Fig. 2).
Esta alternativa ha sido ampliamente utilizada en el pasado, permitiendo identif icar muchas proteínas presentes en el espermatozoide (Com et al., 2003; Pixton et al., 2004; Martínez-Heredia et al., 2006; 2009). Pero de las dos alternativas, la capacidad de análisis de la generación inicial de péptidos y su análisis mediante LC-MS/MS es muy superior. Por ejemplo, a través de 2D y MALDI-TOF o LC-MS/MS es posible identificar hasta unos pocos cientos de proteínas (de Mateo et al., 2007; Martínez-Heredia et al., 2008), mientras que con la generación inicial de péptidos seguido de LC-MS/MS es posible llegar a identificar hasta alrededor de 1000 proteínas diferentes (Baker et al., 2007; Oliva et al., 2009).
Actualmente el catálogo más amplio de las proteínas presentes en el espermatozoide humano se ha conseguido a través de LC-MS/MS con 1056 productos génicos identificados y es complementario al obtenido mediante 2D e identificación de las proteínas (de Mateo et al., 2007; Baker et al., 2007; Oliva et al., 2009). Además de la generación de catálogos de las proteínas, la proteómica se ha aplicado también a la identificación de la presencia de anomalías en pacientes estériles. Existen diversas estrategias para analizar el contenido diferencial de proteínas presentes en dos o más muestras distintas. Un método es el 2D- DIGE que se basa en el marcado diferencial utilizando fluorocromos de las proteínas extraídas del control (por ejemplo con verde) y de las células experimentales (por ejemplo con rojo). Esto es seguido de su mezcla y separación en la misma 2D, lo que permite detectar las proteínas aumentadas o disminuidas observando la desviación de la fluorescencia hacia uno de los fluorocromos (Baker et al., 2005; Oliva et al. ,2008). Otra alternativa es la cuantificación y comparación de la abundancia relativa de las distintas proteínas en geles independientes. Estrategias más recientes desarrolladas se basan en el marcado isotópico no radioactivo de las muestras problema y control (Baker et al., 2009; Oliva et al., 2009).
La primera descripción del potencial de análisis proteómico 2D en el estudio de defectos en espermatozoides se realizó en un paciente con un fallo reiterado de fecundación en técnicas de fecundación in vitro (Pixton et al., 2004). El proteoma de este paciente mostró 20 diferencias en comparación con los controles y se consiguió identificar varias proteínas diferenciales. Posteriormente se ha conseguido identificar proteínas diferenciales en pacientes astenozoospérmicos, oligozoospérmicos y en pacientes con alteraciones en el contenido de protaminas o en la integridad del DNA (Baker et al., 2005; de Mateo et al., 2007; Oliva, 2007; Martínez-Heredia et al., 2009; Botta et al., 2009; Siva et al., 2010). La proteómica se ha aplicado también al estudio de los antígenos inmunogénicos presentes en los espermatozoides, tanto con el fin de comprender la esterilidad inmunológica como para identificar posibles candidatos inmuno-anticonceptivos (Oliva et al. ,2009).
La aplicación de las técnicas de proteómica en andrología y en biología reproductiva se halla en sus inicios, pero los datos disponibles hasta la fecha ya indican su enorme potencial. Es previsible que en un futuro permitan una disección molecular de las distintas causas de esterilidad masculina, permitiendo tanto la identificación de los mecanismos fisiopatogénicos implicados, como resultar de utilidad en el diagnóstico, pronóstico, y desarrollo de nuevas estrategias terapéuticas.
AGRADECIMIENTOS
Subvencionado en parte gracias al proyecto del Ministerio de Ciencia y Tecnología (BFU2009-07118), Fondos FEDER a R.O.