REVISIÓN MORFOLÓGICA Y CATEGORIZACIÓN EMBRIONARIA EN D+4
Grupo de Interés de Embriología de ASEBIR
Marta Moragas (Hospital Quirón Barcelona, España), Mª José Torelló (Hospital Quirón Barcelona, España), Fernando Prados (Hospital Montepríncipe, Madrid, España), Victoria Hurtado de Mendoza (masvida Reproducción, Sevilla, España), Mª José de los Santos (Instituto Valenciano de Infertilidad, Valencia, España), Ana Busquets (Centro Médico Teknon, Barcelona, España), Mª José Figueroa(HC Fertility, Marbella, España), Amaia Mujica (IBILAB, Palma de Mallorca, España), Beatriz González (Hospital Rio Hortega, Valladolid, España), Miguel Ángel Vilches (Complejo Hospitalario Torrecárdenas, Almería, España), María Carme Pons (Centro Médico Teknon, Barcelona, España), Gemma Arroyo (Institut Universitari Quirón Dexeus, Barcelona, España), Elena García (Royal Victoria Hospital, Montreal, Canadá).
En este documento el Grupo de Interés de Embriología (GIE) de ASEBIR presenta una revisión actualizada y una propuesta de categorización embrionaria para los embriones de D+4. Los parámetros más relevantes evaluados en D+4 son la entrada de los embriones en la 4ª ronda de divisiones mitóticas, la adhesión, la compactación celular y las anomalías morfológicas de mal pronóstico (excesiva fragmentación, vacuolización, cavitación intracelular).
1.- Introducción
Hace unos años ASEBIR consideró necesario recoger en un documento de consenso aquellos parámetros que debían considerarse para clasificar los embriones en diferentes estadios de desarrollo. El trabajo realizado por la Comisión de ASEBIR quedó documentado en el II Cuaderno de Embriología Clínica, “Criterios ASEBIR de valoración morfológica de oocitos, embriones tempranos y blastocistos humanos” (ASEBIR, 2008).
Dado que es necesario realizar revisiones periódicas de estos parámetros, la necesidad de profundizar más en el D+4 y, por otra parte, la demanda creciente por parte de los socios de ASEBIR de dar una clasificación a los embriones de D+4, el grupo de interés de embriología (GIE) de ASEBIR presenta en este documento una revisión actualizada y una propuesta de categorización embrionaria para D+4.
Se sigue la idea de clasificación embrionaria dinámica planteada desde el inicio por ASEBIR y por ello se considera el histórico de la evolución de los embriones en D+2 y D+3 para poder dar una gradación final al embrión de D+4.
2.- Intervalo de observación posinseminación en D+4
Se modifica el intervalo de observación para Día+4, que se establece en 92+/-2 horas posinseminación, de acuerdo con el tiempo de observación propuesto por el Alpha/ESHRE Consensus (2011).
3.- Parámetros evaluados en D+4
- División celular
- Adhesión celular
- Compactación
- Fragmentación
- a) División celular.
El embrión óptimo tiene que haber iniciado la 4ª ronda de divisiones mitóticas (>8 células) (Feil et al., 2008; Alpha/ESHRE Consensus, 2011).
- b) Adhesión celular.
Estadio en el cual las células se pueden identificar bien por separado, aunque con membranas adyacentes.
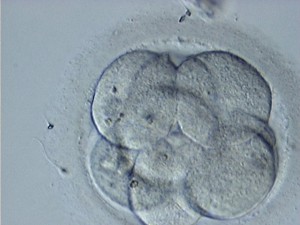
La adhesión celular es el primer paso en el proceso de la compactación; el embrión muestra los blastómeros con amplias zonas de contacto intercelular. En este momento los blastómeros todavía se pueden diferenciar claramente entre sí (ver imagen 1).
Imagen 1.- Adhesión celular
Existe adhesión celular temprana en D+3, que puede ser un factor favorable siempre que el embrión tenga 7 u 8 células. Puede estar influenciado por los protocolos y los medios de cultivo utilizados (Wiemer et al., 1996; Desai et al., 2000).
- c) Compactación celular.
Estadio en el que es difícil diferenciar los blastómeros entre sí; visualmente se caracteriza por la apariencia de una masa de células compacta y se pueden identificar los núcleos.
La compactación celular se debe a las fuertes uniones (tigh junctions) que se forman entre las células, lo que impide que se distingan los contornos de cada una claramente. La activación del genoma embrionario es un requisito previo para la correcta compactación (Balaban et al., 2000; Beher et al., 2000; Alikani et al., 2005). La compactación conlleva un aumento de la adhesión intercelular mediada por uniones adherentes y el inicio de la polarización embrionaria (Gardner, 1989; Veeck, 1999; Alikani, 2005; Cockbum y Rossant, 2010). En esta situación las células dejan de ser totipotentes, lo que corresponde a un preembrión ya especializado.
Según el grado de compactación:
- Compactación total: afecta a todas las células del embrión.
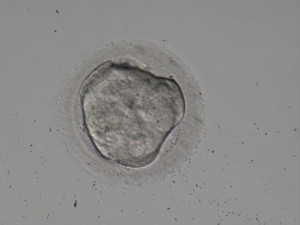
Es completa cuando todas las células están compactadas y visualmente se caracteriza por una masa multicelular (ver imagen 2).
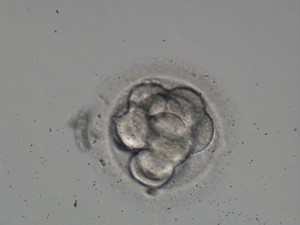
Es incompleta cuando todas las células están iniciando el proceso de compactación pero en distinto grado, pudiéndose distinguir aún algunos blastómeros mientras que otros ya empiezan a formar una masa compacta (ver imagen 3).
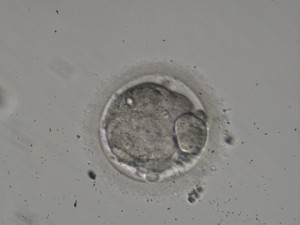
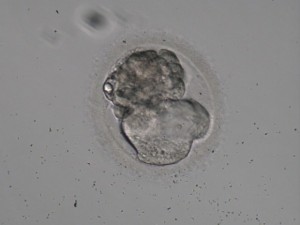
ü Compactación parcial: afecta solamente a algunas de las células del embrión. Se observan embriones que excluyen células de su compactación; esta pérdida de citoplasma puede ser más o menos importante en función de la proporción de células que quedan excluidas y se correlaciona con el tamaño del embrión resultante (ver imagen 4).
Imagen 2.- Compactación completa
Imagen 3.- Compactación incompleta
Imagen 4.- Compactación parcial: exclusión de 1 célula
- d) Fragmentación y vacuolización. Ambos parámetros son indicativos de inicio de apoptosis pero no hay referencias bibliográficas relativas a D+4 que lo relacionen directamente con fallos de implantación. Los fragmentos y células que entran en apoptosis no compactan y quedan excluidos fuera del embrión (ver imagen 5).
Imagen 5.- Fragmentación excluida de la compactación
4.- Transferencias en D+4
La falta de criterios morfológicos predictivos de embarazo es la principal causa de que no se realice la transferencia embrionaria en D+4 de forma sistemática.
Hay pocas publicaciones y la variabilidad en los criterios de gradación todavía es grande. La mayoría de estudios describen tasas de embarazo e implantación similares a las que se obtienen transfiriendo en D+2 o en D+3 (Kiltz et al., 2003; Patnos et al., 2008).
Estudios más recientes ponen de manifiesto que transferir en D+4 es una alternativa viable a transferir en D+5 sin comprometer las tasas de implantación y embarazo clínico (Skorupski et al., 2007; Feil et al., 2008; Menezes et al., 2010).
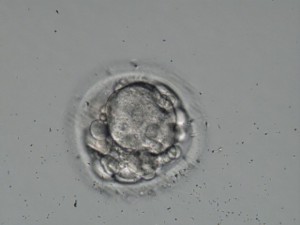
Cuando más de la mitad del embrión está excluido de la compactación el pronóstico implantatorio es más bajo (Tao et al., 2002) (ver imagen 6).
Imagen 6.- Compactación parcial: <50% embrión compactado
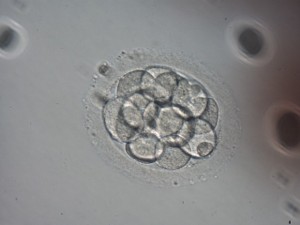
Se postuló que los embriones en estadio de 14-16 células, que no presentaban signos evidentes de compactación, tenían reducida la capacidad de llegar a blastocisto (Veeck y Zaninovic, 2003) (ver imagen 7). Pero contrariamente a lo que se dijo en un primer momento, recientemente se ha constatado que estos embriones tienen capacidad de formar blastocistos viables e implantar en porcentajes aceptables (Feil et al., 2008; Ebner et al., 2009).
Imagen 7.- Embrión de 16 células sin signos de compactación
5.- Recomendaciones ASEBIR para la categorización de los embriones de D+4
La clasificación en D+4 es dinámica; es una continuación de la clasificación morfológica en estadios celulares tempranos.
Es de consenso que el embrión óptimo en D+4 es el que está compactado o compactando y que ha iniciado la 4ª ronda de divisiones mitóticas (>8 células). La compactación debe comprender el total del volumen del embrión.
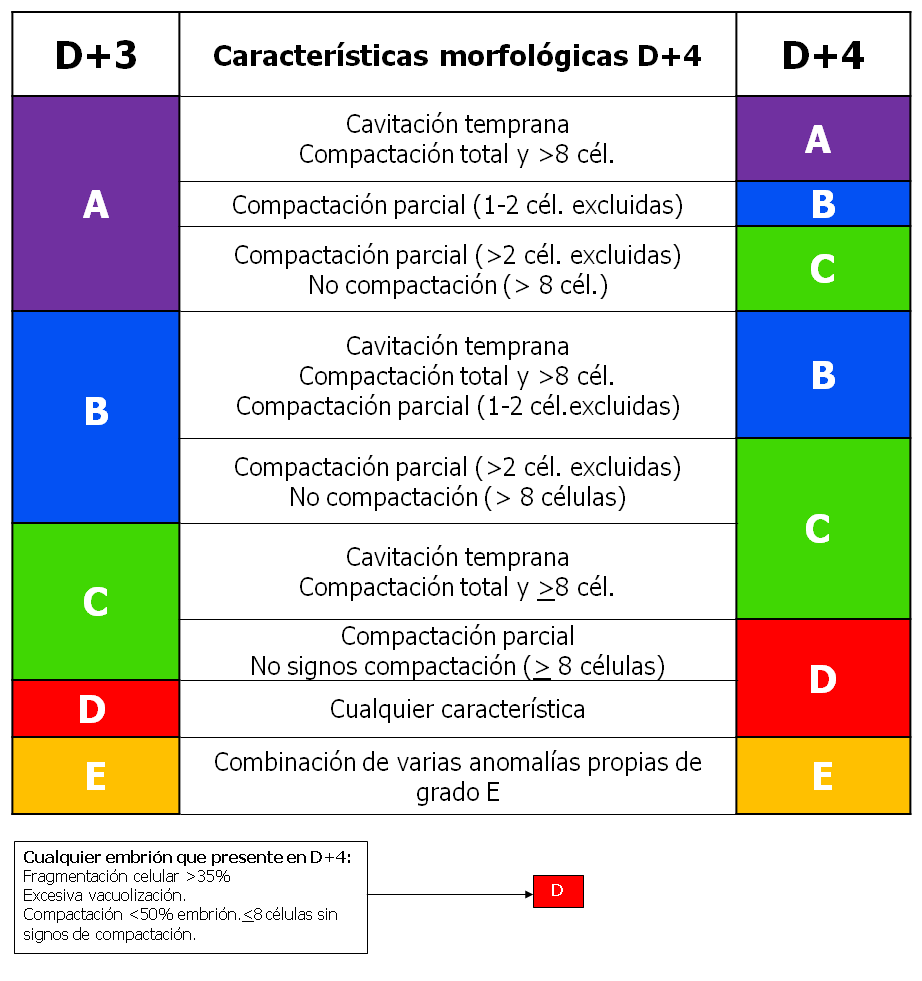
Atendiendo a los parámetros anteriormente mencionados: división celular, adhesión, compactación total o parcial, cavitación temprana y anomalías morfológicas de mal pronóstico (excesiva fragmentación, vacuolización, cavitación intracelular), se puede dar una propuesta de categorización ASEBIR para D+4 (tabla 2).
Tabla 2: Propuesta de gradación embrionaria para D+4.
Referencias
- Alikani M. Epithelial cadherin distribution in abnormal human pre-implantation embryos. Hum Reprod 2005; 20: 3369-3375.
- Criterios ASEBIR de valoración morfológica de oocitos, embriones tempranos y blastocistos humanos. Cuadernos de Embriología Clínica (II). 2ª ed. Madrid. Asociación para el Estudio de la Biología de la Reproducción (ASEBIR); 2008.
- Balaban B, Urman B, Sertac A, Alatas C, Aksoy S, Mercan R. Blastocyst quality affects the success of blastocyst-stage embryo transfer. Fertil Steril 2000; 74: 282-287.
- Behr B, Fisch JD, Racowsky C, Miller K, Pool TB, Miliki AA. Blastocyst embryo transfer and monozygotic twinning. J Assist Reprod Genet 2000; 17: 349-351.
- Cockbum K and Rossant J. Making the Blastocyst: lessons from the mouse. The Journal of Clinical Investigation 2010; 120 (4): 995-1003.
- Desai NN, Goldstein J, Rowland DY, Goldfarb JM. Morphological evaluation of human embryos and derivation of an embryo quality scoring system specific for day 3 embryos: a preliminary study. Hum Reprod 2000; 15 (10): 2190-2196.
- Ebner T, Moser M, Shebl O, Sommergruber M, Gaiswinkler U, Tews G. Morphological analysis at compacting stage is a valuable prognostic tool for ICSI patients. Reprod BioMed Online 2009; 18 (1): 61-66.
- Feil D, Henshaw R, Lane M. Day 4 embryo selection is equal to Day 5 using a new embryo scoring system validated in single embryo transfers. Hum Reprod 2008; 23(7): 1505-1510.
- Gardner RL. Ciba Cell allocation and lineage in the early mouse embryo. Found Symp 1989; 144:172-81; discussion 181-6, 208-211.
- Kiltz R, Woodhouse D, Miller D, Sciera A, Corona L. Efficacy of day 4 embryo transfer (ET) in minimizing weekend staffing requirements. Fertil Steril 2003; 80 (3): 126.
- Menezes J, Sjoblom P, Tristen C, Wrambsby H. Day 4 embryo transfer offers more flexibility in an IVF program without compromising the outcome. 26th Annual Meeting of European Society of Human Reproduction and Embryology; 2010 Junio 27-30 Roma, Italia. O006.
- Patnos K, Makrakis E, Chronopoulou M, Biba M, Perdikaris A, Dafereras A. Day 4 versus Day 3 embryo transfer: a prospective study of clinical outcomes. Fertil Steril 2008; 89 (3): 573-577.
- Skorupski JC, Stein DE, Acholonu U, Field H, Keltz M. Successful pregnancy rates achieved with day 4 embryo transfers. Fertil Steril 2007; 87: 788-791.
- Tao J, Tamis R, Fink K, Williams B, Nelson-White T, Craig, R. The neglected morula/compacted stage embryo transfer. Hum Reprod 2002; 17 (6): 1513-1518.
- The Istanbul consensus workshop on embryo assessment: proceedings of an expert meeting. Alpha Scientists in Reproductive Medicine and ESHRE Special Interest Group Embryology. Hum Reprod 2011; 26 (6): 1270-1283.
- Veeck, L. The cleaving human pre-embryo. An atlas of human gametes and conceptus: an illustrated reference for assisted reproductive technology. Ed. The Parthenon Publishing, New York; 1999. p. 40-45.
- Veeck, LL, Zaninovic N. Human morulae in vitro. An Atlas of Human Blastocysts. Veeck, LL, Zaninovic N (eds). Ed. The Parthenon Publishing. Boca Raton, London, New York, Washington, USA; 2003. p. 61-82.
- Wiemer K, Garrisi J, Seuerwald N. Beneficial aspects of co culture with assisted hatching when applied to multiple-failure in vitro fertilizations patients. Hum Reprod 1996; 11: 2429-2433.