TRANSFERENCIA DE HUSO MEIÓTICO PARA LA PREVENCIÓN DE ENFERMEDADES MITOCONDRIALES: MÁS CERCA LA APLICACIÓN CLÍNICA
Nuno Costa-Borges1, Xavier Santamaría2, Gloria Calderón1
1 Embryotools, Parc Científic de Barcelona
2 IVI-Barcelona
Las enfermedades causadas por mutaciones en el DNA mitocondrial (mtDNA) presentan frecuentemente patologías severas y actualmente no tienen tratamiento. Se conoce que son transmitidas por herencia materna, también denominada herencia citoplasmática. Aunque la reproducción asistida ha propuesto diferentes estrategias para intentar prevenirlas, éstas no han sido lo suficientemente exitosas para la aplicación clínica. Sin embargo, la reciente publicación de una novedosa técnica de reproducción asistida, la transferencia de huso meiótico (MST) en ovocitos humanos, ha reabierto la esperanza, no sólo a la posibilidad de prevenir enfermedades mitocondriales, sino también a la resolución de problemas de infertilidad relacionados con defectos citoplasmáticos del ovocito. En este artículo, se describen las características de esta técnica y el significado de su eventual uso clínico.
Las mitocondrias son orgánulos presentes en prácticamente todas las células eucariotas, que cumplen importantes funciones en el metabolismo celular. Actúan como centrales energéticas de la célula, sintetizando ATP por vía del ciclo del ácido cítrico (de Krebs) y la cadena transportadora de electrones. Además, cuentan con su propio DNA extranuclear, conocido como DNA mitocondrial (mtDNA), el cual se transmite por vía materna en el momento de la fecundación, cuando el embrión hereda las mitocondrias presentes en el citoplasma del ovocito.
Diferentes estudios indican que las enfermedades mitocondriales están frecuentemente asociadas a mutaciones en el DNA mitocondrial, o bien a mutaciones en genes nucleares que codifican proteínas implicadas en el correcto funcionamiento de la mitocondria. Aunque la gravedad y sintomatología de estas enfermedades es variable, estas patologías severas afectan habitualmente a órganos o tejidos que requieren un alto aporte energético, como pueden ser cerebro, corazón, hígado, músculos esqueléticos o riñones (Gropman, 2001). Son ejemplos de enfermedades causadas por alteraciones en el mtDNA, la oftalmoplejia externa crónica progresiva, el síndrome de Kearns-Sayre, el síndrome Mitochondrial Encephalomyopathy, Lactic Acidosis, Stroke (MELAS), el síndrome de Pearson, el síndrome de Leigh, la debilidad neurogénica con ataxia y retinitis pigmentosa, la epilepsia mioclónica con fibras rojas rotas o la neuropatía óptica hereditaria de Leber (Haas et al., 2008).
Se estima que la prevalencia de estas enfermedades es de 1 en cada 5.000 nacimientos, aunque hay estudios que indican que la frecuencia de patologías hereditarias asociadas a mutaciones en el mtDNA puede ser incluso mayor, acercándose a 1 en cada 200 nacimientos (Schaefer et al. 2008).
Actualmente, no se conocen tratamientos para este tipo de enfermedades, por lo que evitar su transmisión a la descendencia es un tema preocupante para muchas familias y para lo cual se necesitan soluciones (Roberts, 1999; Craven et al., 2011).
A nivel de la reproducción asistida, el diagnóstico genético preimplantacional (PGD) se suele considerar como opción para evitar que madres portadoras de mutaciones en el mtDNA las transmitan a sus hijos. En 2006, Steffann et al. describieron la aplicación del PGD para un caso de debilidad neurogénica con ataxia y retinitis pigmentosa (Steffann et al., 2006) y, posteriormente, se ha descrito también el nacimiento de un niño libre del síndrome de Leigh a través del PGD (Unsal et al., 2008). Sin embargo, en el caso de mujeres con altos niveles de alteraciones en el mtDNA, la donación de ovocitos representa la única alternativa que asegura tener un niño sano, con la consiguiente limitación de que la descendencia no comparta su dotación genética (Craven et al., 2011).
Transferencia de huso meiótico en ovocitos
Dado que la herencia mitocondrial se transmite por vía materna, y ya que el mtDNA del futuro embrión proviene de las mitocondrias del ovocito, hace décadas que investigadores de todo mundo se esfuerzan por encontrar soluciones viables al problema de la herencia de enfermedades mitocondriales causadas por mutaciones en el mtDNA.
Sin embargo, ninguno de los procedimientos desarrollados hasta el momento se consideraba lo suficientemente seguro como para utilizarse como herramienta de aplicación clínica con el fin de prevenir la herencia de este tipo de enfermedades (revisado en Craven et al., 2011).
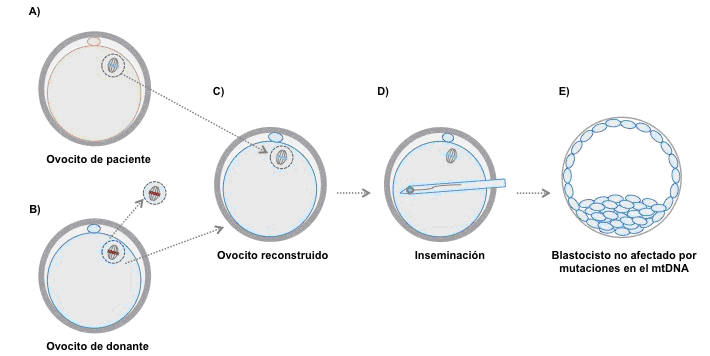
Recientemente, sin embargo, se generó la hipótesis de que si se lograra reemplazar por completo el citoplasma de un ovocito de una paciente por el citoplasma de un ovocito de donante, se podría evitar la presencia de mtDNA con alteraciones en el futuro embrión y de esta forma lograr el nacimiento de hijos libres de enfermedad. En 2009, el grupo de investigadores dirigido por Shoukhrat Mitalipov, del Oregon National Primate Research Center, llevó a cabo un proyecto de investigación destinado a desarrollar la técnica denominada Maternal Spindle transfer (MST) o spindle-chormosomal-complex transfer. Esta técnica se basa en aislar y transferir el huso meiótico y los respectivos cromosomas (material genético nuclear) de un ovocito maduro, al citoplasma de otro ovocito enucleado (al cual se han extraído previamente los cromosomas). De esta manera, se logra reemplazar el citoplasma de un ovocito de una paciente con mutaciones en el mtDNA u otro tipo de defectos citoplasmáticos, por el citoplasma de un ovocito de donante, sin mutaciones en el mtDNA y con orgánulos, RNA y proteínas sanas. Con la posterior inseminación del ovocito resultante del proceso de MTS, el eventual embrión obtenido estaría genéticamente relacionado con la paciente, siendo portador de genes mitocondriales y orgánulos sanos provenientes de la donante (Fig. 1).
Figura 1. La técnica de transferencia de huso meiótico entre ovocitos. A) Se aisla y aspira el complejo formado por el huso meiótico y respectiva placa metafásica (carioplasto) de un ovocito maduro afectado por mutaciones en el mtDNA u otros problemas citoplasmáticos. B) Se transfiere el carioplasto de la paciente a un ovocito enucleado de donante (citoplasto), del cual los cromosomas han sido previamente extraídos. C) El nuevo ovocito, constituido por el carioplasto (cromosomas nucleares) de la paciente y el citoplasto sano de la donante, queda así listo para ser fecundado. D) El embrión obtenido estaría genéticamente relacionado con la paciente y sería portador de mtDNA y orgánulos sanos provenientes de la donante.
Los primeros ensayos realizados en el modelo primate no humano (Reshus macaque) demostraron la fiabilidad técnica de este procedimiento, así como su alta eficiencia, con tasas de fecundación y desarrollo embrionario in vitro similares a las obtenidas con ovocitos control (Tachibana et al., 2009). Además, los embriones transferidos a hembras receptoras, se desarrollaron normalmente y se logró el nacimiento de tres crías sanas que demostraron, mediante análisis por microsatélites, la identidad genética de las células donadoras de huso (Tachibana et al., 2009; Tachibana et al., 2010). A nivel molecular, se demostró a través de la secuenciación de polimorfismos de un solo nucleótido (SNP) mitocondriales y polimorfismos en la longitud de fragmentos de restricción (RFLP) que el mtDNA de las crías provenía exclusivamente de los citoplastos donadores (Tachibana et al., 2009; Tachibana et al., 2010).
Transcurridos más de tres años desde el nacimiento de las tres crías, todas presentan niveles de desarrollo y crecimiento normales, y los parámetros bioquímicos de función renal, hepática y tensión arterial, así como los niveles de ATP y potenciales de membrana de las mitocondrias son similares a los encontrados en animales control de la misma edad (Tachibana et al., 2013).
Los resultados de este estudio representaron un gran hito porque, por primera vez, se demostró que es posible remplazar por completo el mtDNA en un ovocito (todos los análisis probaron la ausencia de heteroplasmia), y por la importancia de haber sido desarrollado en un modelo animal próximo al humano.
Más recientemente, el mismo grupo, confirmó el potencial de la técnica, realizando los primeros ensayos con ovocitos humanos, cuyos resultados fueron dados a conocer el pasado mes de octubre del 2012 en la revista Nature (Tachibana et al., 2013).
De un total de 106 ovocitos humanos donados voluntariamente para investigación, a 65 se les practicó la técnica MST recíproca, mientras que 33 ovocitos fueron usados como control. Una vez inseminados mediante la técnica de ICSI, la tasa de fecundación de los ovocitos provenientes de MST (73%) fue similar a la obtenida con los ovocitos control (75%), aunque un porcentaje importante de zigotos (52%) presentó una tasa anormal de fecundación, determinada por un número irregular de pronúcleos (PNs) (Tachibana et al., 2013). De entre todos los zigotos que demostraron una fecundación normal, 2 PNs y 2 corpúsculos polares, las tasas de desarrollo hasta el estadio de blastocisto (62%) y las tasas de derivación de células madre embrionarias (38%) fueron comparables a las obtenidas con embriones provenientes de ovocitos control. Además, todas las líneas de células madre embrionarias derivadas de blastocistos provenientes de ovocitos en los que se les practicó la técnica de MST presentaron un cariotipo normal y un contenido en mtDNA exclusivamente de origen del ovocito donante del citoplasma (Tachibana et al., 2013). Se demostró así que el mtDNA puede ser reemplazado por completo también en ovocitos humanos y que los embriones obtenidos en los que se observó una fecundación correcta son capaces de desarrollarse in vitro hasta el estadio de blastocisto y producir células madre embrionarias con una eficiencia similar a la obtenida con embriones control (Tachibana et al., 2013). Asimismo, y aunque los resultados descritos son muy prometedores, hay todavía un gran margen de investigación y un largo recorrido para mejorar las tasas de fecundación y desarrollo embrionario, y simplificar técnicamente el protocolo de MST. Además, la técnica y los resultados deben ser contrastados por otros laboratorios para que se corrobore la fiabilidad y seguridad del protocolo y así su potencial para uso clínico.
Potencial de la transferencia de huso meiótico en la práctica clínica
En el caso de que las investigaciones futuras confirmen la seguridad y fiabilidad de la técnica de MST, sus posibles aplicaciones clínicas son amplias. La aplicación más obvia es la que suscitó su desarrollo: la prevención de enfermedades mitocondriales. Como se ha explicado anteriormente, para este fin se usaría como donador un ovocito con mitocondrias normales, lo que permitiría a una pareja afectada por una enfermedad mitocondrial tener sus propios hijos (desde una perspectiva genética) y no tener que recurrir a la donación de ovocitos con el consiguiente complemento genético diferente. Aparte de esta aplicación, la MST también puede tener indicaciones igualmente interesantes, como sería su uso en el fallo repetido de la fecundación in vitro o en la corrección de defectos citoplasmáticos presentes en ovocitos. También se podría aplicar a pacientes con baja reserva ovárica u ovocitos de mala calidad, lo que permitiría usar ovocitos donados pero manteniendo el DNA de la paciente. Esto último podría eliminar al mismo tiempo la reticencia de algunas donadoras de ovocitos que, preocupadas porque sus genes se transmitan, se replantean la donación.
Ensayos clínicos
Confiando en los resultados descritos y siendo un país pionero en la investigación y desarrollo de técnicas para reproducción asistida, Reino Unido ha dado ya el primer paso en el mundo para acercar la MST, todavía en fase experimental, a la práctica clínica. La agencia británica Human Fertilisation and Embryology Authority (HFEA, siglas en inglés), encargada de aconsejar al gobierno sobre la regulación de esta novedosa técnica reproductiva, ha lanzado una consulta pública para saber la opinión de los ciudadanos británicos sobre posibles nuevos procedimientos médicos diseñados para evitar futuras enfermedades genéticas graves. Los resultados fueron dados a conocer en el pasado mes de marzo de 2013 y demostraron una amplia aprobación de la ciudadanía a su aplicación clínica. Dado este importante primer paso, el gobierno inglés debe decidir ahora si pretende legalizar esta práctica en humanos y buscar apoyos para que el Parlamento apruebe o no la ley en Reino Unido. Si su aplicación es exitosa en este país, se espera que se sumen a corto plazo otros países igualmente pioneros en reproducción asistida, como es España.
Referencias
Craven L, Elson JL, Irving L, Tuppen HA, Lister LM, Greggains GD, Byerley S, Murdoch AP, Herbert M, Turnbull D. 2011. Mitochondrial DNA disease: new options for prevention. Hum Mol Genet 20: 168-174.
Gropman AL. 2001. Diagnosis and treatment of childhood mitochondrial diseases. Curr Neurol Neurosci Rep 1: 185–194.
Haas RH, Parikh S, Falk MJ, Saneto RP, Wolf NI, Darin N, Cohen BH. 2007. Mitochondrial disease: a practical approach for primary care physicians. Pediatrics 120, 1326–1333.
Piña-Aguilar RE. 2011. Prevention of mitochondrial diseases: a hope through assisted reproductive technologies. Gac Med Mex 147:172-175.
Roberts RM. 1999. Prevention of human mitochondrial (mtDNA) disease by nucleus transplantation into an enucleated donor oocyte. Am J Med Genet 87:265–266.
Schaefer AM, McFarland R, Blakely EL, He L, Whittaker RG, Taylor RW, Chinnery PF, Turnbull DM. 2008. Prevalence of mitochondrial DNA disease in adults. Ann Neurol 63, 35–39.
Steffann J, Frydman N, Gigarel N, Burlet P, Ray PF, Fanchin R, Feyereisen E, Kerbrat V, Tachdjian G, Bonnefont JP, Frydman R, Munnich A. 2006. Analysis of mtDNA variant segregation during early human embryonic development: a tool for successful NARP preimplantation diagnosis. J Med Genet 43:244-247.
Tachibana M, Amato P, Sparman M, Woodward J, Sanchis DM, Ma H, Gutierrez NM, Tippner-Hedges R, Kang E, Lee HS, Ramsey C, Masterson K, Battaglia D, Lee D, Wu D, Jensen J, Patton P, Gokhale S, Stouffer R, Mitalipov S. 2013. Towards germline gene therapy of inherited mitochondrial diseases. Nature 493:627-631.
Tachibana M, Sparman M, Mitalipov S. 2010. Chromosome transfer in mature oocytes. Nat Protoc 5:1138-1147.
Tachibana M, Sparman M, Sritanaudomchai H, Ma H, Clepper L, Woodward J, Li Y, Ramsey C, Kolotushkina O, Mitalipov S. 2009. Mitochondrial gene replacement in primate offspring and embryonic stem cells. Nature 461:367-372.
Unsal E, Aktaş Y, Uner O, BaltacI A, Ozcan S, Turhan F, Baltaci V. 2008. Successful application of preimplantation genetic diagnosis for Leigh syndrome. Fertil Steril 90:2017:e11-3.