VITRIFICACIÓN DE BLASTOCITOS BOVINOS PRODUCIDOS IN VITRO EN DIFERENTES ESTADIOS DE DESARROLLO
Roser Morató1, Dolors Izquierdo2, Maria Teresa Paramio2, Teresa Mogas1
1Departamento de Medicina y Cirugía Animales.
2Departamento de Ciencia Animal y de los Alimentos. Universidad Autònoma de Barcelona, Cerdanyola del Vallès (Barcelona)
email:teresa.mogas@uab.es
Fecha recepción: 5 mayo 2010 · Fecha aceptación: 25 mayo 2010
Resumen: Se diseñaron dos experimentos para determinar la capacidad de los blastocistos bovinos producidos in vitro para sobrevivir a un proceso de vitrificación en diferentes etapas de su desarrollo. Los embriones se clasificaron en blastocistos no expandidos, expandidos o eclosionando/eclosionados tras 7 u 8 días de cultivo embrionario in vitro. En el primer experimento, se evaluó el porcentaje de supervivencia de los blastocistos vitrificados/calentados tras 3 horas de incubación en el medio SOF. En el segundo experimento, los blastocistos vitrificados/calentados fueron fijados en paraformaldehído e incubados con tinción de TUNEL para detectar el índice de integridad del DNA. El porcentaje de blastómeros TUNEL positivo y negativo fue evaluado por la microscopía confocal. Cuando se analizaron los resultados según la etapa del desarrollo embrionario tras 7 días de cultivo, no se observaron diferencias significativas en los porcentajes de supervivencia después de vitrificar blastocistos expandidos (79,1%) o eclosionados (73,7%). Cuando los embriones fueron vitrificados en el día 8, se obtuvieron porcentajes de supervivencia del 53,5 % y el 54,4 % tras el calentamiento de blastocistos expandidos o eclosionados, respectivamente. La supervivencia siempre fue significativamente inferior tras la vitrificación de blastocistos no expandidos, en particular en los vitrificados a día 8 post-inseminación (≤28%). Los porcentajes de supervivencia obtenidos tras 7 días de cultivo embrionario fueron significativamente superiores a los obtenidos tras 8 días, con independencia del estadio de desarrollo valorado. El índice de integridad del ADN que presentaban los blastocistos tras un proceso de vitrificación/calentamiento fue similar al de los blastocistos control, independientemente de la duración del cultivo embrionario o de la etapa del desarrollo de los blastocistos. Estos resultados sugieren que la vitrificación de embriones bovinos, utilizando el cryotop como soporte, es particularmente útil para la crioconservación de blastocistos que presenten un alto grado de expansión (expandidos o eclosionados), principalmente cuando la vitrificación se lleva a cabo tras 7 días de cultivo embrionario in vitro. Rev Asoc Est Biol Rep 2010;15(2):27-33.
Palabras clave: vaca, maduración, fecundación, crioconservación, cryotop, apoptosis
VITRIFICATION OF DIFFERENT DEVELOPMENTAL STAGES OF BOVINE BLASTOCYSTS PRODUCED IN VITRO
Summary: Two experiments were designed to determine the ability of in vitro cultured blastocysts at different stages of development to survive de vitrification procedure. Day 7 and day 8 embryos were classified as blastocysts, expanded blastocysts, or hatching/hatched blastocysts. In the first experiment, we examined the survival rate of the vitrified/warmed blastocysts after 3h incubation in SOF medium. In the second experiment, vitrified/warmed blastocysts were fixed in 4% paraformaldehyde and were incubated with TUNEL staining for detecting DNA damaged nuclei. The percentage of TUNEL positive and negative blastomeres was assessed by confocal microscopy. When the results according to the developmental stage were analysed, no differences in the survival rate after vitrification of expanded (79.1%) and hatched blastocysts (73.7%) were observed at Day 7. When embryos were vitrified at Day 8, survival rates of 53.5% and 54.4% were observed after warming expanded and hatched blastocysts. The lower survival rates were observed in non expanded blastocysts, particularly in those vitrified at Day 8 (≤28%). Survival rates from blastocysts vitrified after 7 days of embryo culture were significantly higher than those obtained after 8 day, independently of the embryo developmental stage. DNA integrity index obtained after the vitrification/warming process was comparable to those from control fresh blastocysts, independently of the length of the embryo culture or the developmental stage of the blastocyst. These findings suggest bovine blastocyst vitrification, using the cryotop as a support, seems to be particularly useful for blastocysts presenting a high degree of expansion (expanded and hatched blastocysts), mainly when the vitrification is carried out after 7 days of in vitro embryo culture. Rev Asoc Est Biol Rep 2010;15(2):27-33.
Key words: cow, maturation, fertilization, cryopreservation, cryotop, apoptosis
INTRODUCCIÓN
Con los recientes avances en los protocolos de crioconservación, la crioconservación de blastocistos se ha convertido en una herramienta fácil y fiable para preservar aquellos embriones que han expresado su máximo potencial de desarrollo in vitro (Menezo, 2004). A pesar de que la congelación lenta continua siendo la técnica más utilizada para la crioconservación de los embriones bovinos producidos in vivo o in vitro, la vitrificación ha surgido en la última década como una alternativa prometedora y es, en la actualidad, el método de elección debido a que es un procedimiento rápido que no requiere de equipo especial y proporciona buenos resultados en diferentes especies (Berthelot et al., 2000; Vajta et al., 1998) y especialmente cuando se trabaja con ovocitos o embriones producidos in vitro o micromanipulados (Pereira et al., 2008). La vitrificación utiliza soluciones de agentes crioprotectores (CPAs) con concentraciones muy elevadas, que provocan un incremento de la viscosidad de las soluciones provocando la formación de un estado sólido amorfo semejante al vidrio. Debido al uso de estas elevadas concentraciones de CPAs, el contacto de las células con los CPAs y las tasas de enfriamiento deben ser lo suficientemente rápidas para evitar los efectos tóxicos y la formación de cristales intracelulares que puedan dañar al embrión.
Hasta la actualidad, se han descrito diferentes dispositivos como soportes para la vitrificación de embriones preimplantacionales y su posterior almacenaje. entre ellos, citar las rejillas de microscopia electrónica (EM grids), las open pulled straws (OPs) y los sistemas cryoloop, cryotop, cryoleaf, cryotip, nylon mesh y metal mesh, entre otros. Estos dispositivos se desarrollaron con el objetivo de maximizar la velocidad de enfriamiento utilizando volúmenes de solución muy pequeños, proporcionando resultados desiguales de supervivencia y desarrollo embrionario tras su utilización (revisado por Vajta and Kuwayama, 2006). La criotolerancia de los embriones obtenidos in vitro es mucho menor a la de los embriones obtenidos in vivo (Rizos et al., 2002). Se cree que esta diferencia puede depender bien de las condiciones de cultivo, especialmente cuando el medio de cultivo contiene suero que provoca una excesiva acumulación de lípidos durante el desarrollo embrionario (Rizos et al., 2003), o bien del estadio de desarrollo en el que son conservados. La crioconservación de embriones en fase de blastocisto es todavía un reto debido a sus características inherentes, tales como: 1) la penetración lenta de los CPAs en el blastocisto, en gran parte debido a su naturaleza multicelular, 2) la zona pelúcida (ZP), que actúa como una barrera fisiológica a la penetración de los CPAs, y 3) la presencia del blastocele. Diferentes autores realizaron la vitrificación de embriones bovinos en estadio de blastocisto expandido debido a que en este estadio la ZP es más delgada y permite mejor la penetración de los CPAs que en el estadio de blastocisto temprano (Rios et al., 2010; Sommerfeld y Niemann, 1999) mientras que otros autores abogan por la vitrificación de embriones en estadio de blastocisto temprano, pues consideran que el incremento de tamaño del blastocele de los blastocistos expandidos favorece la formación de cristales de hielo y, por tanto, de lesiones celulares durante la vitrificación (Cho et al., 2002; Vanderzwalmen et al., 2002). Por otra parte, diferentes estudios, como los de Hiraoka y colaboradores (2007) o Zech y colaboradores (2005) en embriones humanos, observaron que la rotura de la ZP mejoraba los porcentajes de gestación después de vitrificar embriones eclosionados, ya que, y según apuntan estos autores, la rotura de la ZP favorece la exposición del blastocele a los CPAs y facilita tanto la deshidratación como la posterior hidratación de éste.
La apoptosis es una respuesta celular a las condiciones subóptimas y a los diferentes tipos de estrés que un embrión puede sufrir durante el proceso de crioconservación. La viabilidad de los embriones y su potencial de desarrollo se han relacionado con la proporción entre el número de blastómeros con el DNA dañado (TUNEL positivo) y el número total de blastómeros, conocido como el índice de apoptosis, observándose un mayor índice de apoptosis en embriones de menor calidad. La evaluación de la fragmentación del DNA mediante [TdT]- dUTP nick (TUNEL) ha sido utilizada como un método fiable para la detección de la apoptosis en los embriones. Hasta la actualidad, existen pocos informes sobre los cambios producidos en los índices de apoptosis de los blastocistos bovinos en respuesta a los procesos de vitrificación/calentamiento (Behr et al., 2002; Pomar et al., 2005).
En estudios previos realizados por Morató y colaboradores (2008), se puso a punto con éxito el uso del cryotop como soporte para la vitrificación de ovocitos bovinos madurados in vitro, siendo éste el soporte que se utiliza de forma rutinaria en nuestro laboratorio. en el estudio que nos ocupa, se evaluó la capacidad de blastocistos bovinos producidos in vitro para sobrevivir a un proceso de vitrificación/calentamiento. Para ello, se vitrificaron los blastocistos en diferentes fases de desarrollo embrionario obtenidos tras 7 u 8 días de cultivo in vitro. Nuestro trabajo también fue diseñado para determinar los efectos que la fase de desarrollo o la duración del cultivo in vitro podían provocar sobre las tasas de fragmentación del DNA de embriones sometidos a un proceso de vitrificación /calentamiento.
MATERIALES Y MÉTODOS
A menos que se indique lo contrario, todos los productos químicos y los reactivos fueron adquiridos en Sigma Chemical Co. (St. Louis, MO, USA).
Obtención de los ovocitos y maduración in vitro
Para la producción in vitro de embriones, se ha seguido el protocolo descrito previamente por Rizos y colaboradores (2001). Para la obtención de ovocitos, se obtuvieron ovarios de hembras sacrificadas en un matadero local cercano a la Facultad de Veterinaria (UAB) y se transportaron al laboratorio en una solución salina tamponada (Phosphate Buffered Medium; PBS) a 35-37 ºC. Los complejos cúmulo-ovocito (COCs) se obtuvieron mediante aspiración de aquellos folículos que presentaban un diámetro comprendido entre 2 y 10 mm. después de tres lavados en PBS modificado (PBS suplementado con 36 mg/ml de piruvato sódico, 50 mg/ml de gentamicina y 0,5 mg/ml de albúmina sérica bovina (BSA)), grupos de hasta 50 COCs se colocaron en 500 μl de medio de maduración en placas de cuatro pocillos y se cultivaron durante 24 horas a 38,5 ºC, en una atmósfera con un 5% de CO2 en aire y máxima humedad. El medio de maduración estaba compuesto por medio TCM199 suplementado con un 10% (v/v) de suero fetal bovino (Fetal Calf Serum, FCS), 10 ng/ml de epidermal growth factor y 50 mg/ml de gentamicina.
Fecundación in vitro
Para la fecundación in vitro, los COCs se lavaron cuatro veces en PBS y después en el medio de fecundación, antes de ser colocados, en grupos de hasta 50, en placas de cuatro pocillos que contenían 250 μl de medio de fecundación (medio Tyrode’s suplementado con 25mM de bicarbonato sódico, 22mM lactato sódico, 1mM piruvato sódico, 6 mg/ml Bsa y 10 mg/ml heparina (Calbiochem, Darmstadt, Alemania)). Los espermatozoides móviles fueron obtenidos mediante la centrifugación de semen de toro congelado/descongelado (ASEAVA, Llanera, Asturias, España) a través de un gradiente discontinuo de Percoll (Pharmacia, Uppsala, Suecia) (2,5 ml de Percoll al 45% (v / v) y 2,5 ml de Percoll al 90 % (v / v)) durante 8 minutos a 700g y a temperatura ambiente (22-25 ºC). El pellet obtenido del fondo de la fracción 90%, se lavó en medio Tyrode’s tamponado con Hepes y se centrifugó a 100 g durante 5 min. La concentración de los espermatozoides se evaluó en un hematocitómetro y se diluyeron en un volumen apropiado de medio de fecundación para conseguir una concentración final de 2×106 espermatozoides/ml. Una alícuota de 250μl de esta suspensión se añadió a cada uno de los pocillos de fecundación para obtener una concentración final de 1×106 espermatozoides/ml. Las placas se incubaron a 38,5 ºC en una atmósfera con un 5% de CO2 en aire y máxima humedad. La variación individual entre toros se redujo mezclando muestras de semen de los mismos dos toros en todos los experimentos.
Después de la incubación con los espermatozoides durante 22 h, los presuntos cigotos fueron transferidos a gotas de 25μl de medio de cultivo de fluido oviductal sintético (Syntetic Oviductal Fluid; SOF) (1 embrión / μlitro) durante 7 u 8 días a 38,5 ºC, en un ambiente con un 5% CO2 y un 5% de O2 y máxima humedad. Las tasas de división se registraron a las 48 horas post-inseminación y el número de blastocistos obtenidos se evaluó a los 7 y 8 días después de la inseminación.
Clasificación de los blastocistos
Después de asegurar la calidad de los embriones (Gomez et al., 2008), los blastocistos fueron clasificados de acuerdo al grado de expansión del blastocele en 3 grupos, cada uno de la siguiente manera: 1) blastocistos no expandidos: el volumen del blastocele es menor al de la mitad del volumen total del blastocisto; 2) blastocistos expandidos: el volumen del blastocele es más de la mitad del volumen total del blastocisto, y 3) blastocistos eclosionando o eclosionados: blastocistos con la ZP abierta o sin ZP.
Vitrificación y calentamiento de los blastocistos
Los blastocistos fueron vitrificados utilizando el cryotop como soporte de vitrificación. El cryotop consiste en una película de polipropileno estrecha y delgada (0,4 mm de ancho, 20 mm de largo y 0,1 mm de grosor) unido a un mango de plástico duro. Para proteger el dispositivo de daños mecánicos durante el almacenamiento, se coloca un tubo de plástico para cubrirlo (Kitazato Supply Co., Fujinomiya, Japón). el medio de mantenimiento (MM) utilizado para formular la solución de vitrificación y de calentamiento consistía en medio TCM 199-Hepes con un 20% de FCS. Los blastocistos fueron transferidos a la solución de equilibrio (ES) compuesta por un 7,5% de etilenglicol (EG) y un 7,5% de dimetilsulfóxido (DMSO) en MM durante 10 – 15 min. A continuación, los blastocistos fueron trasladados a la solución de vitrificación (VS) compuesta por un 15% de EG, 15% DMSO y 0,5 M de sacarosa disuelta en MM. Después de una incubación de 30-40 s, los blastocistos (hasta un máximo de 2) se cargaron en el cryotop, se eliminó casi toda la solución sobrante hasta dejar solamente una capa delgada de medio que cubría el/los blastocisto/s y la muestra fue rápidamente sumergida en nitrógeno líquido. Posteriormente, se colocó la tapa de plástico. El proceso desde la inmersión en VS hasta el nitrógeno líquido se completó en menos de un minuto.
Durante el proceso de calentamiento, se retiró el protector de plástico del cryotop cuando todavía estaba sumergido en nitrógeno líquido. A continuación, el cryotop se sumergió directamente en la solución de calentamiento compuesta por 1 M sacarosa disuelta en MM. Después de 1 min, los blastocistos se colocaron en la solución de dilución, que contenía 0,5 M de sacarosa disuelta en MM. Los blastocistos fueron incubados durante 3 min realizando un suave pipeteo para facilitar la difusión de los CPAs fuera del embrión. Posteriormente, los blastocistos fueron incubados en MM durante 5 minutos. Y, finalmente, se pasaron de nuevo a MM durante 1 minuto antes de su transferencia al medio de cultivo SOF a 38,5 °C, en una atmósfera con un 5% CO2 y un 5% de O2 y máxima humedad. La supervivencia de los blastocistos se evaluó como la capacidad de re-expansión de los blastocistos después de 3 horas de incubación en medio SOF.
Valoración de la fragmentación del DNA de los embriones
Tras 3 horas de incubación en SOF, y una vez evaluada su supervivencia, los embriones fueron fijados en paraformaldehído al 4% en PBS durante 1 hora a temperatura ambiente. Después de la fijación, se lavaron por lo menos tres veces en pBs con 0,3% de polivinilpirrolidona (PVP) y se permeabilizaron en 0,5% Triton X-100 durante 2 min. Los embriones fueron lavados tres veces en PBS / PVP y se incubaron en el cóctel de TUNEL (in-situ Cell death detection kit; Roche Diagnostic Inc., Indianapolis, IN) a 37 ºC durante 1 h en oscuridad. Se incluyeron muestras control positivas y negativas en cada ensayo. Los blastocistos expuestos a DNasa I durante 15 min a temperatura ambiente se utilizaron como controles positivos y los blastocistos no expuestos a la enzima TdT terminal fueron los controles negativos. Los embriones fueron lavados en PBS y finalmente se transfirieron a la solución de Hoechst 33342 (25 mg/ml) durante 30 min a 37 ºC en oscuridad. Por último, los blastocistos fueron montados en portaobjetos tratados previamente con poli-L-lisina, se cubrieron con una gota de medio de montaje y un cubreobjetos y los bordes se sellaron con esmalte de uñas. Las muestras se almacenaron a -20 ºC en oscuridad hasta su análisis en el microscopio confocal. Las imágenes se capturaron con un microscopio Leica TCS-SP2 láser confocal de barrido (Leica Microsystems, Heidelberg). Las longitudes de onda de excitación de la pieza fueron 364 nm para la tinción de Hoechst y 488 nm para el FITC-TUNEL conjugado. Los núcleos fueron anotados ya sea como intactos (TUNEL (-), marca roja) o DNA fragmentados (TUNEL (+), marca verde) y contados. El índice apoptótico se calculó como la proporción de TUNEL (+) / número total de núcleos, y el índice de integridad del DNA se calculó como TUNEL (-) / número total de núcleos.
Análisis estadístico
Los datos fueron analizados utilizando el paquete de análisis estadístico systems (SAS, V8). Se obtuvieron al menos 10 réplicas de los datos. Los recuentos de células de los blastocistos en los diferentes grupos experimentales fueron analizados mediante ANOVA (PROC GLM). Las comparaciones de las tasas de supervivencia de los blastocistos después del proceso de vitrificación/calentamiento entre los distintos grupos de blastocistos se llevaron a cabo mediante el test de chi cuadrado. Los datos de supervivencia se transformaron en porcentajes de frecuencia, mientras que el recuento de células de los blastocistos fue expresado como valor absoluto. El nivel de significación estadística se fijó en p <0,05.
RESULTADOS
Experimento 1: porcentajes de supervivencia después de la vitrificación de los blastocistos según su estadio de desarrollo o permanencia en cultivo in vitro.
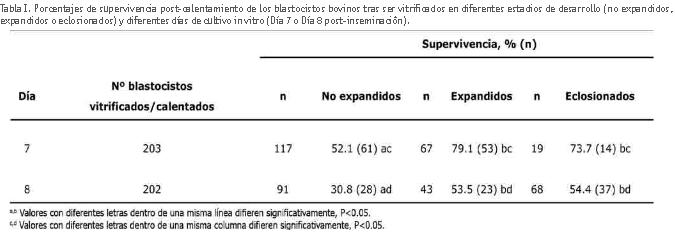
La tabla I muestra los resultados correspondientes a los porcentajes de supervivencia post-calentamiento de los blastocistos bovinos tras ser vitrificados en diferentes estadios de desarrollo o tras diferente duración del cultivo embrionario in vitro. Así, se observó un aumento significativo de la tasa de supervivencia cuando los blastocistos fueron vitrificados en estadio de blastocisto expandido (79,1% y 53,5%) o eclosionado (73,7% y 54,4%) en comparación con los blastocistos no expandidos (52,1% y 30,8%) (días 7 y 8 post-inseminación, respectivamente). No se observaron diferencias significativas en los porcentajes de supervivencia entre los blastocistos vitrificados en el estadio embrionario expandido o eclosionado. Cuando se analizó el efecto del tiempo de cultivo embrionario in vitro, las tasas de supervivencia fueron significativamente más altas en aquellos blastocistos obtenidos y vitrificados en día 7 del cultivo embrionario (52,1%, 79,1% y 73,7%) comparado con los blastocistos obtenidos en día 8 (30,8%, 53,5% y 54,4%).
Experimento 2: Índice de integridad del DNA de las células de los blastocistos vitrificados según su estadio de desarrollo o permanencia en cultivo in vitro.
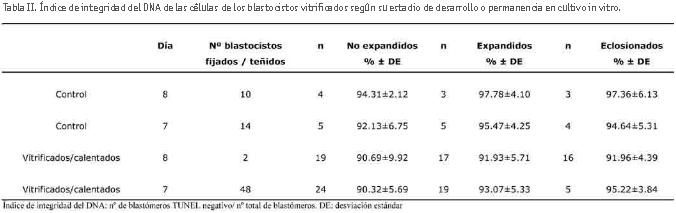
El daño celular en blastocistos bovinos vitrificados se evaluó a las 3 horas postcalentamiento mediante la tinción de TUNEL. Se compararon las tasas de integridad del DNA entre los blastocistos del grupo control (no vitrificados) y los blastocistos vitrificados en estadio de blastocisto no expandido, expandido o eclosionado (tabla II).
Los resultados muestran una ligera disminución en el índice de integridad del DNA en respuesta al proceso de vitrificación/calentamiento en comparación con el grupo de embriones no vitrificados (control), disminución que no fue significativa. No se observaron diferencias significativas entre los distintos estadios de desarrollo de los blastocistos, ni entre la duración del cultivo in vitro. La figura 1 muestra imágenes de microscopía confocal donde se observan blastocistos teñidos con la tinción de TUNEL.
DISCUSIÓN
La crioconservación de los embriones bovinos producidos in vitro (PIV) es un requisito previo para su uso a gran escala comercial. Las tasas de gestación obtenidas después de la transferencia de embriones bovinos PIV congelados son relativamente bajas, lo que supone un claro indicio de su menor calidad en comparación con aquellos embriones obtenidos in vivo. 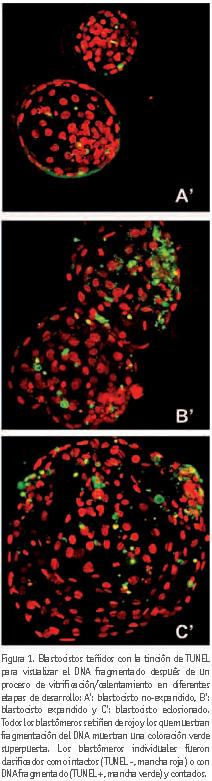 La crioconservación de embriones en la etapa de blastocisto permite una mejor selección de los embriones y sirve para aumentar al máximo el potencial de implantación de la posterior transferencia del embrión. El grado de desarrollo del blastocisto en el momento de la vitrificación puede ser un factor clave que influya en los resultados. En este estudio, se observó un aumento significativo de la tasa de supervivencia de aquellos blastocistos vitrificados en estadio de blastocisto expandido o eclosionado. Además, se observaron tasas similares en la integridad del DNA entre los blastocistos vitrificados y aquellos blastocistos frescos (no vitrificados). Entre los numerosos factores que afectan la supervivencia a la crioconservación, distintos estudios han descrito que tanto la edad, la etapa de desarrollo, la calidad del embrión o las interacciones entre estos factores son muy importantes durante la crioconservación de embriones bovinos PIV (Carvalho et al., 1996; Mahmoudzadeh et al., 1995; Pugh et al., 1998; Saha et al., 1996).
La crioconservación de embriones en la etapa de blastocisto permite una mejor selección de los embriones y sirve para aumentar al máximo el potencial de implantación de la posterior transferencia del embrión. El grado de desarrollo del blastocisto en el momento de la vitrificación puede ser un factor clave que influya en los resultados. En este estudio, se observó un aumento significativo de la tasa de supervivencia de aquellos blastocistos vitrificados en estadio de blastocisto expandido o eclosionado. Además, se observaron tasas similares en la integridad del DNA entre los blastocistos vitrificados y aquellos blastocistos frescos (no vitrificados). Entre los numerosos factores que afectan la supervivencia a la crioconservación, distintos estudios han descrito que tanto la edad, la etapa de desarrollo, la calidad del embrión o las interacciones entre estos factores son muy importantes durante la crioconservación de embriones bovinos PIV (Carvalho et al., 1996; Mahmoudzadeh et al., 1995; Pugh et al., 1998; Saha et al., 1996).
Varios estudios han descrito diferencias en las tasas de supervivencia o porcentajes de eclosión después de la crioconservación de blastocistos obtenidos tras diferentes tiempos de cultivo in vitro, haciendo hincapié en que la duración del cultivo de embriones afecta a la criotolerancia de los blastocistos producidos (Cseh et al., 1996; Gustafsson et al., 2001; Hasler et al., 1995; Hasler et al., 1997; Havlicek et al., 2009). Gustafsson y colaboradores (2001) observaron que los embriones obtenidos después de 7 días de cultivo in vitro mostraban 3 veces más posibilidades de sobrevivir a la congelación y descongelación que aquellos embriones congelados en los días 8-9 de cultivo embrionario in vitro, independientemente de su fase de desarrollo. En un estudio más reciente, Havlicek y col. (2009) describieron resultados similares en embriones bovinos crioconservados mediante técnicas de congelación lenta. Observaciones similares se obtuvieron cuando la vitrificación fue utilizada como método de crioconservación de embriones bovinos (Mahmoudzadeh et al., 1995; Ohboshi et al., 1997; Saha and Suzuki, 1997). Nuestros resultados están de acuerdo con estas observaciones, ya que las tasas de supervivencia significativamente más altas se registraron en aquellos blastocistos obtenidos y vitrificados en día 7 de cultivo in vitro. En contraste, Dinnyés y colaboradores (1999) observaron que la supervivencia de los blastocistos vitrificados en día 7 o en día 8 era similar.
En nuestros experimentos, la supervivencia está relacionada con una fase embrionaria más avanzada en un día determinado. Las razones de las altas tasas de supervivencia de los embriones en sus etapas más avanzadas aún quedan por aclarar. En nuestro estudio se observó que cuando el volumen del blastocele era mayor, la deshidratación de éste era más pronunciada y constante. Estos blastocistos presentaban una ZP más delgada y posiblemente más permeable que la de aquellos blastocistos en fases tempranas (no expandidos). En contraste con nuestros resultados, algunos estudios han descrito que los blastocistos expandidos muestran tasas de supervivencia inferiores después de los procesos de vitrificación en comparación con los blastocistos no expandidos (Cho et al., 2002; Vanderzwalmen et al., 2002). En este tipo de blastocistos, que presenta un blastocele mayor que el de los no expandidos, se pueden formar cristales de hielo durante la congelación, provocando daños mecánicos. Considerando este factor, se ha postulado que la reducción artificial del contenido líquido del blastocele podría mejorar la eficiencia de la vitrificación (Hiraoka et al., 2004a; Son et al., 2003; Vanderzwalmen et al., 2002). Sin embargo, los resultados obtenidos en el presente estudio muestran que la vitrificación de los blastocistos expandidos mejoró los resultados del calentamiento sin la necesidad de la aspiración del blastocele.
Son pocos los trabajos relacionados con la vitrificación de blastocistos en estadio de eclosión o completamente eclosionados (Galan et al., 2003; Hiraoka et al., 2004b; Zech et al., 2005). Las técnicas de reproducción asistida deben considerar la posibilidad de crioconservar blastocistos con una ZP abierta o completamente eclosionados como un reto importante, especialmente cuando se trata de embriones procedentes de cultivos embrionarios prolongados o sometidos a un diagnóstico genético preimplantacional. Los buenos resultados de supervivencia a la descongelación obtenidos en este estudio tras la vitrificación de embriones eclosionados demuestran que la presencia de una ZP intacta no es necesaria para que la vitrificación tenga éxito, y son similares a los obtenidos en estudios donde se realizó una biopsia embrionaria previa al proceso de congelación lenta (Gustafsson et al., 1994; Schmidt et al., 1992) o de vitrificación (Agca et al., 1995).
Una vez evaluada la supervivencia de los blastocistos bovinos, procedimos a evaluar su integridad mediante la determinación del índice de apoptosis. El índice de apoptosis de un blastocisto es un factor importante que ha sido correlacionado negativamente con el potencial de desarrollo embrionario (Makarevich and Markkula, 2002; Spanos et al., 2002). Después de la crioconservación, los blastocistos bovinos inician una reorganización celular, particularmente a nivel del citoesqueleto, el cual puede estar parcialmente despolimerizado debido a la presencia de los CPAs o al proceso de crioconservación (Dobrinsky, 1996). Por otra parte, las membranas celulares también pueden sufrir diferentes lesiones durante el proceso de crioconservación (Acker and Mcgann, 2001; Wolfe and Bryant, 1999), cuya magnitud puede influenciar la supervivencia embrionaria. A pesar de que nuestros resultados no muestran diferencias en los niveles de apoptosis entre embriones frescos y vitrificados, se debe tener en cuenta que se analizó la fragmentación del DNA 3 horas después del calentamiento, lo que nos lleva a hipotetizar que o bien el daño provocado por el proceso de vitrificación a nivel de DNA fue transicional y que las células pudieron restablecer su integridad durante el periodo post-calentamiento, o que dicho periodo no fue suficiente para cuantificar la cantidad de daño producido por el proceso de vitrificación/calentamiento. Utilizando diferentes criosoportes, Park y colaboradores (2006) sí observaron un índice apoptótico significativamente superior cuando se vitrificaron blastocistos bovinos PIV en día 7 en pajuelas de 0,25ml (11,9%) o en pajuelas minimum volume cooling (MVC) (11,0%), comparado con los embriones no vitrificados (3,0%).
En conclusión, el tiempo de cultivo embrionario in vitro para obtener los blastocistos, así como el estadio de desarrollo de éstos, son factores importantes a considerar durante el proceso de vitrificación de embriones bovinos producidos in vitro. Más específicamente, nuestros resultados indican que la vitrificación utilizando el cryotop como soporte parece ser particularmente útil para la criopreservación de blastocistos bovinos con un alto grado de expansión (blastocistos expandidos o eclosionados), y, principalmente, en aquellos blastocistos vitrificados en día 7 post- inseminación.
AGRADECIMIENTOS
Este estudio ha sido financiado por Ministerio Español de Educación y Ciencia (número de proyecto: AGL2007-60227/GAN) y de la Universidad Autónoma de Barcelona (número de la donación: EME2004-25).
Referencias
Acker JP, McGann Le. Membrane damage occurs during the formation of intracellular ice. Cryo Letters 2001; 22(4):241-254.
Agca y, Monson RL, northey DL, Schaefer DM, Rutledge JJ. Post-thaw survival and pregnancy rates of biopsed, sexed and vitrified bovine embryos. Theriogenology 1995; 43:153.
Behr B, Gebhardt J, Lyon J, Milki AA. Factors relating to a successful cryopreserved blastocyst transfer program. Fertil Steril 2002; 77(4):697-699.
Berthelot F, Martinat-Botte F, Locatelli A, Perreau C, Terqui M. Piglets born after vitrification of embryos using the open pulled straw method. Cryobiology 2000; 41(2):116-124.
Carvalho RV, Del Campo MR, Palasz AT, Plante y, Mapletoft RJ. Survival rates and sex ratio of bovine IVe embryos frozen at different developmental stages on day 7. Theriogenology 1996; 45(2):489-498.
Cseh S, Wang G, Corselli J, nehlsenCannarella SL, Bailey LL, Szalay AA. Rapid freezing of mouse embryos in ethylene glycol at different preimplantation stages. Acta Vet Hung 1996; 44(4):457-465.
Cho SK, Cho SG, Bae IH, Park CS, Kong IK. Improvement in post-thaw viability of in vitro-produced bovine blastocysts vitrified by glass micropipette (GMP). Anim Reprod Sci 2002; 73(3-4):151-158.
Dinnyes A, Lonergan P, Fair T, Boland MP, Yang X. Timing of the first cleavage postinsemination affects cryosurvival of in vitro-produced bovine blastocysts. Mol Reprod Dev 1999; 53(3):318-324.
Dobrinsky JR. Cellular approach to cryopreservation of embryos. Theriogenology 1996; 45(1):17-26.
Galan A, escriba MJ, Gamiz P, Mercader A, Rubio C, Crespo J. High survival rate of human blastocysts after preimplantation genetic diagnosis and vitrification. Human Reproduction 2003; 18(Suppl. 1):141.
Gomez e, Rodriguez A, Munoz M, Caamano Jn, Hidalgo CO, Moran e, et al. Serum free embryo culture medium improves in vitro survival of bovine blastocysts to vitrification. Theriogenology 2008; 69(8):1013-1021.
Gustafsson H, Jaakma U, Shamsuddin M. Viability of fresh and frozen-thawed biopsied bovine embryos. Acta Vet Scand 1994; 35(3):217-222.
Gustafsson H, Larsson B, Shamsuddin M, Jaakma U, emanuelson U. Factors affecting the survival of frozen thawed bovine in vitro produced blastocysts. Asian-Aust J Anim Sci 2001; 14(1):7-12.
Hasler JF, Henderson WP, Hurtgen PJ, Jin ZQ, McCauley AD, Mower SA, et al. Trimmer , Production freezing and transfer of bovine IVF embryos and subsequent calving results. Theriogenology 1995; 43:141-152.
Hasler JF, Hurtgen PJ, Jin ZQ, Stokes Je. Survival of IVF-derived bovine embryos frozen in glycerol or ethylene glycol. Theriogenology 1997; 48(4):563-579.
Havlicek V, Kuzmany A, Cseh S, Brem G, Besenfelder U. The effect of Long-term In Vivo Culture in Bovine Oviduct and Uterus on the Development and Cryo-tolerance of In Vitro Produced Bovine embryos. Reprod Domest Anim 2009.
Hiraoka K, Hiraoka K, Kinutani M, Kinutani K. Blastocoele collapse by micropipetting prior to vitrification gives excellent survival and pregnancy outcomes for human day 5 and 6 expanded blastocysts. Hum Reprod 2004a; 19(12):2884-2888.
Hiraoka K, Hiraoka K, Kinutani M, Kinutani K. Case report: successful pregnancy after vitrification of a human blastocyst that had completely escaped from the zona pellucida on day 6. Hum Reprod 2004b; 19(4):988-990.
Hiraoka K, Hiraoka K, Kinutani M, Kinutani K. Vitrification of human hatched blastocysts: a report of 4 cases. J Reprod Med 2007; 52(5):413-415.
Mahmoudzadeh AR, Van Soom A, Bols P, ysebaert MT, de Kruif A. Optimization of a simple vitrification procedure for bovine embryos produced in vitro: effect of developmental stage, two-step addition of cryoprotectant and sucrose dilution on embryonic survival. J Reprod Fertil 1995; 103(1):33-39.
Makarevich AV, Markkula M. Apoptosis and cell proliferation potential of bovine embryos stimulated with insulin-like growth factor I during in vitro maturation and culture. Biol Reprod 2002; 66(2):386-392.
Menezo yJ. Blastocyst freezing. eur J Obstet Gynecol Reprod Biol 2004; 115 Suppl 1:S12-15.
Morató R, Izquierdo D, Paramio MT, Mogas T. Cryotops versus open-pulled straws (OPS) as carriers for the cryopreservation of bovine oocytes: effects on spindle and chromosome configuration and embryo development. Cryobiology 2008; 57(2):137-141.
Ohboshi S, Fujihara n, yoshida T, Tomogane H. Usefulness of polyethylene glycol for cryopreservation by vitrification of in vitroderived bovine blastocysts. Anim Reprod Sci 1997; 48(1):27-36.
Park Sy, Kim ey, Cui XS, Tae JC, Lee WD, Kim nH, et al. Increase in DnA fragmentation and apoptosis-related gene expression in frozen-thawed bovine blastocysts. Zygote 2006; 14(2):125-131.
Pereira RM, Carvalhais I, Pimenta J, Baptista MC, Vasques MI, Horta Ae, et al. Biopsied and vitrified bovine embryos viability is improved by trans10, cis12 conjugated linoleic acid supplementation during in vitro embryo culture. Anim Reprod Sci 2008; 106(3-4):322-332.
Pomar FJ, Teerds KJ, Kidson A, Colenbrander B, Tharasanit T, Aguilar B, et al. Differences in the incidence of apoptosis between in vivo and in vitro produced blastocysts of farm animal species: a comparative study. Theriogenology 2005; 63(8):2254-2268.
Pugh PA, Ankersmit Ae, McGowan LT, Tervit HR. Cryopreservation of in vitro-produced bovine embryos: effects of protein type and concentration during freezing or of liposomes during culture on post-thaw survival. Theriogenology 1998; 50(3):495-506.
Rios GL, Mucci nC, Kaiser GG, Alberio RH. Effect of container, vitrification volume and warming solution on cryosurvival of in vitro-produced bovine embryos. Anim Reprod Sci 2010; 118(1):19-24.
Rizos D, Gutierrez-Adan A, Perez-Garnelo S, De La Fuente J, Boland MP, Lonergan P. Bovine embryo culture in the presence or absence of serum: implications for blastocyst development, cryotolerance, and messenger RnA expression. Biol Reprod 2003; 68(1):236-243.
Rizos D, Ward F, Boland MP, Lonergan P. effect of culture system on the yield and quality of bovine blastocysts as assessed by survival after vitrification. Theriogenology 2001; 56(1):1-16.
Rizos D, Ward F, Duffy P, Boland MP, Lonergan P. Consequences of bovine oocyte maturation, fertilization or early embryo development in vitro versus in vivo: implications for blastocyst yield and blastocyst quality. Mol Reprod Dev 2002; 61(2):234-248.
Saha S, Rajamahendran R, Boediono A, Sumantri C, Suzuki T. Viability of bovine blastocysts obtained after 7, 8 or 9 days of culture in vitro following vitrification and one-step rehydration. Theriogenology 1996; 46(2):331-343.
Saha S, Suzuki T. Vitrification of in vitro produced bovine embryos at different ages using one- and three-step addition of cryoprotective additives. Reprod Fertil Dev 1997; 9(7):741-746.
Schmidt M, Avery B, Smith SD, Purwantara B, Greve T. The freezability of biopsied bovine embryos. Theriogenology 1992; 38(4):615-621.
Sommerfeld V, niemann H. Cryopreservation of bovine in vitro produced embryos using ethylene glycol in controlled freezing or vitrification. Cryobiology 1999; 38(2):95-105.
Son Wy, yoon SH, yoon HJ, Lee SM, Lim JH. Pregnancy outcome following transfer of human blastocysts vitrified on electron microscopy grids after induced collapse of the blastocoele. Hum Reprod 2003; 18(1):137-139.
Spanos S, Rice S, Karagiannis P, Taylor D, Becker DL, Winston RM, et al. Caspase activity and expression of cell death genes during development of human preimplantation embryos. Reproduction 2002; 124(3):353-363.
Vajta G, Holm P, Kuwayama M, Booth PJ, Jacobsen H, Greve T, et al. Open Pulled Straw (OPS) vitrification: a new way to reduce cryoinjuries of bovine ova and embryos. Mol Reprod Dev 1998; 51(1):53-58.
Vajta G, Kuwayama M. Improving cryopreservation systems. Theriogenology 2006; 65(1):236-244.
Vanderzwalmen P, Bertin G, Debauche C, Standaert V, van Roosendaal e, Vandervorst M, et al. Births after vitrification at morula and blastocyst stages: effect of artificial reduction of the blastocoelic cavity before vitrification. Hum Reprod
2002; 17(3):744-751.
Wolfe J, Bryant G. Freezing, drying, and/or vitrification of membrane- solute-water systems. Cryobiology 1999; 39(2):103-129.
Zech nH, Lejeune B, Zech H, Vanderzwalmen P. Vitrification of hatching and hatched human blastocysts: effect of an opening in the zona pellucida before vitrification. Reprod Biomed Online 2005; 11(3):355-361.