ESTUDIO DEL EFECTO DE PROLONGAR 1 HORA EL TIEMPO DE INCUBACIÓN EN LA TÉCNICA DE SWIM-UP
Núria Alcañiz2, Ivan Solvas1, Mark Grossmann1, Francesca Vidal2, M Carme Pons1
1Unitat de Reproducció Assistida. Centro Médico Teknon (Barcelona) ura@cmteknon.com. 2Unitat de Biologia Cel·lular. Universitat Autònoma de Barcelona
Resumen
Objetivo: Determinar el efecto del tiempo de incubación prolongado sobre la recuperación de espermatozoides móviles en la técnica de swim-up.
Ubicación: Laboratorio de la Unitat de Reproducció Assistida de Centro Médico Teknon (Barcelona). Estudio incluido en la asignatura “Prácticas en empresa” de la titulación de Biología de la Universitat Autònoma de Barcelona (NA).
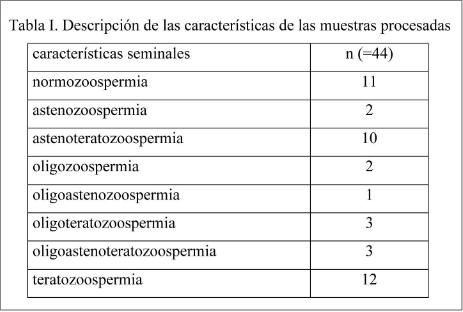
Material: 44 muestras de semen con un volumen ≥1,5ml y una concentración y movilidad de espermatozoides que permitiese su preparación mediante la técnica de swim-up.
Diseño: Preparar en paralelo dos fracciones de semen según el protocolo de swim-up descrito por la OMS y comparar la recuperación espermática (REM).
- Grupo 1 (incubación estándar de 1h): 0,75 ml de semen se reparten en 3 tubos y se cubren con 0,5 ml de medio de cultivo por tubo. Incubación durante 60 min a 37ºC y 6%CO2, en posición inclinada de 45º.
-Grupo 2 (incubación prolongado de 2h): Misma preparación pero con un período de incubación de 2h en las mismas condiciones.
Medidas principales: Se valora volumen, recuento espermático, movilidad y morfología en cada muestra de semen y REM después del período de incubación.
Conclusión: No se hallaron diferencias estadísticamente significativas entre el REM de los dos grupos, por lo que no se considera útil aumentar el tiempo de cultivo en ninguna muestra.
Palabras clave: swim-up, tiempo de incubación y REM
Abstract
Objective: To assess the effect of incubation time (1h versus 2h) during swim-up technique on motile spermatozoa recovery.
Centre: Laboratory of Unitat de Reproducció Assistida (Centro Médico Teknon, Barcelona). This study is included in the Biology degree at Universitat Autònoma de Barcelona of one of us (NA).
Material: 44 semen samples with volume ≥1,5ml and appropiate spermatozoa concentration and motility to perfom the swim-up technique.
Experimentl design: Two aliquots from the semen sample were processed in parallel as follows:
-Method 1 (1h standard incubation period): 0,75 ml from the original semen sample were gently added to fresh medium at the bottom of 3 plastic tubes then placed in 45º angle for incubation during 60 min (37ºC and 6%CO2).
-Method 2 (2h incubation period): 3 plastic tubes filled in similar way were incubated during 2h under the same in vitro conditions.
Main mesurements: Volume, sperm count, motility and morphology in semen samples and REM in the recovered fractions.
Conclusión: There are no statistically significant differences between the 2 groups. So it is useless to extend the period of incubation in any semen sample.
Key words: swim-up, period of incubation, sperm count and motility after incubation
INTRODUCCIÓN
La técnica de preparación del semen para Reproducción Asistida más utilizada en el laboratorio de reproducción asistida y la recomendada por la Organización Mundial de la Salud (WHO, 1999) es el Swim-up o técnica de migración ascendente.
Este protocolo se recomienda por su sencillez y rapidez ya que la selección de los espermatozoides se realiza de forma pasiva aprovechando su capacidad natatoria para migrar hacia el medio de cultivo.
Dicha capacidad natatoria depende de varios factores como el porcentaje de espermatozoides móviles y el tipo de movilidad de éstos, así como de la composición del medio de cultivo y del tiempo de incubación (Andolz and Bielsa, 1995).
La técnica de swim-up evita la excesiva manipulación de la muestra reduciendo el riesgo de contaminación externa (Inaudi et al., 2002) así como también reduce la generación de Especies Reactivas de Oxígeno (ROS) responsables de provocar daños en la membrana celular de los espermatozoides (Aitken and Clarson, 1988) y disminuir la función espermática.
Según Andolz y Bielsa los espermatozoides seleccionados mediante la técnica de swim-up presentarían una mayor estabilidad nuclear así como una elevada tasa de penetración en ovocitos de hámster (Andolz and Bielsa, 1995), aunque Sakkas et al. (2000) publicaron conclusiones opuestas ya que obtienen mayores porcentajes de espermatozoides con integridad de DNA usando, como método de capacitación, gradientes de densidad.
A pesar de que el swim-up es una técnica que presenta múltiples ventajas, generalmente no se considera la técnica de elección en la preparación de muestras de semen de baja calidad ya que su rendimiento es inferior al obtenido por la técnica de separación por gradientes de densidad.
Por lo tanto, en un intento por aprovechar las ventajas que ofrece la técnica de swim-up, nuestro objetivo fue valorar la utilidad de prolongar el tiempo de incubación sobre el rendimiento final, especialmente en muestras de semen de baja calidad.
Por ello planteamos comparar los resultados de incubar una alícuota de cada una de las muestras de semen durante una hora (protocolo OMS; WHO, 1999), con los resultados de incubar una segunda alícuota de la misma muestra en las mismas condiciones de cultivo aunque durante un período más largo, en concreto de dos horas.
MATERIAL Y MÉTODOS
Las muestras de semen estudiadas provinieron de pacientes que consultan por esterilidad en la Unidad de Reproducción Asistida de Centro Médico Teknon, durante el periodo comprendido entre Junio y Octubre de 2006.
Cada muestra fue recogida en un frasco estéril entre 48 horas y no más de 7 días de abstinencia sexual, siempre por masturbación y sin utilizar lubricantes artificiales (WHO, 1999).
Las muestras fueron analizadas en la primera hora post-recolección siguiendo los criterios de la OMS (WHO, 1999), con valoración de la concentración espermática mediante Cámara de Neubauer Improved y estimación subjetiva de la movilidad.
En total se aceptaron 44 muestras cuya clasificación según los parámetros seminales OMS se muestra en la Tabla I.
De cada muestra se utilizaron dos alícuotas que fueron procesadas independientemente mediante la técnica de swim-up, e incubadas durante una o dos horas, respectivamente.
Las muestras se procesaron según el protocolo establecido en nuestro laboratorio (Solvas et al., 2002). Brevemente, 1,5 ml de medio de cultivo SpermRinse (Vitrolife‚) se repartieron en 3 tubos de fondo cónico (Nunc, 347856) y en cada uno de ellos cuidadosamente se depositaron 0,25 ml de semen.
Los tubos se incubaron en posición inclinada a 37ºC y 6% CO2 durante el tiempo establecido tras lo cual los 2/3 superiores del sobrenadante se recogen en un único tubo. Se valoró la muestra recuperada (volumen, recuento y movilidad) y se calculó el REM.
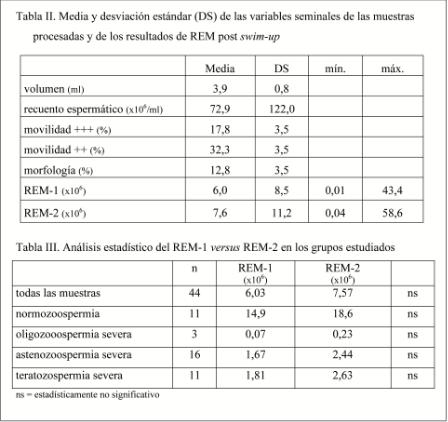
Definimos REM como el recuento de espermatozoides con movilidad traslativa que se obtienen tras la técnica de preparación de semen. Así, REM-1 corresponde al número de espermatozoides móviles recuperados de la incubación de una alícuota durante 1 hora y REM- 2 al número de espermatozoides móviles recuperados de la incubación de la otra alícuota durante dos horas.
Tras la incubación una persona distinta a la que preparó las muestras se encargó de estimar la movilidad espermática, obteniéndose así una valoración “a ciegas”.
El análisis estadístico se realizó con el programa Instat de GraphPad, que comparó los resultados obtenidos en una y dos horas de incubación, es decir, se comparó el REM- 1 frente al REM-2 con el test U de Mann-Whitney y nivel de significación de P≤0,01.
RESULTADOS
La tabla II muestra las medias de los parámetros seminales de las muestras de semen procesadas y el rendimiento global obtenido con cada uno de los tiempos de incubación.
Como se ilustra en la tabla III, la comparación de las medias de REM-1 y de REM-2 analizando el conjunto de todas las muestras no dio diferencias estadísticamente significativas. Tampoco se observaron diferencias cuando se analizaron subgrupos en función de la alteración seminal que presentara la muestra: oligo-, asteno- y teratozoospermia severa.
DISCUSIÓN
En este trabajo valoramos si se podía mejorar la calidad de la muestra de espermatozoides recuperados prolongando en 1 hora el periodo de incubación en el protocolo de swim-up, protocolo de capacitación con las mínimas manipulaciones posibles.
Aunque se sabe que una incubación prolongada de los espermatozoides humanos puede tener efectos deletéreos sobre la función espermática, nuestro estudio no detecta diferencias en el REM, de manera que concluimos que un tiempo de incubación de 2 h no es tiempo suficientemente largo como para disminuir la calidad de los espermatozoides recuperados, pero tampoco para mejorarla.
En la literatura científica no hemos hallado estudios recientes sobre el efecto del tiempo de incubación en swim-up. Calamera et al., publicaron un artículo donde analizaban el efecto de la incubación prolongada en cuatro tiempos consecutivos (a las 1, 5, 23 y 47 horas) sobre diferentes variables (movilidad espermática, hiperactividad, niveles de ROS…). Y centrándonos en la movilidad espermática en la segunda observación, a las cinco horas, ya detectan una disminución del porcentaje de espermatozoides móviles que se acentúa a lo largo del tiempo de incubación (Calamera et al., 2001).
Nuestros datos no son comparables con los de Calamera et al., ya que nuestro intervalo de estudio (1 y 2 h) queda entre sus dos primeras observaciones (1 y 5 h) en un intervalo en el que no realizan valoraciones.
Podría pues argumentarse que se podría alargar el tiempo de incubación más allá de las 2 h pero menos de 5 h para obtener mejores rendimientos o bien para detectar efectos adversos (ya que en nuestro estudio no observamos diferencias), pero consideramos que esa opción carecería de interés práctico ya que no podría trasladarse a la rutina diaria de un laboratorio de FIV.
Como conclusión podemos afirmar que en el laboratorio de FIV, donde el tiempo es algo muy importante, no merece la pena una incubación prolongada de la muestra de semen sea cual sea la calidad de ésta puesto que en este trabajo no encontramos diferencias en la calidad de la muestra recuperada.
Referencias
Aitken RJ, Clarkson JS. Significance of reactive oxygen species and antioxidants in defining the efficacy of sperm preparation techniques. J Androl 1988; 9:367-76.
Aitken RJ, West KM. Analisis of the relationship between reactive oxygen species production and leucocyte infiltration in fractions of human semen separated on Percoll gradients. Int J Androl 1990; 13:4533-51.
Andolz P, Bielsa MA. Semen Humano (Atlas y manual). 1ª ed. Madrid: Editorial Garrisi; 1995. ISBN:84-7391-271-9.
Calamera JC, Fernández PJ, Buffone MG, Acosta AA, Doncel GF. Effects of long-term in vitro incubation of human spermatozoa: functional parameters and catalase effect Andrologia 2001; 33:79-86.
Inaudi P, Petrilli S, Joghtapour A, Trusso P, Petraglia F. Reduction of steps in the preparation of motile sperm for intrauterine insemination does not reduce efficacy of the procedure: simplified onestep swim-up method versus classic swim-up. Hum. Reprod 2002; 17:1288-91.
Jones R, Mann T, Sherins RJ. Peroxidative breakdown of phospholipids in human spermatozoa, spermicidal properties of fatty acid peroxides and protective action of seminal plasma. Fertil Steril; 31:531-37.
Sakkas D, Manicardi GC, Tomlison M, Mandrioli M, Bizzarro D, Bianchi PG, Bianchi U. The use of two density gradient centrifugation techniques and swim-up method to separate spermatozoa with chromatin and nuclear DNA anomalies. Hum Reprod 2000;15:1112-6.
Solvas I, Grossmann M, Santaló J, Pons MC. Estudio comparativo entre dos métodos de swim-up. Revista ASEBIR 2002; vol. 7 (2):28-32.
WHO. Laboratory manual for the examination for human semen and sperm-mucus interaction. 4th ed. Cambridge University Press; 1999. ISBN: 0-521-64599-9.0