CONSECUENCIAS DE LA ROTURA SIN SALTO (SS) DE LA MEMBRANA DE LOS OVOCITOS TRAS EL ICSI.
Martín M., Florensa M., Esbert M., Riqueros., M., Calderón A., Múgica A., Ballesteros A., Calderón, G.
IVI-Barcelona, Ronda General Mitre 14, 08017. Barcelona. Correspondencia: mmartin@ivi.es
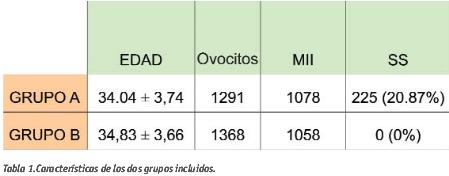
Resumen: El objetivo de este estudio es evaluar de manera retrospectiva las consecuencias de la rotura, tipo Sin Salto (SS), de la membrana citoplasmática del ovocito durante la microinyección citoplasmática de espermatozoide (ICSI). Se han incluido 226 ciclos de ICSI realizados desde octubre del 2004 hasta diciembre 2006 en el IVI-Barcelona. Se han dividido en dos grupos: grupo A (n = 111 ciclos, 1291 ovocitos, 225 ovocitos con rotura SS) en el que hay al menos un ovocito dentro de la cohorte con rotura SS y grupo B (n = 155 ciclos, 1348 ovocitos,) en el que no ha habido ningún ovocito con rotura SS en la cohorte. De los dos grupos se han calculado y comparado la tasa de degeneración ovocitaria y la tasa de fecundación. Una vez comprobada la fecundación se ha evaluado la evolución de los embriones en día 2 y día 3, siendo en este día cuando se realiza la transferencia embrionaria y, en caso de tener embriones sobrantes de suficiente calidad, se ha procedido a su congelación. Se ha observado un aumento significativo (p<0.05) en la degeneración de ovocitos del grupo A. Un 10% de los ovocitos con rotura tipo SS degeneran vs un 4% de los ovocitos que degeneran sin haber sufrido este tipo de rotura. Del mismo modo, se observa una diferencia significativa (p<0.05) en la tasa de fecundación. Se encuentra una fecundación del 69% en los ovocitos que han tenido rotura SS vs un 75% de fecundación en los ovocitos del grupo B. Los resultados muestran que, una vez conseguida la fecundación, la probabilidad que un embrión sea transferido es independiente del tipo de rotura de la membrana ovocitaria, (28.2% en grupo A vs. 33.6% en grupo B). En conclusión, según este estudio, la rotura del oolema de tipo SS no compromete al desarrollo ni a la calidad embrionaria, una vez superada la fecundación.
Consequences of a sudden breakage (SS) of oocyte membrane after ICSI
Summary: The aim of this study was to asses the consequences of a sudden breakage (SS) of oocyte membrane while performing an intracytoplasmic sperm injection (ICSI). A retrospective analysis was performed on 226 cycles of ICSI in a 2 year period in our clinic. We categorized them in 2 groups: group A in which at least one oocyte presents SS breakage (n = 111 cycles, 1291 oocytes, 225 SS membrane breakage oocytes) and group B in which no oocytes present SS breakage (n=1555 cycles, 1348 oocytes). We evaluate degeneration and fertility rate of each group. Once fertilization was assessed, embryo quality was evaluated in Day2 and D3. In this day, we performed the embryo transfer and in case of having a surplus of good quality embryos we proceed to freeze them. Degeneration rate was significantly higher (p<0.05) in group A compared with group B (10% vs 4% respectively). Fertility rate followed an exactly inverse pattern, being significantly lower (p<0.05) in group A compared with group B (69% vs 75% respectively). Our data showed that, once fertilization was achieved, the probability of one specific embryo to reach the transfer does not depend on the kind of oocyte membrane breakage (28.2% Group A vs. 33.6% in Group B). Thus, these data indicate that SS type of breakage do not jeopardize neither embryo development nor quality once fertilization is reached.
INTRODUCCIÓN
Entre las técnicas de reproducción asistida, la microinyección intracitoplasmática de espermatozoide (ICSI) es la técnica de fecundación asistida ampliamente utilizada desde que fue probada como la más eficiente en casos de esterilidad de causa masculina (Palermo et al., 1992).
Para una adecuada realización de la técnica, primero se deben elegir y preparar correctamente los gametos. El ovocito a microinyectar debe ser un ovocito maduro (MII), es decir, que haya extruido el primer corpúsculo polar. Para poder observarlo, se le deben retirar las células del cúmulo que rodean la zona pelúcida. Este procedimiento recibe el nombre de decumulación. Por otra parte, el espermatozoide debe ser activado mecánicamente, rompiendo el flagelo con ayuda de la micropipeta. Así se estimulará la reacción entre los diferentes componentes citoplasmáticos de ambos gametos.
Con el ICSI se consigue microinyectar un único espermatozoide con buena morfología y movilidad en la mejor zona del citoplasma del ovocito. De esta manera se superan los pasos preliminares de la fecundación in vivo, como la reacción acrosómica y la fusión de membranas de los gametos.
La microinyección espermática está indicada en aquellos casos donde hay un factor masculino relacionado con baja concentración espermática, movilidad y/o morfología alterada que impide una buena fecundación mediante la inseminación convencional (FIV). Del mismo modo el ICSI se utiliza en casos de fallo de fecundación por FIV, de no gestación en diferentes intentos de inseminación artificial homóloga o heteróloga (IAH o IAD) y en casos de diagnóstico genético pre-implantacional por PCR. En estos casos, ni las células del cúmulo, ni los espermatozoides adheridos a la zona pelúcida deben interferir en el resultado.
Esta técnica se lleva a cabo con la ayuda de un micromanipulador que dirige el movimiento de las dos micropipetas responsables del ICSI. Una de ellas (conocida como holding), mediante succión, sujeta el ovocito en la posición deseada para realizar el ICSI. Así, el ovocito se posiciona de manera que la zona del citoplasma adyacente al primer corpúsculo polar, donde teóricamente se encuentra el huso meiótico, queda alejada de la zona de microinyección evitando la posible desestructuración de la placa metafásica. La segunda micropipeta (la de inyección) perfora sin problemas la zona pelúcida y la membrana citoplasmática u oolema, para depositar el espermatozoide en el ooplasma (Remohí et al 2002).
El oolema suele presentar una elasticidad y resistencia determinada frente a la pipeta de inyección, y aunque se deben reducir al máximo los daños ocasionados al ovocito durante la rotura, no siempre es posible. Dependiendo de la calidad ovocitaria, del grado de maduración del citoplasma y de la propia membrana citoplasmática, la rotura de ésta se realizará de manera más o menos agresiva. En general, una cierta elasticidad en la membrana citoplasmática está relacionada con una buena calidad ovocitaria.
La categorización de los diferentes tipos de rotura de la membrana difiere entre los diferentes laboratorios de FIV. En 1995 se describieron 5 tipos de rotura diferentes: Tipo A, el oolema se rompe durante el proceso de introducción de la pipeta sin aplicar ningún tipo de aspiración del citoplasma; Tipo B, el oolema se rompe como consecuencia de una leve aspiración; Tipo C, el oolema se rompe aspirando muy fuerte, sobrepasando la zona pelúcida; Tipo D, el oolema se rompe después de la reintroducción de la pipeta en otra área, aspirando poco citoplasma; Tipo E, el oolema se rompe debido a una fuerte aspiración después de la reintroducción de la pipeta en otra área (Nagy et al., 1995). Posteriormente, en 1996 se describieron 3 tipos de rotura diferentes: normal, rápida y difícil. La rotura normal se define como aquella en la que el oolema presenta cierta resistencia y se rompe al aplicar un poco de presión; una rotura rápida es aquella en la que el oolema se rompe durante el proceso de introducción de la pipeta sin presentar resistencia alguna; y finalmente una rotura difícil, aquella en la que se debe reintroducir la pipeta en otra área y en ocasiones aspirar citoplasma (Palermo et al., 1996).
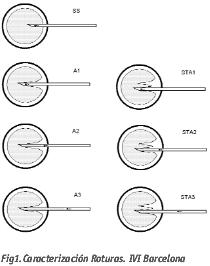
En la actualidad, en el laboratorio de FIV de IVI Barcelona para describir los diferentes tipos de rotura no se excluye ninguna de las anteriores, y de esta manera se identifican 7 tipos de rotura diferentes: SS, A1, A2, A3, STA1, STA2, STA3. Rotura SS o Sin Salto, el oolema se rompe durante la introducción de la pipeta sin ningún tipo de resistencia; Rotura A1, el oolema se rompe al introducir la pipeta observándose previamente una invaginación en la membrana siendo esto síntoma de una cierta elasticidad. Rotura A2, cuando no es posible una rotura A1, el oolema se rompe como consecuencia de una leve aspiración del citoplasma. Rotura A3, el oolema se rompe después de una aspiración citoplasmática importante al presentar una mayor resistencia a la rotura. Rotura STA1 o Stirring, el oolema se rompe al reintroducir la pipeta en otra área aplicando una cierta presión. Rotura STA2, el oolema se rompe después de la reintroducción de la pipeta y una leve aspiración. Rotura STA3, el oolema se rompe después de la reintroducción de la pipeta y una importante aspiración.
Cada tipo de rotura tiene una repercusión sobre el ovocito y su posterior desarrollo. En los estudios realizados por Nagy et al. en 1995 y Palermo et al. en 1996, se encuentra una mayor tasa de degenerados y una menor tasa de fecundación cuando la rotura es de tipo A o rápida (según la categorización del IVI Barcelona una rotura de tipo SS) debido a una inmadurez del ooplasma y del oolema.
A las 17-20 horas posteriores a la microinyección, se comprueba la fecundación de los zigotos. Un zigoto correctamente fecundado debe tener 2 pronúcleos (el masculino y el femenino) y dos corpúsculos polares extruidos (el primario y el secundario). Se considera que la fecundación es anómala cuando en lugar de 2 pronúcleos, el zigoto presenta cualquier variación en número de éstos. (Remohí et al., 2000).
El desarrollo y la calidad de los embriones es valorado en día 2 y en día 3. El día de la transferencia se seleccionarán los embriones (1 o 2) de mejor morfología entre todos los de la cohorte embrionaria.
OBJETIVO
El objetivo de este estudio es averiguar si, diez años más tarde, con el perfeccionamiento de la técnica y con la experiencia de los biólogos, una rotura sin salto (SS) sigue teniendo las mismas repercusiones.
MATERIAL Y MÉTODOS
Se ha realizado un estudio retrospectivo en el que se han incluido 266 ciclos de Fecundación in Vitro realizados en nuestro centro desde octubre de 2004 hasta diciembre de 2006. Se trata de ciclos realizados con ovocitos propios en los cuales la técnica indicada para la inseminación es el ICSI. Se han dividido los ciclos en dos grupos: grupo A (n = 111 ciclos, 1291 ovocitos) en el que hay al menos un ovocito dentro de la cohorte con rotura SS y grupo B (n = 155 ciclos, 1348 ovocitos) en los que no ha habido ningún ovocito con rotura SS en la cohorte. De cada grupo se ha valorado las tasas de degeneración, correcta fecundación y fecundación anómala. Por otro lado, se ha comparado el porcentaje de embriones transferidos
o congelados según el tipo de rotura que se ha dado en el momento de la microinyección espermática.
RESULTADOS
Este estudio consta de dos grupos de pacientes: A y B, correspondientes a pacientes que han tenido algún ovocito con rotura SS durante la microinyección en su cohorte, y a pacientes que no han tenido ningún ovocito con rotura SS en su cohorte ovocitaria respectivamente.
Ambos grupos son comparables en tratamiento, edad media, número de ovocitos totales y número de ovocitos maduros.
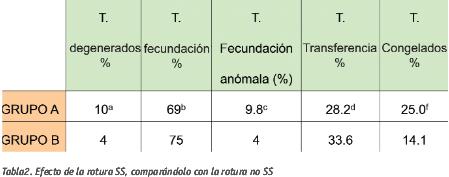
A continuación se presentan, en la tabla 2, los resultados obtenidos en los diferentes grupos.
a) Chi cuadrado de Pearson: p=0.001 Diferencia degeneración entre Grupo A y Grupo B
b) Chi cuadrado de Pearson: p=0.01 Diferencia de fecundación entre Grupo A y Grupo B
c) Chi cuadrado de Pearson: p=0.002 Diferencia fecundación anómala entre Grupo A y Grupo B
d) Chi cuadrado de Pearson p>0.5 Diferencia de transferencia entre Grupo A y Grupo B
f) Chi cuadrado de Pearson: p=0.02 Diferencia de tasa de congelados entre Grupo A y Grupo B
CONCLUSIONES
Los resultados obtenidos en este estudio retrospectivo revelan que el tipo de rotura SS aumenta la probabilidad de degeneración y disminuye la tasa de fecundación de manera significativa, del mismo modo que reflejaban los estudios de Nagy et al. y de Palermo et al. una década atrás.
El aumento significativo de la tasa de fecundación anómala, como afirman Palermo et al. (1996) es debido a la fragilidad o inmadurez de la membrana plasmática, que dificulta la extrusión de segundo corpúsculo polar (CP), el cual descondensa en el citoplasma, formándose un tercer pronúcleo.
La comparación del número medio de embriones transferidos y el porcentaje de embriones congelados en los grupos A y B, no muestra ninguna diferencia significativa. Se puede concluir que una rotura SS no compromete el desarrollo ni la calidad embrionaria de los ovocitos correctamente fecundados.
Una rotura SS provoca la disminución del número de embriones que forman la cohorte embrionaria de una paciente. Por lo tanto, para que existan más posibilidades de selección en el momento de escoger el mejor o los mejores embriones para la transferencia embrionaria, se debe intentar evitar al máximo una rotura SS.
Referencias
Nagy ZP, Liu J, Joris G, Bocken G, Desmet B, van Ranst A, Vankelecom A, Devroey P, van Steirteghem AC. The influence of the site of sperm deposition and mode of oolemma breakage at intracytoplasmic sperm injection on fertilization and embryo development rates. Human reproduction 1995; 10(12): 3171-3177.
Palermo G, Alikani M, Bertoli M, Colombero LT, Moy F, Cohen J, Rosenwaks Z. Oolemma characteristics in relation to survival and fertilization patterns of oocytes treated by intracytoplasmic sperm injection. Human Reproduction 1996; 11(1): 172-176.
Remohí J, Romero JL, Pellicer A, Simón C, Navarro J. Manual práctico de la esterilidad y reproducción humana. Madrid, McGraw- Hill. Interamericana. 2000; p.392-401.
Remohí J, Pellicer A, Simón C, Navarro J, Reproducción Humana. Madrid, McGraw- Hill. Interamericana. 2002; p.443-453.
Trounson AO, Gardner DK. In Vitro Fertilization. Boca Raton, Florida, CRC. 2000.
Veeck LL. An Atlas of Human Gametes and Conceptuses. Londres, Parthenon Publishing. 1999; p. 32-39.