DESCELULARIZACIÓN EN ÓRGANOS REPRODUCTIVOS FEMENINOS: VISIÓN GENERAL DEL CONOCIMIENTO ACTUAL Y AVANCES RECIENTES EN MEDICINA REPRODUCTIVA
Neus Moranta. P. Estudiante del Máster Universitario en Biotecnología de la Reproducción Humana Asistida de la Universidad de Valencia junto con IVI-RMA E-mail: nmorantaperello@gmail.com
En un 38% de los casos se atribuye la infertilidad a causas femeninas, la mayoría de las cuales pueden subsanarse con técnicas de reproducción asistida, pero aun así existen un conjunto de patologías ginecológicas cuya funcionalidad sólo puede restituirse con tratamientos quirúrgicos basados en la escisión y criopreservación de corteza ovárica, los trasplantes de útero o la histeroscopia reparativa. Las limitaciones asociadas a estos son la posible reintroducción de células cancerígenas, la necesidad de inmunosupresión o el estado y disponibilidad de los órganos. Los avances en los conocimientos de la Medicina Regenerativa están siendo de gran valor en la medicina reproductiva, ofreciendo la terapia celular y la ingeniería de tejidos como alternativas a las técnicas habituales. Esta revisión ofrece una visión general de las investigaciones y avances actuales en la bioingeniería de tejidos a partir del uso de órganos descelularizados y su aplicación clínica en medicina reproductiva.
INTRODUCCIÓN
La Organización Mundial de la Salud (OMS) establece que entre el 2-14% de las parejas en edad reproductiva son estériles. En un 38% de los casos se atribuye tal afección a causas femeninas, la mayoría de las cuales pueden subsanarse mediante el uso de técnicas de reproducción asistida (TRA), pero hay un conjunto de pacientes cuya patología no es tratable. Algunos de estos casos incluyen las adhesiones intrauterinas, las malformaciones congénitas, la ausencia de útero funcional (tanto de origen congénito como el Síndrome Mayer-Rokitansky-Kaüser-Hauser e hipoplasia uterina, como adquirido debido a histeroscopias por tumoración maligna, hemorragia postparto…), etc… (Campo, Baptista et al. 2017; Campo, Cervelló et al. 2017; Peng et al. 2017). Por otra parte, los efectos gonadotóxicos de las terapias anticancerígenas, resultan frecuentemente en la infertilidad crónica. Además, las mujeres jóvenes pueden padecer un fallo ovárico prematuro por predisposición genética (ej.: Síndrome de la X-frágil y Síndrome de Turner), a un cáncer familiar de inicio temprano (BRCA1/2), o como consecuencia a tratamientos para otras enfermedades (Laronda et al. 2015).
Actualmente, la función reproductiva de estas pacientes sólo puede restituirse con tratamientos quirúrgicos basados en trasplantes de útero, histeroscopia reparativa o la escisión y criopreservación de corteza ovárica. Las limitaciones asociadas a estos enfoques son varias, como la falta de donantes de útero, la necesidad de una larga inmunosupresión y la posibilidad de reintroducir células cancerígenas con el autotransplante de corteza ovárica (Kakabadze et al. 2017; Kuo et al. 2017; Peng et al. 2017; Campo, Cervelló et al. 2017). Otras opciones actuales a las que recurrir serían la gestación subrogada o la adopción (Tamadon et al. 2016).
Las investigaciones hoy en día en la bioingeniería de tejidos femeninos reproductivos y el mayor conocimiento de su fisiología dan pie a nuevas esperanzas para las mujeres que sufren este tipo de patologías gracias a modelos complejos desarrollados por la Medicina Regenerativa (MR) (Campo, Baptista et al. 2017). Esta ciencia se divide en dos ramas principales: por un lado la terapia celular, basada en la utilización de células para reconstruir o restaurar tejidos dañados, y por otro lado la Ingeniería de Tejidos (IT), basada en la utilización de moldes para la formación de estructuras tridimensionales (3D) destinadas a funcionar como órganos. Los moldes pueden construirse de manera artificial, a partir de biomateriales sintéticos y/o derivados de otros componentes naturales como polímeros y proteínas (Campo, Cervelló et al. 2017; Peng et al. 2017). Además, el uso de órganos descelularizados proporciona el molde ideal para la reconstrucción de los órganos en 3D.
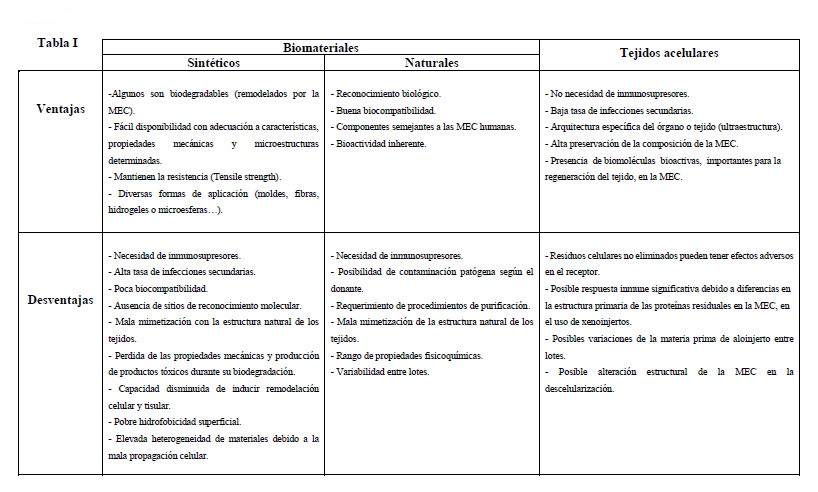
Para restituir y mantener la función normal de los órganos se requiere del establecimiento de sustitutos biológicos que puedan cubrir las condiciones apropiadas de adhesión, crecimiento, migración, proliferación, señalización y diferenciación celular (Olalekan et al. 2017; Tamadon et al. 2016). Así pues, las propiedades ideales de los biomoldes serían: la biocompatibilidad, la coincidencia de la cinética de degradación y formación de bioproductos; la similitud de propiedades estructurales y mecánicas; y el biomimetismo funcional y de composición (Murphy and Atala 2014; Tamadon et al. 2016). Como se puede observar en la Tabla I los tejidos acelulares cumplen más propiedades que los biomateriales, y de hecho ya han demostrado tener una gran capacidad de regeneración en varios órganos (Tamandon et al. 2016). Esta tabla describe las ventajas y desventajas de los biomateriales frente a las matrices extracelulares (MEC), una compleja mezcla de proteínas estructurales y funcionales obtenidas después de la descelularización de un tejido. Concretamente los órganos reproductivos debido a la especificidad de las funciones que desempeñan, conllevan una dificultosa elaboración artificial de sus MEC. Tales conocimientos han sido aplicados al campo de la medicina reproductiva, utilizando las matrices descelularizadas y sin antígenos que puedan provocar un rechazo inmune, como plataformas regenerativas para su recelularización (RC) con diferentes tipos de células (Campo, Baptista et al. 2017; Taylan and Oktay 2017;Peng et al. 2017).
El objeto de esta revisión es dar una visión general de los recientes avances en MR e IT en la medicina reproductiva a partir del uso de órganos descelularizados y a sus posibles aplicaciones clínicas.
PROTOCOLOS DE DESCELULARIZACIÓN
La descelularización (DC) fue definida por Badylack et al. como la “eliminación eficiente del material celular y nuclear de un tejido minimizando cualquier efecto adverso sobre la composición, actividad biológica e integridad mecánica de la matriz extracelular (MEC) restante”. Si el proceso se hace correctamente, tales características pueden ser mantenidas en el tiempo incluso después de una esterilización y largo almacenamiento. La preservación de la red vascular también es crítica ya que se necesita de un sistema circulatorio para recelularizar el órgano (Campo, Baptista et al. 2017; Peng et al. 2017).
Tabla 1. Ventajas y desventajas de la utilización de biomateriales sintéticos frente a matrices extracelulares (tejidos acelulares) obtenidas tras proceso de descelularización de los órganos de interés (Murphy and Atala., 2014; Tamadon et al.,2016)
Los protocolos de DC varían en relación al órgano de interés ya que la eficiencia de los procesos depende del tejido y de los métodos que se utilicen (Peng et al. 2017; Young and Goloman 2013). El primer paso generalmente es la lisis de la membrana celular a partir de técnicas físicas o soluciones iónicas, seguido por la separación celular de los componentes de la MEC, utilizando reacciones enzimáticas, y la solubilización de los elementos celulares usando detergentes (iónicos o no iónicos). Todo ello puede ir acoplado a mecanismos de agitación para incrementar su efectividad (Gilbert et al. 2006). Durante los protocolos las proteasas liberadas pueden causar daño en la MEC
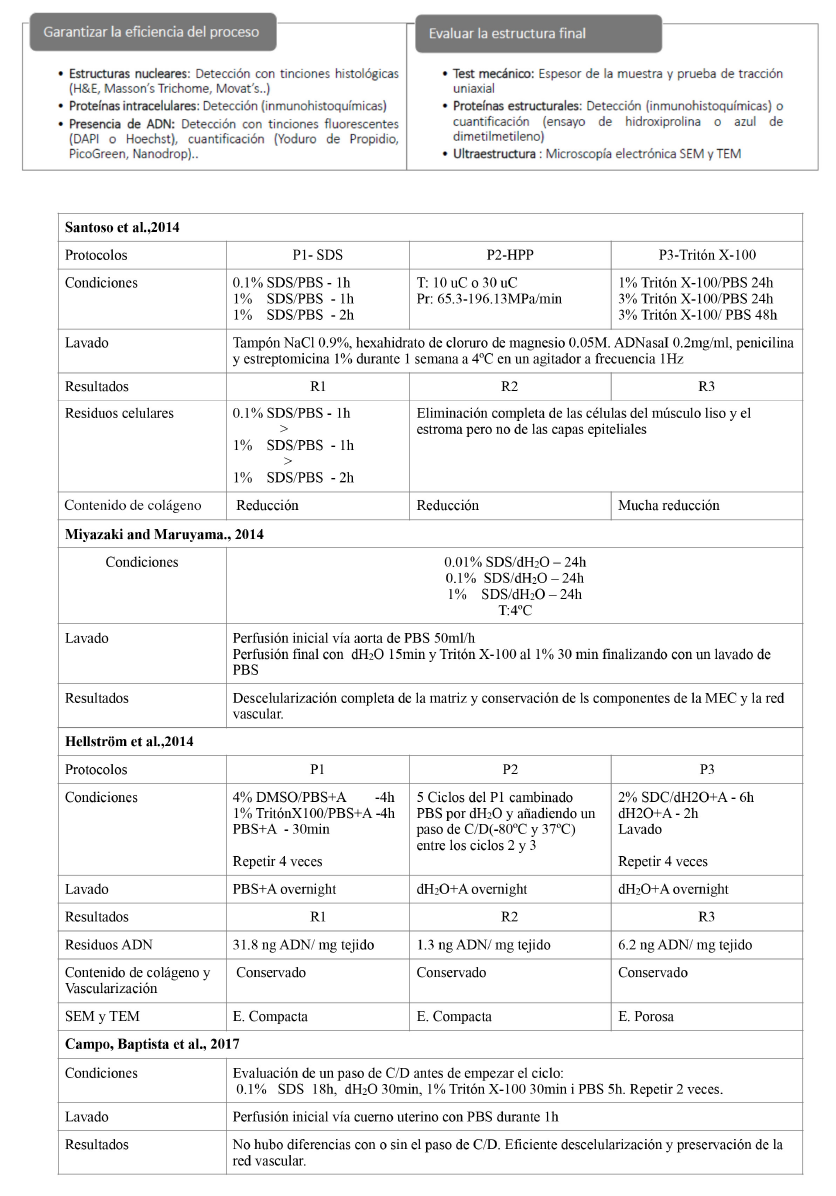
Tabla 2. Métodos y técnicas para garantizar la efectividad de los procesos de descelularización y la conservación de las características de la matriz extracelular (Campo, Baptista et al. 2017; Santoso et al., 2014).
por lo que deben incluirse inhibidores de proteasas y mantener la temperatura y el pH controlados. Para disminuir las contaminaciones es habitual incluir soluciones antibióticas y finalmente eliminar los residuos químicos del tejido antes de la RC y trasplante, ya que, en altas concentraciones, podrían causar una reacción adversa en el receptor (Gilbert et al. 2006).
Este proceso se deberá acompañar de análisis adecuados para garantizar su efectividad y la conservación de las características de la estructura final. Existen muchos métodos para ello, tal como se muestra en la Tabla II. Pequeñas concentraciones de restos celulares en la MEC no se han correlacionado con una respuesta adversa en el receptor. Aun así, según Crapo et al. el mínimo criterio a satisfacer es: <50 ng de ADN por mg de MEC peso seco, <200 pb ADN longitud de los fragmentos y además falta de material nuclear visible en tinciones DAPI o Hematoxilina & Eosina (Crapo et al. 2011; Gilbert et al. 2006).
APLICACIONES DE LA MEDICINA REGENERATIVA BASADA EN LA BIOINGENIERÍA
Útero
El útero es un órgano muscular que se divide en cérvix, istmo, cuerpo y fondo. Formado por tres capas: el perimetrio, principalmente tejido conectivo, el miometrio, tejido muscular, y el endometrio, epitelio columnar parcialmente ciliado acompañado de estroma. Este órgano reproductivo es muy sensible a la producción hormonal de los ovarios y varía tanto en la composición del endometrio como en su comportamiento (contracciones) a lo largo del ciclo menstrual. Todas estas características hacen que su MEC sea especialmente difícil de imitar aun siendo el órgano reproductivo más estudiado respecto a su funcionalidad (Tamadon et al. 2016).
En 2005 Alborzi et al. utilizaron un injerto peritoneal y un soporte de plástico para tratar la aplasia cervical en humanos. Estudios semejantes se han hecho con submucosa del intestino delgado, células cervicales y con biomateriales sintéticos pero todavía ningún constructo ha sido testado bajo condiciones de embarazo (Campo, Cervelló et al. 2017; Kuo et al. 2017; Tamadon et al. 2016).
Los primeros intentos para desarrollar endometrios con estructuras 3D fueron llevados a cabo por Bentin-Ley et al., Schutte et al. o MacKintosh et al., a partir de matrices sintéticas o derivadas de otros compuestos humanos llegando a imitarse su compleja arquitectura e incluso la menstruación, pero sin resultar óptimos para uso in vivo. Otros muchos estudios han intentado mejorar los resultados sobre todo en cuanto a similitud estructural (Campo, Cervelló et al. 2017). Recientemente Olalekan et al. establecieron un nuevo modelo 3D de endometrio in vitro que responde a un ciclo de 28 días de hormonas esteroideas ováricas con la expresión de receptores de estrógeno y progesterona y una respuesta de decidualización proporcionando un novedoso sistema para estudiar la acción hormonal sobre la angiogénesis, la receptividad endometrial y la implantación (Olalekan et al. 2017). Lu et al. demostraron que es posible llevar a cabo el desarrollo temprano de embriones en un co-cultivo estratificado de endometrio y miocitos sobre una capa de matrigel de colágeno (Steinberg et al. 2015). Y Young y Goloman dirigieron sus esfuerzos a reparar una fracción de pared uterina a partir de células de miometrio cultivadas en MEC de miometrios humanos y de rata DC. (Campo, Cervelló et al. 2017; Kuo et al. 2017; Young and Goloman 2013).
Los conocimientos adquiridos con todos esos estudios hicieron posible el hecho de regenerar el tejido uterino, in vivo, a partir de injertos cultivados sobre moldes construidos normalmente con materiales sintéticos o naturales, llegando a obtener tasas de embarazo del 77.8% e incluso viendo implantaciones de embriones en los injertos (Ding et al. 2014). Aunque estas matrices artificiales constan de reconocimiento biológico, no se ha conseguido imitar totalmente la estructura del tejido uterino y su capacidad regenerativa es dependiente del tejido nativo existente. Otra posibilidad serían los trasplantes de órgano íntegro pero descelularizados, así como la utilización de injertos de tejido uterino acelular, una alternativa que podría mejorar mucho los resultados y a la vez saltar ciertos obstáculos como la inmunosupresión (Campo, Baptista et al. 2017; Kuo et al. 2017; Santoso et al. 2014).
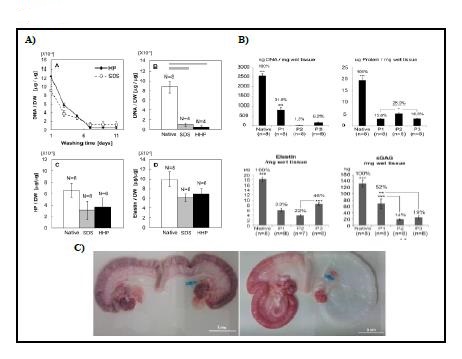
Bastantes grupos han descrito el procedimiento de DC y RC de todo el órgano en modelos animales (Campo, Cervello et al. 2017). En 2014 Santoso et al., compararon la efectividad de tres métodos de DC, representados en la Tabla III, en trompas de Falopio de rata y estudiaron el comportamiento de estos tejidos in vivo. Los resultados mostraron que con alta presión hidrostática (HHP) se pueden estandarizar las condiciones de DC porque son independientes del tamaño y la estructura de la muestra. Además, este sistema causa una desnaturalización de proteínas mínima en contraste con los detergentes, lo que resulta en la mejor preservación del contenido de MEC (Figura 1 apartado A). Se observó regeneración de los tejidos uterinos, específicamente en el grupo HHP, además de respuesta hormonal y propiedades mecánicas que revelaron el potencial de los úteros reconstruidos para comportarse como un útero nativo. En las pruebas de fertilidad hubo embarazo en los grupos de dodecilsulfato sódico (SDS) y HHP, concluyéndose este último como la mejor opción (Santoso et al., 2014). Ese año Miyazaki y Maruyama consiguieron la DC completa de útero, en rata, con la conservación de los componentes de la MEC y la red vascular, usando un sistema de perfusión vía aorta, Tabla III. Demostraron RC in vitro con la consiguiente reconstrucción de un endometrio funcionalmente competente y tasas de embarazo del 75% (Miyazaki and Maruyama., 2014). Por su parte Hellström et al., compararon tres protocolos de DC de útero de rata basados en el uso de diferentes detergentes, Tabla III. La inmunohistoquímica mostró que todos los protocolos utilizados eliminaron con éxito los elementos inmunorreactivos MHC clase I y II. No se detectaron diferencias importantes en el contenido ni distribución del colágeno entre los moldes, pero si en elastina y glicosaminoglicanos (GAGs). Los análisis de microscopía electrónica revelaron que los constructos más resistentes, según los experimentos mecánicos, contaban con una estructura de MEC porosa. Los protocolos que demostraron ser superiores en la eliminación de ADN y, en general, fueron menos nocivos para la MEC fueron señalados como candidatos prometedores para futuras aplicaciones de bioingeniería del útero, Figura 1 apartado B. (Hellström et al., 2014)
Tabla 3 – Figura 1
Tabla 3. Detalle de 4 protocolos de descelularización de útero y sus resultados. T: Temperatura, Pr: Presión, SDS: Dodecilsulfato sódico, HPP: Alta presión hidrostática, dH2O: Agua destilada, A: Ácida sódica, C/D: congelación/descongelación (Santoso et al.,2014; Mizayaki y Maruyama 2014; Hellstrom et al. 2014; Campo, Baptista et al.,2017).
Tabla 3 – Figura 1. Técnicas y protocolos de descelularización de útero A) El protocolo con alta presión hidrostática (HHP) elimina mejor el ADN y desnaturaliza mínimamente las proteínas de la MEC en contraste con la utilización de SDS, sin dejar residuos químicos (Santoso et al., 2014) B) La cuantificación del ADN sugirió propiedades de DC para la dH2O como reactivo tamponador. No se detectaron diferencias importantes en el contenido ni distribución del colágeno entre los moldes, pero si en elastina y glicosaminoglicanos (Hellström et al.,2014). C) Útero antes y después de la descelularización (Campo, Baptista et al., 2014)
Los tratamientos explicados anteriormente generan cambios en las MEC que pueden tener un cierto impacto en su funcionalidad por lo que se debería tratar de establecer cuál es el mejor protocolo para su aplicación in vivo (Hellstrom et al. 2017). Con esta motivación los dos grupos anteriores evaluaron conjuntamente la capacidad regenerativa de injertos uterinos obtenidos a partir de la RC de matrices uterinas que habían sido DC con los protocolos mencionados previamente. Los resultados corroboraron los del estudio anterior, mostrando que los injertos obtenidos mediante uno de los protocolos más prometedores regeneraban mejor e incluso fueron capaces de desarrollar fetos a corto plazo en los sitios de trasplante aunque la placentación nunca ocurrió directamente sobre los injertos, posiblemente debido a una estructura de tejido subóptima y/o revascularización deficiente (Hellstrom et al. 2016).
En 2017 Campo et al. desarrollaron un protocolo de DC, Tabla III, de todo el útero porcino consiguiendo una eficiente eliminación de los restos celulares sin diferencias visibles entre los protocolos estudiados. La estructura 3D se mantuvo, así como la red vascular, Figura 1 apartado C. También se observó una correcta RC y regeneración de células endometriales, demostrando la posibilidad de aumentar el tamaño de los órganos descelularizados y permitiendo la posibilidad de crear un órgano funcional (Campo, Baptista et al., 2017).
Vagina
La vagina forma parte de los órganos sexuales externos que intervienen en el coito. Su estructura se compone de tejido epitelial, muscular y una matriz con proteínas estructurales como colágeno, elastina…
Para pacientes que sufren aplasia vaginal la bioingeniería hace posible la creación, ex vivo, de construcciones que desempeñan una función sexual normal y mantienen adecuadamente la apariencia de genitales externos (Campo, Cervelló et al. 2017; Peng et al. 2017). Sin embargo, la mayoría de las alternativas disponibles incluyen procedimientos quirúrgicos y el uso de tejidos no-genitales. Los tejidos usados como sustitutos pueden tener una adecuada regeneración y función epitelial pero normalmente disponen de una capa muscular anormal dificultando la recuperación normal de la función de este órgano (De Filippo et al. 2003; Murphy and Atala 2014). El primer caso de un trasplante vaginal, con moldes 3D, en humanos fue publicado por Raya- Rivera et al.
Segmentos comerciales de submucosa intestinal acelular se sembraron con células autólogas obtenidas de pacientes con ausencia congénita de vagina y con ellas se recubrieron los moldes de copolímero diseñados específicamente para cada paciente. Seis meses después de la operación los tejidos reconstruidos se mostraron similares a los nativos en características físicas, perfiles de expresión de proteínas y organizaciones celulares (Raya-Rivera et al. 2014). Estos resultados fueron posibles porque se basan en la experiencia previa de pruebas experimentales in vitro e in vivo en modelos animales y la utilización de las MEC de otros órganos descelularizados (De Filippo et al. 2003;Peng et al. 2017).
Ovarios
Los ovarios son los órganos sexuales primarios responsables de la producción de los óvulos y la secreción endocrina de hormonas y otros péptidos. Es muy importante su flexibilidad y adaptabilidad ya que su tamaño varía dentro del ciclo menstrual y la paridad de la mujer además de sufrir mensualmente roturas relacionadas con la ovulación. Su estructura histológica consiste en cuatro capas: el epitelio germinativo, la túnica albugínea, la corteza que contiene los folículos ováricos, y la médula (Tamadon et al. 2016).
Para las pacientes que se enfrentan a un cáncer es primordial salvaguardar una gran población inactiva de folículos primordiales antes de iniciar los tratamientos. Se han descrito diferentes estrategias para ello siendo una de ellas la criopreservación y trasplante de tejido ovárico cuyo principal inconveniente recae en el fenómeno conocido como “burnout” producido por una isquemia inicial, pero también existe el riesgo de reintroducir células malignas en el paciente a partir del tejido trasplantado (Laronda et al. 2015; Taylan and Oktay 2017). Por ello, en las últimas décadas, numerosos equipos de investigación han trabajado en el desarrollo de dos estrategias para evitar o disminuir tal riesgo: el ovario in vitro y el ovario artificial trasplantable. (Diaz-Garcia and Herraiz 2014; Telfer and Fauser 2016).
Construir un ovario podría restaurar las funciones sistémicas mejor que la terapia hormonal de reemplazo, además se beneficiaría a pacientes con opciones limitadas (prepuberales o con cánceres hormonodepedientes) (Laronda et al. 2015). Pero la dificultad del cultivo folicular recae en que en las diferentes etapas de maduración los folículos van cambiando sus necesidades en términos de estímulos paracrinos, tanto bioquímicos como mecánicos (Diaz-Garcia and Herraiz 2014). Además, la imitación de la MEC ovárica es fundamental para promocionar su desarrollo y recuperación (Laronda et al. 2015, Tamadon et al. 2016).
Muchos estudios desarrollaron sistemas de cultivo 3D con materiales sintéticos como Pangas et al., 2003 o Xu et al., pero fue Krotz S.P. et al. quien consiguió, en humanos, la maduración desde folículo antral temprano a ovocitos metafase II en geles de agarosa. Otros estudios que incorporan componentes como colágeno (tipo I y IV), fibrina y/o fibronectina en la MEC han demostrado un crecimiento, diferenciación y competencia meiótica mejorados en comparación con las matrices sintéticas (Kuo et al. 2017; Luyckx et al. 2014; Amorim and Shikanov 2016). Una vez más, la mejor alternativa a la utilización de biomateriales es la DC del órgano despojándolo de las células cancerígenas. Partiendo de esta hipótesis se puede recurrir a dos enfoques: el primero implica la DC y RC del órgano completo antes de la implantación (Jakus et al. 2017). Laronda et al., descelularizaron ovarios bovinos y humanos y después de volver a sembrarlos con células ováricas somáticas se observó que producían estradiol e inhibina A in vitro. Además, los injertos recelularizados iniciaron la pubertad en ratones que habían sido ovariectomizados, sugiriendo que podrían tener implicaciones más amplias en la bioingeniería de otros órganos con función endocrina (Martinez and International Society for Fertility Preservation-ESHRE-ASRM Expert Working Group 2017). Los resultados fueron satisfactorios, sin embargo, no se consiguió la RC completa del órgano ni hubo descendencia viable (Laronda et al. 2015). Liu et al., diseñaron un nuevo protocolo para la DC de tejido ovárico de cerdo acortando el tratamiento con SDS para minimizar el daño en la ultraestructura del tejido nativo. Además de una correcta repoblación del tejido y secreción de estradiol, se observó una respuesta inmune mínima en los injertos (Liu et al. 2017). Aunque prometedor, este enfoque todavía adolece de una variedad de deficiencias técnicas y prácticas que incluyen la incapacidad de recelularizar completamente los órganos consiguiendo una total funcionalidad y la necesidad de órganos completos y viables que estén disponibles para la DC inicial.
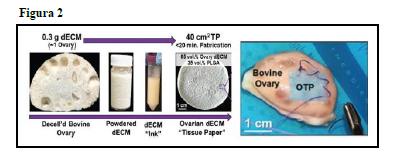
El segundo enfoque, utilizado por Jakus et al., se basaba en un proceso altamente versátil para crear biomateriales llamados “Tissue paper” (TP). Estos se componen en un 65% de componente bioactivo natural, de manera que mantienen parte de la estructura nativa y de las características mecánicas del tejido original, y en un 35% de polímero, presente principalmente para ayudar en el procesamiento y la manipulación.
Podrían usarse para impresiones en 3D, para la implantación quirúrgica de folículos individuales, actuar como un parche asegurando injertos de tejido cortical o en trasplantes de órgano completo (Figura 2). Se investigó la viabilidad y la función ex vivo de los folículos ováricos aislados de ratón y trozos de corteza ovárica cultivados en TP demostrando que se puede mantener la viabilidad tisular y la función hormonal (Jakus et al., 2017). Esta aplicación de los TP recuerda al estudio de Taylan y Oktay en el que se describe la aplicación innovadora de estructuras tridimensionales descelularizadas como una plataforma regenerativa para la reconstrucción de injertos ováricos para autotrasplante (Taylan and Oktay 2017).
Figura 2. Creación de biomateriales llamados “Tissue Paper” a partir de matrices ováricas descelularizadas que son liofilizadas y mezcladas con biomateriales. Éstos pueden ser útiles en infusiones de andamios, impresiones 3D o parches asegurando injertos corticales. (Jakus et al.,2017)
presente principalmente para ayudar en el procesamiento y la manipulación. Podrían usarse para impresiones en 3D, para la implantación quirúrgica de folículos individuales, actuar como un parche asegurando injertos de tejido cortical o en trasplantes de órgano completo (Figura 2). Se investigó la viabilidad y la función ex vivo de los folículos ováricos aislados de ratón y trozos de corteza ovárica cultivados en TP demostrando que se puede mantener la viabilidad tisular y la función hormonal (Jakus et al., 2017). Esta aplicación de los TP recuerda al estudio de Taylan y Oktay en el que se describe la aplicación innovadora de estructuras tridimensionales descelularizadas como una plataforma regenerativa para la reconstrucción de injertos ováricos para autotrasplante (Taylan and Oktay 2017).
CONCLUSIÓN
Los tejidos descelularizados han demostrado ser prometedores sustitutos funcionales de los biomateriales hasta el punto de ser actualmente esenciales en la IT. Además, la baja respuesta inmune de las MEC las convierte en ideales para su uso tanto en alo-como xeno-trasplantes por tener los componentes de la matriz altamente conservados entre especies.
En medicina reproductiva estas nuevas técnicas también se están llevando a cabo con resultados muy prometedores: respecto al endometrio se ha conseguido la construcción de moldes acelulares 3D sensibles a hormonas in vitro, los trabajos con miometrio han demostrado la utilidad de los parches uterinos y se han utilizado soportes sintéticos, naturales e incluso recelularizados con células de otros órganos para tratar la aplasia cérvico-vaginal. Gracias a los conocimientos adquiridos con todos estos estudios, ha sido posible regenerar tejido uterino, in vivo, a partir de tejido acelular y desarrollar un protocolo de DC para un órgano reproductor grande manteniendo su estructura 3D, dando opción a futuros trasplantes de útero íntegros, lo que podría evitar la inmunosupresión como tratamiento de los pacientes. La IT también puede ofrecer una solución para la reconstrucción vaginal cuando se dispone de poco tejido local, con el uso de tejido autólogo, de otros órganos, descelularizado. Por otra parte, el desarrollo de un ovario artificial es una alternativa valiosa para restaurar la fertilidad y las funciones sistémicas en pacientes puntuales sin necesidad de inmunosupresión y disminuyendo el riesgo de reintroducción de células cancerígenas. Además, podría usarse en estudios de toxicología para evaluar el impacto de diferentes fármacos y sustancias químicas sobre la supervivencia y el desarrollo de los folículos, así como sobre la calidad de los ovocitos. Se concluye la necesidad de más estudios in vivo con la DC del órgano completo demostrando la función fisiológica de los ovarios finalizando en una gestación para que esta estrategia se utilice en trasplantes humanos.
Finalmente, el reciente descubrimiento de la posibilidad de solubilizar y manipular MEC para formar hidrogeles y TP ha dado paso a investigaciones in vitro e in vivo para intentar entender sus propiedades mecánicas y evaluar cómo éstos influyen en el control de la diferenciación y comportamiento celular además de la remodelación del tejido de novo. Los resultados actuales prevén una expansión de sus utilidades clínicas en un futuro al utilizarse como plataformas regenerativas, ya sea en forma de injerto o de órgano completo creado a partir de una impresión 3D, disminuyendo el burnout al reducir la isquemia inicial, facilitando la maduración folicular y la RC o mejorando la sujeción de diferentes órganos (Saldin et al. 2017). Aun así, quedan muchos obstáculos que sobrepasar para la completa sustitución de los tejidos reproductivos, entre ellos la optimización de protocolos de DC y RC de los diferentes órganos completos. Por ello, los estudios actuales se centran cada vez más en comparar protocolos que una vez establecidos en animales podrían dar paso a estudios clínicos en humanos.
CONFLICTO DE INTERESES
La autora no tiene ningún conflicto de intereses para declarar.
AGRADECIMIENTOS
Me gustaría agradecer a la Dra. Irene Cervelló su generosa asistencia y discusión.
Referencias
Amorim CA and Shikanov A. The artificial ovary: current status and future perspectives. Future Oncol 2016:12:2323-2332.
Campo H, Baptista PM, Lopez-Perez N, Faus A, Cervello I and Simon C. De- and recellularization of the pig uterus: a bioengineering pilot study. Biol Reprod 2017:96:34-45.
Campo H, Cervello I and Simon C. Bioengineering the Uterus: An Overview of Recent Advances and Future Perspectives in Reproductive Medicine. Ann Biomed Eng 2017:45:1710-1717.
Crapo PM, Gilbert TW and Badylak SF. An overview of tissue and whole organ decellularization processes. Biomaterials 2011:32:3233-3243.
De Filippo RE, Yoo JJ and Atala A. Engineering of vaginal tissue in vivo. Tissue Eng 2003:9:301-306.
Diaz-Garcia C and Herraiz S. The artificial ovary: any new step is a step forward. Fertil Steril 2014:101:940.
Ding, L., X. Li, H. Sun, J. Su, N. Lin, B. Peault, T. Song, J. Yang, J. Dai, and Y. Hu.
Transplantation of bone marrow mesenchymal stem cells on collagen scaffolds for the functional regeneration of injured rat uterus. Biomaterials 2014:35:4888–4900.
Gilbert TW, Sellaro TL and Badylak SF. Decellularization of tissues and organs. Biomaterials 2006:27:3675-3683.
Hellstrom M, Bandstein S and Brannstrom M. Uterine Tissue Engineering and the Future of Uterus Transplantation. Ann Biomed Eng 2017:45:1718-1730.
Hellström M, El-Akouri R, Sihlbom C, Olsson B, Lengqvist J, Bäckdahl H, et al. Towards the development of a bioengineered uterus: comparison of different protocols for rat uterus decellularization. Acta biomaterialia 2014:10:5034-5042.
Hellstrom M, Moreno-Moya JM, Bandstein S, Bom E, Akouri RR, Miyazaki K, et al. Bioengineered uterine tissue supports pregnancy in a rat model. Fertil Steril 2016:106:487-496.e1.
Jakus AE, Laronda MM, Rashedi AS, Robinson CM, Lee C, Jordan SW, et al "Tissue Papers" from Organ-Specific Decellularized Extracellular Matrices. Adv Funct Mater 2017:27:10.1002/adfm.201700992. Epub 2017 Aug 7.
Kakabadze Z, Kakabadze A, Chakhunashvili D, Karalashvili L, Berishvili E, Sharma Y and Gupta S. Decellularized human placenta supports hepatic tissue and allows rescue in acute liver failure. Hepatology 2017:.
Kuo CY, Baker H, Fries MH, Yoo JJ, Kim PCW and Fisher JP. Bioengineering Strategies to Treat Female Infertility. Tissue Eng Part B Rev 2017:23:294-306.
Laronda MM, Jakus AE, Whelan KA, Wertheim JA, Shah RN and Woodruff TK. Initiation of puberty in mice following decellularized ovary transplant. Biomaterials 2015:50:20-29.
Liu WY, Lin SG, Zhuo RY, Xie YY, Pan W, Lin XF and Shen FX. Xenogeneic Decellularized Scaffold: A Novel Platform for Ovary Regeneration. Tissue Eng Part C Methods 2017:23:61-71.
Luyckx V, Dolmans MM, Vanacker J, Legat C, Fortuno Moya C, Donnez J and Amorim CA. A new step toward the artificial ovary: survival and proliferation of isolated murine follicles after autologous transplantation in a fibrin scaffold. Fertil Steril 2014:101:1149-1156.
Martinez F and International Society for Fertility Preservation-ESHRE-ASRM Expert Working Group. Update on fertility preservation from the Barcelona International Society for Fertility Preservation-ESHRE-ASRM 2015 expert meeting: indications, results and future perspectives. Fertil Steril 2017:108:407-415.e11.
Miyazaki K and Maruyama T. Partial regeneration and reconstruction of the rat uterus through recellularization of a decellularized uterine matrix. Biomaterials 2014:35:8791-8800.
Murphy SV and Atala A. 3D bioprinting of tissues and organs. Nat Biotechnol 2014:32:773-785.
Olalekan SA, Burdette JE, Getsios S, Woodruff TK and Kim JJ. Development of a novel human recellularized endometrium that responds to a 28-day hormone treatment. Biol Reprod 2017:96:971-981.
Peng G, Liu H and Fan Y. Biomaterial Scaffolds for Reproductive Tissue Engineering. Ann Biomed Eng 2017:45:1592-1607.
Raya-Rivera AM, Esquiliano D, Fierro-Pastrana R, Lopez-Bayghen E, Valencia P, Ordorica-Flores R, et al. Tissue-engineered autologous vaginal organs in patients: a pilot cohort study. Lancet 2014:384:329-336.
Saldin LT, Cramer MC, Velankar SS, White LJ and Badylak SF. Extracellular matrix hydrogels from decellularized tissues: Structure and function. Acta Biomater 2017:49:1-15.
Santoso EG, Yoshida K, Hirota Y, Aizawa M, Yoshino O, Kishida A, et al. Application of detergents or high hydrostatic pressure as decellularization processes in uterine tissues and their subsequent effects on in vivo uterine regeneration in murine models. PLoS One 2014:9:e103201.
Steinberg M, Siegersma K, Roth E and Marsh E. Decoding the matrix: using an optimal decellularization protocol to characterize the leiomyoma and myometrium extracellular matrix (ECM). Fertil Steril 2015:104:e102-e103.
Tamadon A, Park K, Kim YY, Kang B and Ku S. Efficient biomaterials for tissue engineering of female reproductive organs. Tissue Engineering and Regenerative Medicine 2016:13:447-454.
Taylan E and Oktay K. Application of Decellularized Tissue Scaffolds in Ovarian Tissue Transplantation. Methods Mol Biol 2017:.
Telfer EE and Fauser BC. Important steps towards materializing the dream of developing an artificial ovary. Reprod Biomed Online 2016:33:333-334.
Young RC and Goloman G. Allo- and xeno-reassembly of human and rat myometrium from cells and scaffolds. Tissue Eng Part A 2013:19:2112-2119.