EXISTEN DIFERENCIAS EN EL SEX-RATIO DE LOS NIÑOS NACIDOS TRAS UNA TRA? ESTUDIO RETROSPECTIVO EN EL CHGUV
Jose Gabriel Descals Ferrando 1, Rubén DasíCrespo 1, Juan Manuel Moreno-Moya 1, Carla Olmedo Illueca1, Iris Martínez Rodero 1, Irene Cuevas Sáiz1.
1Consorcio Hospital General Universitario de Valencia, Valencia, Avenida Tres Cruces, 2.
En la población general, el sex-ratio en el nacimiento, que se define como el número de varones respecto a toda la población, se estima en torno al 0.52. Sin embargo, en los nacimientos de niños a partir de técnicas de reproducción asistida (TRA) se han registrado en la bibliografía tasas en el sex-ratio comprendidas entre 0.45-0.65 según la TRA empleada (ICSI o FIV, respectivamente), y estadio de desarrollo embrionario el día de transferencia (Estadio de células, o blastocisto), así como diferencias estadísticamente significativas respecto a la población general. En este trabajo se llevará a cabo una revisión bibliográfica de algunos de los trabajos publicados sobre el posible efecto de las TRA en el sex-ratio, exponiéndose las posibles causas de esta desviación respecto a la población general. Además, se comentarán los resultados obtenidos en el CHGUV sobre el sex-ratio de la descendencia obtenida tras TRA.
INTRODUCCIÓN
Las dos TRA in vitro más importantes son la fecundación in vitro convencional (FIVc) y la microinyección intracitoplasmática de espermatozoides (ICSI). En primer lugar, el sex-ratio primario es el sex-ratio en el momento de la concepción, que se define como el número de ovocitos fecundados con el cromosoma Y que porta el espermatozoide respecto el total. Generalmente, el sex-ratio primario es difícil de averiguar ya que requiere de diagnóstico genético preimplantacional (DGP) (Zarutskie PW et al., 1989) y debido a esto suele ser desconocido.
Por otro lado, el sex ratio en el nacimiento, también conocido como sex ratio secundario se define como la proporción de varones al nacer respecto a todos los nacidos vivos, el cuál es mucho más fácil de averiguar y por ello es el más utilizado por las diferentes bases de datos en todo el mundo (James WH, 1989). Existe variación en el sex-ratio en la población general, situándose en torno el 0.52. Sin embargo, en niños nacidos mediante TRA varía de forma significativa en mayor magnitud que en cualquier otra población (Källén B et al., 2005). Se han llevado a cabo estudios para investigar si el uso de una determinada TRA, o el estadio de desarrollo embrionario en el día de la transferencia (estadio en células o blastocisto) pueden alterar el sex-ratio en los nacidos.
Así pues, el objetivo de este estudio es llevar a cabo una revisión bibliográfica y analizar el posible efecto de las diferentes técnicas de inseminación de los ovocitos y el estadio embrionario en el día de la transferencia sobre el sex-ratio.
SEX-RATIO SEGÚN LA TRA EMPLEADA
Se ha observado en diferentes estudios un aumento significativo en el sex-ratio en los nacidos obtenidos a partir de FIV y posterior transferencia de embriones, y un descenso significativo en el sex-ratio en los nacidos tras ICSI y transferencia de embriones (Thatcher et al., 1989; Ghazzawiet al., 2000; Deanet al., 2010; Walid E et al., 2014).
SEX-RATIO SEGÚN EL ESTADIO EMBRIONARIO EN EL DÍA DE TRANSFERENCIA EMBRIONARIA
La optimización de los medios de cultivo de embriones y las evidencias de la mayor tasa de implantación al transferir en estadio de blastocisto, junto con la tendencia a transferir un único embrión para evitar posibles complicaciones gestacionales asociadas a los embarazos múltiples, ha causado un aumento de transferencias en estadio de blastocisto en las clínicas de fertilidad de todo el mundo. En 1994, se observó que la transferencia de embriones de crecimiento más rápido resultó en un aumento del sex-ratio (Pergamentet al., 1994). Además, cabe destacar el efecto aditivo que se produce al combinarse estos dos factores, ya que se ha observado un mayor aumento en el sex-ratio tras la transferencia en estadio de blastocisto tras FIV, y un marcado descenso tras la transferencia en estadio de células embrionaria tras ICSI (0.487) (Deanet al., 2010; Walid E et al., 2014).
MATERIAL Y METODOS
BASES DE DATOS
Para llevar a cabo este estudio retrospectivo, se consultaron diferentes bases de datos en la bibliografía, además de la base de datos de la Unidad de Medicina Reproductiva del Hospital General Universitario de Valencia.
En el estudio del CHGUV, se analizó retrospectivamente el sexo de los niños nacidos de 165 ciclos de fecundación in vitro entre Mayo de 2005 y Diciembre de 2014. Se registraron un total de 192 nacimientos de sexo conocido, 27 de ellos provenientes de gestaciones gemelares. 42 de los ciclos fueron realizados mediante FIV convencional y 150 mediante ICSI. La principal medida del estudio fue el sexo del nacido, y la técnica de inseminación de los ovocitos (FIV o ICSI).
ANÁLISIS ESTADÍSTICO
Se utilizaron unos intervalos de confianza del 95% y se consideró significancia estadística en P<0.05. El análisis estadístico se realizó mediante chi-cuadrado utilizando el paquete estadístico SPSS v 15.0.
RESULTADOS
ESTUDIO DE JUAN J TARÍN et al., 2014
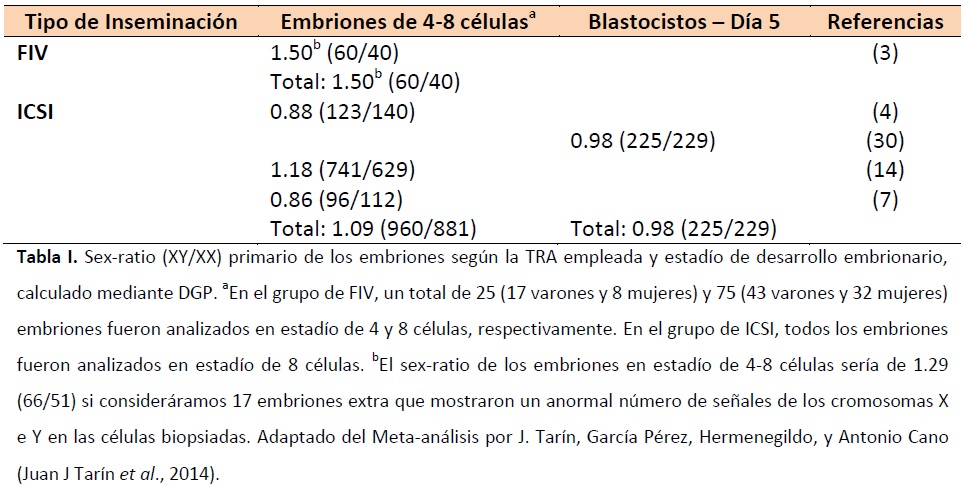
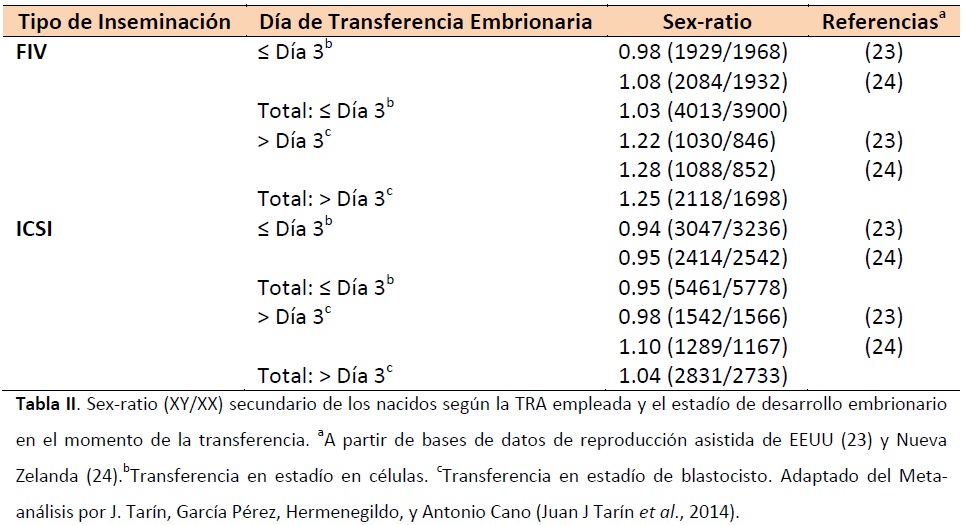
En este trabajo se llevó a cabo un meta-análisis de los artículos previamente publicados hasta el año 2013 que trataban el sex-ratio. Tal y como puede observarse en la Tabla I, se compararon los sex-ratios primarios a partir de ciclos donde se realizó un DGP y el secundario tras transferir embriones en estadio de células y blastocisto.
En la Tabla I se observan los resultados obtenidos, donde el sex-ratio primario de los embriones obtenidos mediante FIV se sitúa en torno el 0.6, mientras que el de los obtenidos por ICSI se sitúa en torno el 0.53. Por otro lado, en la Tabla II puede observarse el sex-ratio secundario de los embriones obtenidos por FIV, que fue de 0.515 tras transferencia en estadio de células y de 0.555 tras transferencia en estadio de blastocisto, mientras que para los embriones obtenidos por ICSI fue de 0.482 cuando se transfirió en estadio de células y de 0.508 cuando se transfirió en estadio de blastocisto.
Estos resultados mostraron una desviación estadísticamente significativa (P < 0.05) entre los subgrupos. Además, hace evidente la necesidad de más estudios que comparen el sex-ratio primario con el secundario, siendo necesario para ello aplicar un DGP.
ESTUDIO DE DEAN JH et al., 2010
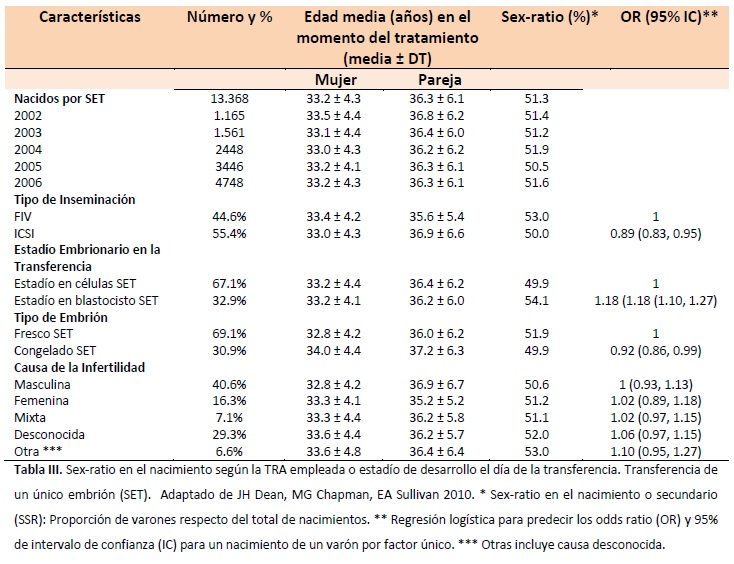
En este estudio se llevó a cabo una revisión de todos los ciclos de reproducción asistida realizados en Australia y Nueva Zelanda entre los años 2002 y 2006 mediante la base de datos ANZARD. En el estudio se incluyó un tamaño muestral de 13.368 nacidos a partir de 13.165 mujeres donde se transfirió un único embrión (SET).
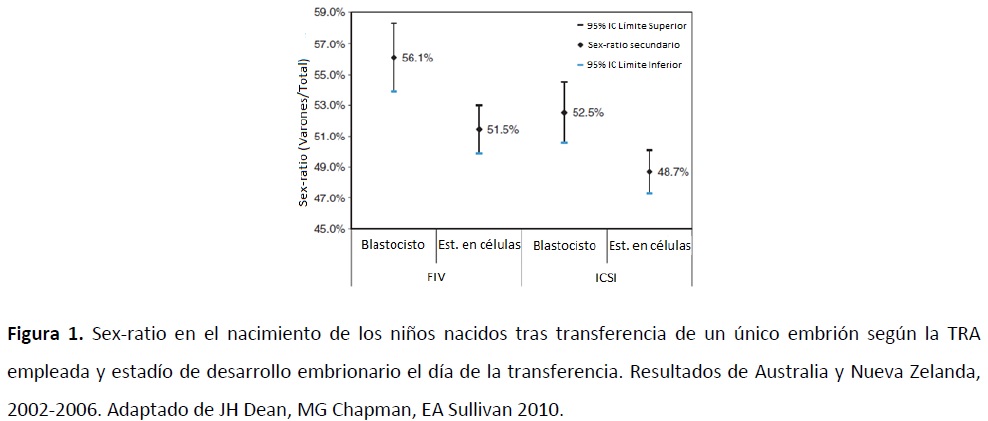
Se observó una diferencia estadísticamente significativa entre los grupos de FIV e ICSI (P = 0.001), donde un menor número de varones nacía tras ICSI (0.50), mientras que un mayor número nacían tras FIV (0.53) (Tabla III). Por otro lado, se observó un aumento en el sex-ratio secundario tras realizarse la transferencia en estadio de blastocisto (0.541) y un descenso al realizarse la transferencia en estadio de células (0.499), (P < 0.001). Además, se estratificaron los datos para cada subgrupo, y se calculó el sex-ratio para cada uno, tal y como se puede observar en la Figura 1.
El mayor sex-ratio fue el obtenido para los embriones del subgrupo IVF-BT (blastocisto) (0.561), y el menor sex-ratio fue el obtenido para los embriones del subgrupo ICSI-estadio de células (0.487), con una diferencia entre los grupos significativa (P < 0.001) respecto de la población general en el sex-ratio (0.515). La potencia de este estudio se apoya en su gran tamaño muestral. Sin embargo, una de las limitaciones del estudio es, al tratarse de un estudio multicéntrico, la gran variabilidad entre clínicas (medios de cultivo, protocolos de trabajo, criterio de selección…) que deberían tenerse en cuenta en estudios futuros con el fin de normalizar la población.
ESTUDIO DE WALID E. et al., 2014
En este estudio retrospectivo se llevó a cabo una revisión de 85.511 ciclos de TRA realizados en Reino Unido entre los años 2000 y 2010. Se incluyó en el estudio un tamaño muestral de 106.066 nacidos de sexo conocido a partir de 76.994 pacientes. El sex-ratio obtenido en el nacimiento tras aplicarse respectivamente una IA, FIV o ICSI, puede observarse en la Figura 2. La diferencia entre el sex-ratio obtenido tras aplicarse una IA o una FIV, no es significativa. Sin embargo, el sex-ratio obtenido tras aplicarse una ICSI (0.493) era menor que tras aplicarse una FIV (0.521) de forma significativa (P < 0.05), respecto de la población general en Reino Unido (0.513).
En la Figura 2 se observa que el sex-ratio fue significativamente mayor cuando la transferencia embrionaria se realizó en estadio de blastocisto tanto para FIV (0.539) como para ICSI (0.519), que cuando se realizó en estadio de células (0.521 y 0.489, respectivamente). El sex-ratio secundario de los nacidos tras todas las TRA combinadas fue significativamente menor que en la población general (0.507) (P = 0.0005).
ESTUDIO EN EL CHGUV
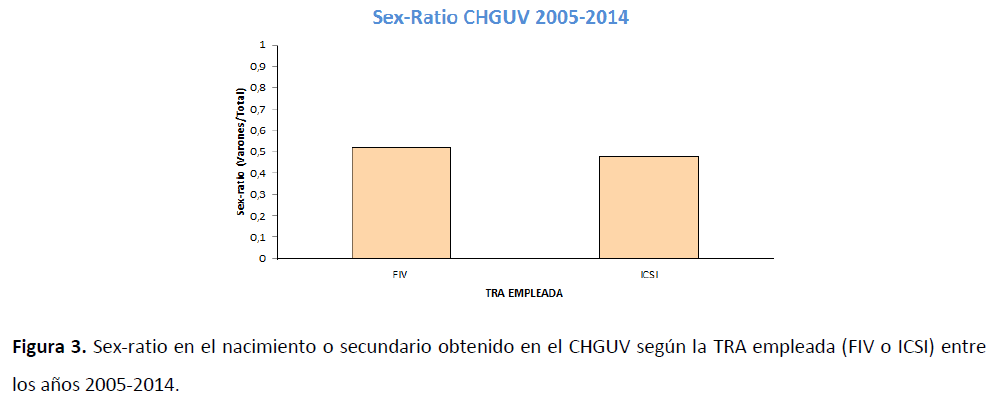
De los 42 nacimientos de FIV, 22 fueron varones y 20 fueron mujeres. Por otro lado, de los 150 nacidos tras ICSI, 72 fueron varones y 78 fueron mujeres. El sex-ratio de los nacidos mediante FIV fue de 0,524 mientras que el de los nacidos mediante ICSI fue de 0,480, tal y como puede observarse en la Figura 3. Sin embargo no se apreció diferencia estadísticamente significativa (P>0,05) entre ambos grupos (FIV o ICSI), aunque es posible observar una tendencia. En relación a estos resultados, cabe mencionar que para poder detectar con significancia estadística de 0.05 una desviación del 1,5%, es necesario un tamaño poblacional de en torno 12.000 individuos (Dean et al., 2010).
DISCUSIÓN
Las posibles causas de esta desviación en el sex-ratio de los niños nacidos tras una TRA permanecen inciertas. En base a los resultados obtenidos, se han desarrollado diferentes teorías para tratar de explicar este hecho.
TECNICA DE CAPACITADO SEMINAL EMPLEADA
Los dos procedimientos más utilizados para la capacitación seminal son los gradientes de densidad y el swim-up. En una revisión bibliográfica (Boomsma CM et al., 2004) se concluyó que no existía diferencia significativa en las tasas de implantación y de embarazo según la técnica de capacitado de semen empleada. Sin embargo, los gradientes de densidad pueden dar lugar a un enriquecimiento de espermatozoides portadores del cromosoma Y (Ericsson RJ et al., 1973), lo que podría contribuir a un aumento de la proporción de varones en las IAs y FIV, ya que es la técnica de capacitado empleada en estos estudios. No obstante, existen estudios (Walid E et al., 2014) que afirman que ni el swim-up ni los gradientes de densidad enriquecen selectivamente espermatozoides portadores del cromosoma X o Y de forma significativa, o incluso un enriquecimiento de portadores del cromosoma X, con lo que esta hipótesis podría ser descartada.
CAPACIDAD FECUNDADORA ESPERMÁTICA
Por otro lado, según Tarín et al., 2014, el aumento en el sex-ratio tras aplicarse una IA o FIV puede deberse a que los ovocitos puedan ser más susceptibles a la fecundación por espermatozoides portadores del cromosoma Y, y/o que los espermatozoides Y posean mayor capacidad fecundadora.
Según esta teoría, durante la foliculogénesis cambia la composición de la ZP (Zona Pelúcida) de los ovocitos, de forma que los altos niveles de testosterona en el líquido folicular varíen la composición de los hidratos de carbono de la ZP. Este cambio podría favorecer la fecundación por parte de los espermatozoides Y (Grant VJ et al., 2010). Además, existen genes disruptores que se expresan tras la meiosis en espermátidas que son capaces de alterar el sex-ratio afectando a la maduración y capacidad fecundadora de los espermatozoides, favoreciendo en este caso a los espermatozoides portadores del cromosoma Y (Ellis PJ et al., 2011).
MORFOLOGÍA ESPERMÁTICA
Por otro lado, en la ICSI el espermatozoide es seleccionado por el embriólogo, atendiendo a características morfológicas y de movilidad. Un menor sex-ratio tras ICSI se ha relacionado a la infertilidad por el factor masculino, ya que la ICSI es la técnica de elección en los casos de pobre calidad seminal (Setti AS et al., 2012), y donde los espermatozoides portadores del cromosoma Y presentan peor calidad morfológica, tendiendo a ser menos seleccionados bajo esta técnica (Walid E et al., 2014). Estos resultados coinciden con lo aportados por Tarín et al., (Juan J Tarín et al., 2014), donde se observó un descenso muy marcado en el sex-ratio al aplicarse una IMSI (micro-inyección de espermatozoides morfológicamente seleccionados por magnificación) siendo éste de 0.35, mientras que cuando se realizó una ICSI este descenso fue menor. Además, se sugirió la existencia de mecanismos iatrogénicos por los cuales el sex-ratio tras ICSI disminuye, ya que se observó este descenso incluso en los casos donde se aplicó ICSI a pesar de no existir factor masculino (Luke B et al., 2007).
POTENCIAL EVOLUTIVO EMBRIONARIO IN VITRO DEPENDIENTE DEL SEXO
La hipótesis consiste en que los embriones varones poseen un potencial evolutivo y tasas de crecimiento superiores respecto a los femeninos a partir del tercer día de cultivo in vitro, de forma que mostrarán más células en el momento de la transferencia embrionaria, tendiendo a ser seleccionados para transferir con mayor frecuencia embriones varones que femeninos (Milki AA et al., 2003). Según Bonduelle et al., 2002, los embriones XY presentan un mayor número de células en el estadio de blastocisto que los XX, lo que les podría conferir una ventaja evolutiva. Este hecho se debe a la diferente respuesta de cada sexo a los medios de cultivo in vitro, debido al segundo cromosoma X presente en los femeninos pero no en los varones, manteniendo estos últimos una mayor actividad evolutiva en la etapa de mórula (Gutierrez-Adan A et al., 2000).
Los genes responsables de la captación de glucosa y del metabolismo (glucosa-6-fosfato deshidrogenasa, G6PD) y de antioxidantes (hipoxantina fosforribosil transferasa HPRT) se encuentran en el cromosoma X, y por lo tanto los embriones femeninos presentarán una mayor captación de glucosa y detoxificación de radicales libres de oxígeno (Walid E et al., 2014). Estos radicales libres presentan un efecto estimulante de crecimiento embrionario (Peipoo J et al., 1995) y no sólo están involucrados en los mecanismos de daño celular, lo cual podría beneficiar el desarrollo de los embriones varones.
INACTIVACIÓN DEL SEGUNDO CROMOSOMA X EN EMBRIONES XX
Esta desviación podría deberse a una mayor mortalidad de los embriones XX en etapas tempranas post-implantación, debido en parte a una anormal inactivación del segundo cromosoma X (mecanismo de compensación de dosis) (Tarín et al., 2014).
Para resolver esta cuestión, se diseñó un modelo de implantación embrionaria in vitro, y se observó que en los embriones femeninos se producía una inactivación del cromosoma X en la mayor parte de sus células tras la implantación (Tarín et al., 2014). No obstante, esta inactivación post-implantación del cromosoma X podría estar alterada por factores epigenéticos, como la metilación de DNA, o deacetilación de histonas.
Este aumento o disminución en la expresión de genes relativos al cromosoma X puede afectar a la implantación o al desarrollo embrionario post-implantación. Además, se ha observado una expresión de genes relativos al segundo cromosoma X caótica, produciéndose anormalidades severas en tejidos embrionarios y extra-embrionarios y una aparente muerte embrionaria precoz (Schulz EG et al., 2013). Al parecer, el cultivo in vitro largo de embriones femeninos en condiciones sub-óptimas (oxígeno ambiental, variaciones de temperatura) puede ser uno de estos factores (Juan J Tarín et al., 2014).
Esta hipótesis es cuestionada por los siguientes motivos: no se observa una diferencia significativa en la tasa de abortos tras transferencia en Día 3 (8%) y transferencia en Día 5 (9,2%) (Glujovsky et al., 2012) como cabría esperar, y se observa una mayor tasa de nacimientos tras transferencia el Día 5 (38,9%) y Día 3 (31,2%). Según esta teoría, se debería esperar un mayor número de abortos y menor tasa de nacimientos tras transferencia en Día 5. Además, la mortalidad de embriones femeninos por una deficiente inactivación del cromosoma X ocurriría en etapas muy tempranas del embarazo, y estas pérdidas no se contabilizan en las tasas de aborto. En este contexto, cabe destacar que la transferencia en Día 5 se asocia a una mayor tasa de embarazo bioquímico (14.1%) que la transferencia en Día 3 (8.2%) (Poikkeus P et al., 2002).
Como conclusión, existe un cambio en el sex-ratio secundario significativo en los nacidos a partir de TRA. Diversos estudios concluyen que el sex-ratio secundario aumenta significativamente al transferir blastocistos, o embriones procedentes de una FIV, y disminuye al transferir embriones en estadio de células, o embriones procedentes de una ICSI. Estos dos factores tienen un efecto sinérgico.
Debido al progresivo aumento en el número de niños nacidos a partir de TRA en todo el mundo, son necesarias investigaciones futuras que traten los factores biológicos y ambientales que podrían alterar el sex-ratio tras una determinada TRA, y su posible efecto en la población general. Las clínicas de fertilidad de todo el mundo y los pacientes deberían ser conscientes de este hecho al aplicar una determinada TRA.
En el estudio en el Hospital General Universitario de Valencia, aunque no se observaron diferencias estadísticamente significativas, probablemente debido al pequeño tamaño muestral, se apreció una desviación en el sex-ratio según la técnica de inseminación empleada, a favor cuando se aplica una FIV y en contra al aplicarse una ICSI. Se realizarán futuros estudios sobre este hecho.
Referencias
1.Boomsma CM, Heineman MJ, Cohlen BJ, Farquhar C. Semen preparationtechniquesforintrauterineinsemination. Cochrane Database System Review 2004: CV004507.
2. Dean JH, Chapman MG, Sullivan EA. The effect on human sex-ratio at birth by assisted reproductive technology (ART) procedures – an assessment of babies born following sigle embryo transfers, Australia and New Zealand, 2002-2006. Epidemiology 2010.
3. Ellis PJ, Yu Y, Zhang S: Transcriptional dynamics of the sex chromosomes and the search for offspring sex-specific antigens in sperm. Reproduction 2011, 142:609–619.
4. Ghazzawi IM, Sarraf M, Alhasani S. Children born after ICSI: are we altering sex-ratio? Int J GynaecolObstet 2000;70(Suppl 2):866.
5. Glujovsky D, Blake D, Farquhar C, Bardach A: Cleavage stage versus blastocyst stage embryo transfer in assisted reproductive technology. Cochrane Database Syst Rev 2012, 7, CD002118.
6. Grant VJ, Chamley LW: Can mammalian mothers influence the sex of their offspring peri-conceptually? Reproduction 2010, 140:425–433.
7. Gutierrez-Adan A, Oter M, Martinez-Madrid B, Pintado B, De La Fuente J. Differential expression of two genes located on the X chromosome between male and female in vitro-produced bovine embryos at the blastocyst stage. MolReprod Dev 2000;55:146-51.
8. James WH. The human sex-ratio. Part 1: A review of the literature. Human Biology 1989;59:721-52.
9. Juan J Tarín, Miguel A García Pérez, Carlos Hermenegildo, Antonio Cano. Changes in sex-ratio from fertilization to birth in assisted-reproductive-treatment cycles.Reproductive Biology and endocrinology.2014, 12:56.
10. Källén B, Finnstrom O, Nygren K-G, Olausson PO. In vitro fertilization (IVF) in Sweden: infant outcome after different IVF fertilization methods. FertilSteril 2005;84:611-7.
11. Luke B, Brown MB, Grainger DA, Stern JE, Baker VL, Ginsburg E. The sex-ratio of singleton offspring in assisted-conception pregnancies.FertilSteril 2007, 88(Suppl 1):259.
11.Maryse Bonduelle, Inge Liebaers, Veerle Deketelaere, Marie-Paule Derde, m. Camus, Paul Devroey and André Van Steirteghem. Neonatal data on a cohort of 2889 infants born after ICSI (1991-1999) and of 2995 infants born after IVF (1983-1999). Human Reproduction Vol.17, No.3 671-694, 2002.
12. Milki AA, Jun SH, Hinckley MD, Westphal LW, Giudice LC, Behr B. Comparison of the sex-ratio with blastocyst transfer and cleavage stage transfer. J Assist Reprod Genet 2003;20:323–6.
13. Pergament E, Fiddler M, Cho N, Johnson D, Hofmgren WJ. Sexual differentiation and preimplantation cell growth. Human Reproduction 1994,9: 1730-2.
14. Poikkeus P, Hiilesmaa V, Tiitinen A: Serum HCG 12 days after embryo transfer in predicting pregnancy outcome. Hum Reprod 2002, 17:1901–1905.
15. Schulz EG, Heard E: Role and control of X chromosome dosage in mammalian development. CurrOpin Genet Dev 2013, 23:109–115.
16. Thatcher SS, Restrepo U, Lavy G, DeCherney AH. In vitro fertilization and sex-ratio. Lancet 1989;333:1025-6.
17. Walid E. Maalouf, Mina N. Mincheva. Bruce K. Campbell, Ian C. Effects of assisted reproductive technologies on human sex-ratio at birth. FertilSteril 2014 282-5.
18. Zarutskie PW, Muller CH, Magone M, Soules MR. The clinical relevance of sex selection techniques. FertilSteril 1989;52:891-905.