IMPACTO DE LA OLIGOZOOSPERMIA EN EL PATRÓN DE VACUOLIZACIÓN ESPERMÁTICA EN MUESTRAS EN FRESCO
Laura Prats, María Rodríguez Agüera, Olga Cairó, Sergio Rovira, Felipe del Río, Arturo Brassesco, Mario Brassesco
Centro de Infertilidad y Reproducción Humana (CIRH), Clínica Corachán · Plaza Eguilaz, 14. 08017 Barcelona
email:laboratorio@cirh.es
Fecha recepción: 27 septiembre 2010 · Fecha aceptación: 26 octubre 2010
Resumen:
Objetivo: Valorar la repercusión de la concentración en una muestra seminal en el patrón de vacuolización de los espermatozoides.
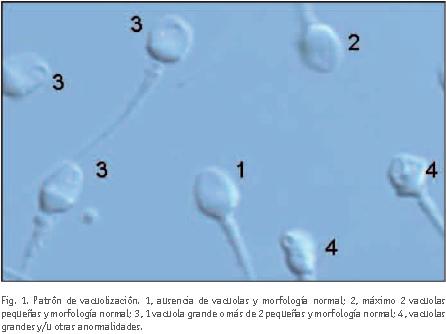
Material y métodos: Realizando un test de magnificación, se comparó el patrón de vacuolización de 70 muestras oligozoospérmicas (OZ) con un grupo control de 70 muestras normozoospérmicas (NZ). Se clasificaron 100 espermatozoides de cada muestra en 4 grados, en función de la presencia y tipología de las vacuolas: grado I (ausencia de vacuolas), grado II (máximo 2 vacuolas pequeñas), grado III (1 vacuola grande o más de 2 pequeñas), grado IV (vacuolas grandes y/u otras anormalidades).
Resultados: Se compararon los resultados de las medias aritméticas para cada grado de vacuolización. Los resultados obtenidos demuestran un descenso de espermatozoides de grados I (nZ: 3,66% vs OZ: 2,01) y II (nZ: 24,49% vs OZ: 14,14%) y un aumento de los de grado III (nZ: 43,43% vs 48,74%) y IV (nZ: 28,57% vs 35,08%) en las muestras oligozoospérmicas. Realizando un análisis de subgrupos de todas las muestras evaluadas en función de su concentración espermática, el descenso de buenos espermatozoides (grado I y II) es más acusado a partir de concentraciones ≤10 mill/ml.
Discusión: Los resultados evidencian la relación que existe entre la presencia de espermatozoides de buena calidad y la concentración espermática. En una muestra oligozoospérmica la probabilidad de encontrar buenos espermatozoides es menor. Rev Asoc est Biol Rep 2010; 15(2):35-38.
Palabras clave: Alta magnificación, oligozoospermia, vacuolización, concentración espermática.
IMPACT OF OLIGOSPERMIA ON VACUOLIZATION PATTERN FROM FRESH SPERM SAMPLES
Summary:
Aim: To assess the repercussion of sperm concentration in the spermatozoa vacuolization pattern.
Materials and Methods: The vacuolization pattern of 70 oligospermic samples have been compared to 70 normospermic control samples by high magnification test. One hundred spermatozoa from each sample were classified according to the presence and type of vacuole: grade I (normal form and no vacuoles), grade II (normal form and ≤ 2 small vacuoles), grade III (normal form, >2 small vacuoles or at least one large vacuole), and grade IV (large vacuole and abnormal head shapes or other abnormalities).
Results: Arithmetic means from each grade of vacuolization were calculated. The results from the oligospermic samples showed a decrease from grade I (nZ: 3.66% vs OZ: 2.01) and II spermatozoa (nZ: 24.49% vs OZ: 14.14%) and an increase in those from grade III (nZ: 43.43% vs 48.74%) and IV (nZ: 28.57% vs 35.08%). Making a subgroup analysis of all the assessed samples, good spermatozoa decrease (grade I and II) is more outstanding from ≤10 mill/ml concentration according to its sperm concentration.
Discussion: The results prove the correlation between good quality spermatozoa presence and sperm concentration. The probability of finding good spermatozoa is lower in an oligospermic sample. Rev Asoc Est Biol Rep 2010; 15(2):35-38.
Key words: high magnification test, oligospermia, vacuolization, sperm concentration.
INTRODUCCIÓN
Hasta hace poco tiempo la única técnica disponible en el laboratorio de fecundación in vitro para casos con factor masculino severo era la microinyección espermática convencional conocida como ICSI (intracytoplasmic sperm injection, Palermo et al, 1992). La ICSI permite la selección individual de los mejores espermatozoides presentes en una muestra en cuanto a motilidad y morfología. Esta selección del espermatozoide a 200x y 400x depende del buen criterio del biólogo, existiendo un cierto riesgo de seleccionar espermatozoides con algún tipo de anomalía morfológica y/o genética que pudiera afectar a los embriones.
Existen diversos factores asociados a la oligozoospermia (OZ), como la edad, distintas disfunciones hormonales, consumo de alcohol, factores genéticos e incluso idiopáticos, que podrían constituir probables mecanismos desencadenantes de una desregularización de la homeostasis testicular.
Diferentes estudios realizados hasta la fecha verifican que la OZ está directamente relacionada con un aumento de anomalías genéticas en espermatozoides. En 2003, Schmid, observó que en pacientes con OZ existía un incremento de aneuploidías y diploidías en los cromosomas sexuales de la línea germinal, así como niveles altos de daño en la cromatina espermática y un aumento de roturas en las cadenas de DNA (Schmid et al., 2003). Estos resultados indican que la infertilidad de estos pacientes oligozoospérmicos no se debe únicamente a la concentración espermática. Estudios posteriores corroboran la disminución de la calidad de la cromatina y DNA y el aumento de anomalías genéticas en espermatozoides de muestras OZ (Pang et al, 1999; Vegetti, 2000; Rubio, 2001; Calogero, 2001). Todo esto se traduce en peores tasas de implantación y embarazo.
Así, la utilización de la ICSI como única solución para la infertilidad de pacientes oligozoospérmicos genera dudas sobre si la selección del espermatozoide es la correcta.
Desde que Bartoov describiera en 2003 sus resultados con la valoración morfológica de los espermatozoides a grandes aumentos, muchos autores consideran esta técnica como el complemento ideal en el estudio del factor masculino (Bartoov et al., 2003). Esta técnica permite valorar ultraestructuras de los espermatozoides en tiempo real, antes imperceptibles mediante una ICSI convencional. Principalmente se valora la correcta morfología del espermatozoide y la presencia o ausencia de vacuolas nucleares. La presencia de vacuolas nucleares disminuye el éxito de los tratamientos de reproducción asistida (TRA) y aumenta sensiblemente las tasas de aborto temprano (Berkovitz, 2005, 2006). Vanderzwalmen también describe un efecto deletéreo tardío de la presencia vacuolar en el desarrollo de los embriones y propone una clasificación dependiendo del número y tamaño vacuolar en el núcleo espermático: grado I (ausencia de vacuolas y morfología normal), grado II (máximo 2 vacuolas pequeñas y morfología normal), grado III (1 vacuola grande o más de 2 pequeñas y morfología normal), grado IV (vacuolas grandes y/u otras anormalidades) (Vanderzwalmen et al., 2008). Observa que la fecundación de ovocitos con espermatozoides de grados III y IV afecta negativamente al desarrollo embrionario y la obtención de blastocistos de buena calidad.
Varios estudios posteriores (Franco et al, 2008; Junca et al, 2009) relacionan la presencia de vacuolas en la cabeza del espermatozoide con un aumento de la fragmentación y desnaturalización del DNA.
Garolla et al (2008) realizó un estudio a partir de muestras de pacientes con oligozoospermia severa por obstrucción parcial de vías seminales y pacientes con OZ severa por hipoespermatogénesis. Utilizando como grupo control muestras NZ, evaluó varios parámetros seminales: actividad de la membrana mitocondrial, fragmentación de DNA y aneuploidías. Los dos grupos de pacientes OZ, especialmente los pacientes con hipoespermatogénesis presentaron peor funcionalidad de la membrana mitocondrial y mayores tasas de fragmentación del DNA y de aneuploidías, que los pacientes con muestras NZ. Utilizaron la alta magnificación para seleccionar espermatozoides de pacientes con daño testicular y compararon espermatozoides morfológicamente normales con vacuolas y sin vacuolas. Los espermatozoides morfológicamente normales sin vacuolas presentaban valores significativamente mejores en cuanto a todos los parámetros estudiados.
Sabiendo que los espermatozoides de muestras OZ presentan mayores tasas de anomalías genéticas y daño de DNA y que el daño en el DNA se relaciona con la presencia de vacuolas nucleares, el objetivo de nuestro estudio fue evaluar si existe una correlación entre la concentración espermática y los patrones de vacuolización en este tipo de muestras.
MATERIAL y MÉTODOS
Para este estudio prospectivo se analizaron 140 muestras de semen mediante test de magnificación: 70 muestras oligozoospérmicas como grupo de estudio y 70 muestras normozoospérmicas como grupo control. A todos los pacientes se les realizaron, con anterioridad, al menos dos seminogramas para evaluar su concentración espermática. El diagnóstico se realizó siguiendo las recomendaciones de la Organización Mundial de la Salud (WHO, 1992) para la clasificación de muestras oligozoospérmicas (<20 mill/ ml) y normozoospérmicas (≥20 mill/ml).
Una vez hecho el diagnóstico, cada paciente entregó una nueva muestra de semen de la que se separó una alícuota de 5 μl para realizar el test de magnificación.
Para el análisis de las muestras se utilizó un microscopio invertido AM6000 equipado con óptica de contraste interdiferencial (DIC) desarrollado por Leica. El microscopio tiene 2 objetivos de inmersión, de 20 y de 100 aumentos. Con el objetivo de 100x obtenemos una imagen de 1000 aumentos ópticos que, si añadimos una lente suplementaria de 1,6x, nos permite conseguir hasta 1600 aumentos ópticos.
El microscopio está equipado con un VarioZoom digital con el que podemos obtener imágenes nítidas de hasta 16000 aumentos digitales.
Para la observación de los espermatozoides con DIC se utilizaron placas con fondo de vidrio (Willcodish®HBST -5040 Willco Wells, Holanda), donde se dispensó 1 µl de la muestra capacitada en una gota de 3 µl de polivinilpirrolidona (PVP), todo ello recubierto con aceite mineral. La observación para este estudio se realizó con el objetivo de 100x con aceite de inmersión.
Una vez visualizados, se clasificaron 100 espermatozoides de cada muestra según el modelo propuesto por Vanderzwalmen (2008), descrito anteriormente, en función de su patrón de vacuolización (ver fig. 1).
RESULTADOS
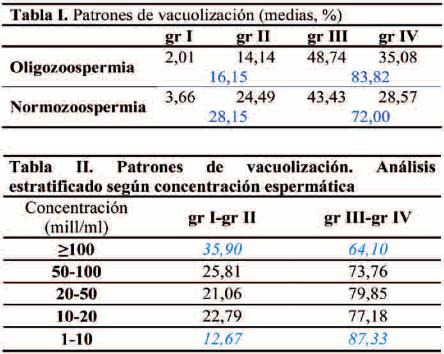
Para valorar los resultados se calcularon las medias aritméticas de los diferentes grados de vacuolización de las muestras oligozoospérmicas (OZ) y normozoospérmicas (NZ), obteniendo para las muestras NZ 3,66% de espermatozoides de grado I, 24,49% de grado II, 43,43% de grado III y 28,57% de grado IV. Para las muestras OZ se obtuvieron 2,01% de grado I, 14,14% de grado II, 48,74% de grado III y 35,08% de grado IV. Según se muestra en la Tabla I, se observa un menor porcentaje de los espermatozoides de grado I y II y un mayor porcentaje de los de grado III y IV en las muestras oligozoospérmicas respecto a las normozoospérmicas.
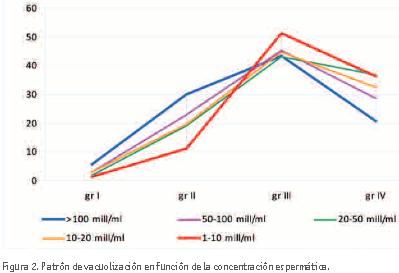
Evaluando con más detalle los resultados, se realizó un análisis de subgrupos en función de la concentración espermática de cada muestra, considerando los siguientes subgrupos: 1-9 mill/ml, 10- 19 mill/ml, 20-49 mill/ml, 50-99 mill/ ml y ≥100 mill/ml. Los resultados de este análisis quedan reflejados en la figura 2 y evidencian que, a medida que disminuye la concentración espermática, las muestras presentan menos espermatozoides de grado I y II y más de grado III y IV.
La tendencia demostrada para el análisis primario se hizo aún más evidente al calcular las medias de espermatozoides considerados de buena calidad (grados I + II) y de mala calidad (grados III + IV) en función de la concentración espermática (Tabla II), pues encontramos que, para muestras con concentraciones iguales o superiores a 100 mill/ml, obtuvimos 35,90% espermatozoides de buena calidad y 64,10% de mala calidad, mientras que en muestras con concentraciones espermáticas de 1-10 mill/ml obtuvimos 12,67% espermatozoides de buena calidad y 87,33% de mala calidad.
DISCUSIÓN
Según los resultados obtenidos en nuestro estudio todas las muestras OZ presentan más espermatozoides de mala calidad (grado III y IV) que las muestras NZ del grupo control.
Con el análisis de subgrupos observamos un claro patrón de vacuolización en función de la concentración espermática. A medida que disminuye la concentración espermática disminuye la presencia de espermatozoides de buena calidad (grado I y II) y aumenta la presencia de espermatozoides de mala calidad (grado III y IV).
A partir de una concentración espermática inferior a 10 mill/ml, la disminución de espermatozoides de buena calidad se hace aún más evidente. En concentraciones de 10-20 mill/ml encontramos 22,79% espermatozoides de buena calidad y con una concentración inferior a 10 mill/ml obtenemos aproximadamente la mitad (12,67%) de espermatozoides de buena calidad.
Al recibir una muestra de semen únicamente podíamos determinar parámetros básicos de un seminograma para realizar un diagnóstico. Actualmente disponemos de novedosas técnicas que nos pueden dar mucha información sobre el estado de los espermatozoides.
Por ejemplo, la aparición de un test de fácil aplicación para la valoración de la fragmentación de DNA espermático, facilita su incorporación a la rutina del laboratorio de andrología para determinadas muestras.
Por otro lado, el test de alta magnificación nos permite evaluar la presencia de orgánulos y alteraciones morfológicas del espermatozoide, antes imperceptibles en una ICSI convencional. Actualmente, ya está bien descrita la relación entre la fragmentación del DNA y la presencia de vacuolas nucleares en los espermatozoides.
En nuestro laboratorio, el microscopio de alta magnificación AM6000 nos facilita la posibilidad de realizar IMSI en pacientes que lo requieren por historia clínica, mejorando la probabilidad de embarazo. En el laboratorio de andrología proporciona la posibilidad de combinar los test de magnificación y fragmentación para evaluar la calidad seminal. Un estudio realizado en el CIRH, utiliza las dos técnicas para comprobar si el tratamiento multivitamínico con antioxidantes durante un mes produce una mejora tanto en la fragmentación del DNA como en la calidad espermática de las muestras. En este estudio, se incluyeron 33 pacientes y se evaluó una muestra antes y después del tratamiento, observándose una disminución significativa de la fragmentación del DNA y de la vacuolización nuclear (artículo en preparación).
Sin embargo, los test de magnificación resultan también una herramienta útil para el estudio del semen antes de empezar los tratamientos de TRA.
Con un test de magnificación in vivo podemos valorar el estado de los espermatozoides y podríamos llegar a dirigir a los pacientes hacia el TRA más apropiado para ellos. Wittemer et al. (2006) sugieren esta posibilidad después de realizar un test de magnificación a 55 parejas previo al TRA. Realizó tanto FIV como ICSI a todas las parejas y concluye que en las muestras con un ≥8% de formas normales, los resultados de fecundación son similares en la FIV e ICSI. En las muestras con <8% de formas normales se obtienen mejores tasas de fecundación con ICSI. La tasa de implantación es superior en las muestras con ≥8% de espermatozoides normales. De esta manera, según el resultado del test de magnificación se podría dirigir a los pacientes a FIV o ICSI.
Observando nuestros resultados y valorando la utilidad que nos puede ofrecer esta técnica podríamos recomendar realizar un test de magnificación de manera rutinaria en muestras con menos de 10 mill/ml, debido a la alta probabilidad de que estas muestras contengan un alto porcentaje de espermatozoides de mala calidad. De esta manera, con un simple test de magnificación se podría recomendar a estos pacientes la técnica de TRA más adecuada (FIV/ICSI o IMSI). En pacientes con una concentración espermática menor a 1 mill/ml prácticamente no existen espermatozoides para seleccionar y se debería realizar una ICSI.
AGRADECIMIENTOS
Agradecemos la colaboración en la obtención de resultados al Laboratorio de Andrología del Centro de Infertilidad y Reproducción Humana (CIRH, Clínica Corachán), especialmente a Gemma López y al doctor Juan Manuel Nardín (Sanatorio de la Mujer, Rosario, Argentina) por su colaboración en la elaboración y revisión de este estudio.
Referencias
Bartoov B,Berkovitz A, Eltes F, Kogosovsky A, Yagoda A, Lederman H, et al. Pregnancy Rates are higher with intracytoplasmic morphologically selected sperm injection than with conventional intracytoplasmic injection. Fertil Steril 2003; 80:1413-1419.
Berkovitz A, Eltes F, Ellenbogen A, Peer S, Feldberg D and Bartoov B. Does the presence of nuclear vacuoles in human sperm selected for ICSI affect pregnancy outcome? Hum Reprod 2006; 21:1787-1790.
Berkovitz A, Eltes F, Yaari S, Katz N, Barr I, Fishman A, et al. The morphological normalcy of sperm nucleus and pregnancy rate of intracytoplasmic injection with morphologically selected sperm. Hum Reprod. 2005; 20:185-190.
Calogero A, De Palma A, Grazioso C. Barone N, Burrello N, Palermo I, et al. High sperm aneuploidy rate in unselected infertile patients and its relationship with intracytoplasmic sperm injection outcome. Hum Reprod 2001; 6:1433-1439.
Garolla A, Fortini D, Meneazzo M, de Toni L, Nicoletti V, Selice V et al. High power microscopy for selecting spermatozoa for ICSI by physiological status. Reprod Biomed Online 2008; 17:610-616
Franco Jr JG, Baruffi RLR, Mauri AL, Petersen CG, Oliveira JBA,Vagnini L Significance of large vacuoles in human spermatozoa: implications for ICSI. Reprod Biomed Online 2008; 17:42-45.
Junca AM, Cohen-Bacrie P, Belloc S, Dumont M, Ménézo Y. Teratozoospermia at the time of intracytoplasmic morphologically selected sperm injection (IMSI). Gynecol. Obstet. Fertil. 2009; 37: 552-557.
Palermo G, Joris H, Devroey P,Van Steirteghem AC. Pregnancies after intracytoplasmic injection of single spermatozoon into an oocyte. Lancet 1992; 340:17-18.
Pang M.G, Hoegerman S.F, Cuticchia A.J, Moon SY, Doncel GF, Acosta AA, et al. Deteccion of aneuploidy for chromosomes 4, 6, 7, 8, 9, 10, 11, 12, 13, 17, 18, 21, X and Y by fluorescence insitu hybridization in spermatozoa from nine patients with oligoasthenoteratozoospermia undergoing intracytoplasmic sperm injection. Hum Reprod 1999; 14:1266-1273.
Rubio C, Gil-Salom M, Simón C, Vidal F, Rodrigo L, Mínguez Y et al. Incidence of sperm chromosomal abnormalities in a risk population: relationship with sperm quality and ICSI outcome. Hum Reprod 2001; 6:2084-92.
Schimd TE, Kamischke AK, Bollwein H, Nieschlag E and Brinkworth MH. Genetic damage in oligozoospermic patients detected by fluorescence in-situ hybridation, inverse restriction site mutation assay, sperm chromatin structure assay and comet assay Hum Reprod 2003; 18:1474-1480.
Vanderzwalmen P,Hiemer A, Rubner P, Bach M, Neyer A,Stecher A. Blastocyst development after sperm selection at hight magnification is associated with size and number of nuclear vacuoles Reprod Biomed Online 2008; 17:617-627.
Vegetti W, Van Assche E, Frias A, Verheyen G, Bianchi MM, Bonduelle M et al. Correlation between semen parameters and sperm aneuploidy rates investigated by fluorescence in-situ hybridization in infertile men. Hum Reprod 2000; 15:351-365.
Wittemer C, Pujol A, Boughali H, Viville S. The impact of high-magnification evaluation of sperm on ART outcome Hum Reprod 2006; 22 (Suppl1) i50-i60.
World Health Organization Laboratory Manual for the Examination of Human Semen and Sperm- Cervical Mucus Interaction (3rd edition). 1992. Cambridge University Press:Cambridge, UK.