IMPACTO DE LAS ANOMALÍAS DEL ESPACIO PERIVITELINO DE LOS OVOCITOS EN EL DESARROLLO EMBRIONARIO Y LA TASA DE IMPLANTACIÓN
Marta Herrero1,2, Pere Feliu1, Celia Vives1, Gerard Albaigès1, Mònica Ballesteros1, Teresa Planella1, Francesca Vidal3, Imma Saumell1 1Embriogyn, Centre de Reproducció Assistida i Diagnòstic Prenantal, Tarragona. 2Alumna en prácticas . Universitat Autònoma de Barcelona. Bellaterra, Barcelona 3Unitat de Biologia cel·lular. Universitat Autònoma de Barcelona. Bellaterra. Barcelona
email:isaumell@embriogyn.com
Fecha recepción: 27 Marzo 2011 · Fecha aceptación: 26 Abril 2011
Resumen: La posible relación entre las alteraciones de la morfología ovocitaria con las tasas de fecundación y el posterior desarrollo de los embriones es una cuestión aún discutida y todavía surge más controversia cuando las anomalías hacen referencia específicamente a alteraciones extracitoplasmáticas.
El objetivo de nuestro estudio ha sido evaluar la influencia de las alteraciones extracitoplasmáticas de los ovocitos sobre la tasa de fecundación en procedimientos de FIV-ICSI, en su posterior desarrollo embrionario y la tasa de implantación.
Se han estudiado un total de 476 ovocitos en metafase II procedentes de 65 ciclos de ovodonación. Los ovocitos evaluados se han agrupado en función de la presencia (grupo de estudio GE) o no de alteraciones en el espacio perivitelino (grupo control GC).
En nuestro estudio se ha observado que el 20,17% de los ovocitos analizados presentaban alteraciones en el espacio perivitelino. No se han encontrado diferencias estadísticamente significativas entre los dos grupos analizados para ninguno de los parámetros estudiados: tasa de fecundación, calidad embrionaria, tasa de compactación a d+4, tasa de blastocisto a d+ 5 y tasa de implantación.
A partir de nuestros resultados, podemos concluir que las anomalías en el espacio perivitelino no influyen en el resultado de la fecundación mediante ICSI, tampoco en el posterior desarrollo embrionario in vitro, ni en su capacidad de implantación. Rev Asoc Est Biol Rep 2011; 16(1):34-37.
Palabras clave: Morfología ovocitaria, espacio perivitelino, calidad embrionaria, tasa de fecundación
IMPACT OF OOCYTE PERIVITELLINE SPACE SIZE IN THE EMBRYO DEVELOPMENT AND IMPLANTATION RATE
Summary: The possible relationship between alterations of oocyte morphology, fertilization rate and subsequent embryo development is an issue still under debate and even more controversial when extracitoplasmatic alterations are the focus of the discussion.
The aim of this study was to evaluate the influence of oocyte extracitoplasmatic alterations in the rate of fertilization (ICSI) and the subsequent in vitro embryo development and implantation rate.
We have evaluated a total of 476 metaphase II oocyte from 65 cycles of oocyte donation. Oocytes have been grouped according to the presence (study group GE) or absence of alterations in the perivitelline space (control group GC).
Anomalies in perivitelline space have been observed in 20.17% of the oocytes evaluated. No significant differences were found between the two groups of study for any of the parameters analyzed: fertilization rate, embryo quality, compaction rate, blastocyst rate at day + 5 and implantation rate. From our results, it can be concluded that an increased perivitelline space does not affect ICSI fertilization outcome or subsequent in vitro embryo development. Rev Asoc Est Biol Rep 2011; 16(1):34-37.
Key words: oocyte morphology, perivitelline space, embryo quality, fertilization rate.
INTRODUCCIÓN
En el laboratorio de Fecundación in vitro (FIV) la evaluación de la morfología ovocitaria se realiza en el caso de la ICSI. Los parámetros más frecuentemente estudiados de la morfología ovocitaria son: alteraciones citoplasmáticas (granulosidad en el centro del ovocito, agregación del retículo endoplasmático liso, vacuolas e inclusiones citoplasmáticas), y alteraciones extracitoplasmáticas (exudados en el espacio perivitelino, espacio perivitelino incrementado, alteraciones del primer corpúsculo polar y anomalías de la zona pelúcida) (Ardoy et al., 2008).
La medida en que la morfología de los ovocitos está relacionada con la calidad y la funcionalidad de éstos suscita una controversia que se mantiene vigente a día de hoy. Varios estudios realizados sobre esta temática aportan conclusiones divergentes y sostienen posturas enfrentadas (Rienzi et al., 2011). Algunos autores sostienen la idea de que las alteraciones citoplasmáticas y extracitoplasmáticas del ovocito juegan un papel determinante en la fecundación y en el posterior desarrollo embrionario (Xia, 1997; Rienzi et al., 2008). En este sentido, trabajos concretos reflejan la influencia de las alteraciones extracitoplasmáticas en detrimento de la calidad embrionaria después de la ICSI (Suppinyopong et al., 2000; Lasiene et al., 2009), contrariamente a aquellos que asocian un mayor tamaño del espacio perivitelino a una mejor calidad embrionaria (Ten et al., 2007). Otros destacan que el espacio perivitelino incrementado reduce la tasa de fecundación o puede disminuir el potencial de implantación de los embriones obtenidos (Serhal et al., 1997). En contraposición a estos resultados, otros estudios no demuestran ninguna correlación entre la morfología ovocitaria, las tasas de fecundación y el desarrollo embrionario (Sutter et al., 1996; Balaban et al., 1998; Chamayou et al., 2006).
El presente estudio tiene como objetivo analizar específicamente si las alteraciones extracitoplasmáticas del ovocito, en concreto el incremento del espacio perivitelino y la presencia de exudado, tienen repercusión en la fecundación, el posterior desarrollo embrionario y el potencial de implantación de los embriones.
MATERIAL Y MÉTODOS
Se han analizado 476 ovocitos maduros destinados a FIV-ICSI de 65 ciclos de ovodonación realizados en nuestro centro. Los ovocitos estudiados proceden expresamente de donantes, para descartar posibles efectos de los factores de esterilidad femenina sobre la morfología ovocitaria. Las donantes (edad 18-35 años) han sido tratadas siguiendo una pauta de estimulación con gonadotropinas recombinantes y urinarias, y antagonistas de la GNRH, establecida por nuestro centro. Al tercer día después de la regla se inició la administración de FSHr (225,4 +/- 63,1 UI). El 94,5% recibieron LH durante la estimulación. La administración del antagonista se realizó en base al tamaño folicular (13-15 mm de diámetro máximo), y en régimen de administración diaria. La señal de la ovulación se indicó en d+10,7 habitualmente con 0,2 mg de triptolerina, más una ampolla de 2500 ul de hCG, administradas vía subcutánea 36 horas antes de la punción folicular.
Se han incluido en el estudio los ovocitos destinados a ICSI, independientemente de que en el mismo ciclo haya otros ovocitos que se destinen a FIV convencional. La decumulación de los ovocitos se ha realizado mediante un proceso combinado, enzimático (hialuronidasa) y mecánico (a través de pipetas de 140 y 170 μm de diámetro; Cook®).
Una vez realizada la decumulación y previamente a la ICSI se evaluó la morfología de los ovocitos en Metafase II. La valoración se llevó a cabo con aumentos de 40x a través de un microscopio de modulación de contraste de Hoffman (IX51 Olympus®).
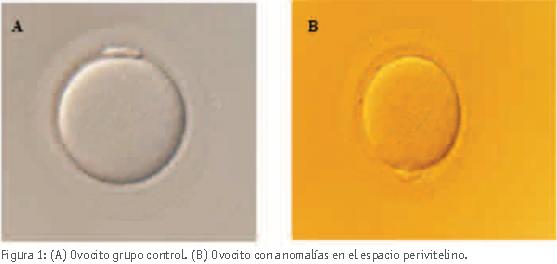
Los ovocitos fueron clasificados en función de la presencia (GE, grupo de estudio) o ausencia (GC, grupo control) de alteraciones en el espacio perivitelino. (Figura 1).
Los ovocitos microinyectados y los embriones obtenidos se mantuvieron en cultivo en microgotas de 40μl (G1+, Vitrolife serie 5+®), permitiendo el seguimiento individualizado de cada uno de ellos, evaluándose la tasa de fecundación y la calidad embrionaria. En los ciclos en los que se realizó un cultivo largo (G2+, Vitrolife serie 5+®) también se analizó la tasa de compactación a d+4 y la tasa de formación de blastocisto a d+5.
La transferencia embrionaria se realizó en día +3 o en día +5, según el número de embriones de buena calidad y cada caso en particular. La transferencia se llevó a cabo mediante catéter de transferencia Wallace® con seguimiento por ecografía, según el protocolo de transferencia del centro.
La tasa de implantación se calculó sólo teniendo en cuenta aquellos ciclos en los que se realizó la transferencia en día +3, incluyendo aquellos que se habían transferido embriones procedentes del mismo grupo de ovocitos (GE o GC) y que mediante ecografía se pudo confirmar la implantación de un 100% o 0%.
En conjunto, los parámetros evaluados en el estudio fueron: la incidencia de alteraciones en el espacio perivitelino, la tasa de fecundación, la tasa de embriones de buena calidad (transferidos y vitrificados), la tasa de compactación, la tasa de formación de blastocisto y, por último, la tasa de implantación de aquellos ciclos en los que la transferencia se realizó a d+3.
El análisis estadístico utilizado para establecer las comparaciones entre los resultados obtenidos respecto a los dos grupos (GE, GC) fue la comparación de proporciones (Prueba Z) con un nivel de significación p=0,05.
RESULTADOS
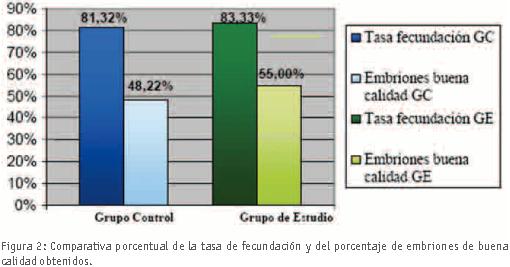
En los 65 ciclos realizados se analizaron un total de 476 ovocitos en Metafase II y un 20,17% (96/476) presentaron alteraciones en el espacio perivitelino. La tasa de fecundación en los ovocitos con un espacio perivitelino anómalo (GE) fue del 83,33% y en los ovocitos normales (GC) de un 81,32%. No se observaron diferencias estadísticamente significativas (p>0,05) en las tasas de fecundación entre los dos grupos de ovocitos (z = 0,46; p = 0,652). (Figura 2).
Se contabilizaron como embriones de buena calidad aquellos que por su buena morfología fueron transferidos o congelados (vitrificados). No se observaron diferencias estadísticamente significativas (p>0,05) entre los embriones de buena calidad obtenidos a partir de ovocitos con espacio perivitelino alterado respecto al de los procedentes de ovocitos normales (55,0% en GE vs 48,2% en GC; z = 1,12; p = 0,250). (Figura 2).
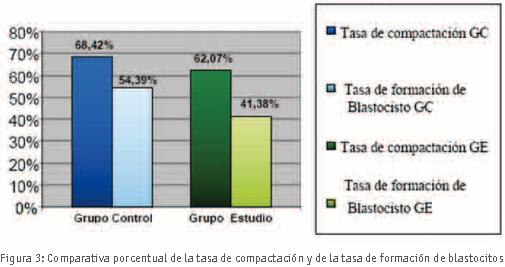
Se mantuvieron en cultivo largo hasta día +5 un total de 86 embriones. No se observaron diferencias estadísticamente significativas (p>0,05) entre los dos grupos de embriones en cuanto a tasa de compactación a d+4. De los embriones del grupo de estudio un 62,42% compactaron correctamente mientras que del grupo control compactaron un 68,42% (z = -0,55; p = 0,582). Tampoco encontramos diferencias estadísticamente significativas (p>0,05) entre los dos grupos de embriones que fueron capaces de formar blastocistos a d+5. La tasa de formación de blastocisto fue de 41,38% en el grupo de estudio y 54,39% en el grupo control (z = -1,14; p = 0,250). (Figura 3).
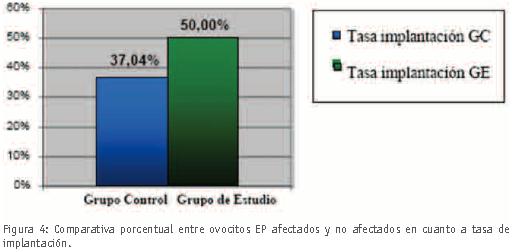
Los resultados obtenidos en cuanto a tasas de implantación tampoco mostraron diferencias significativas entre los dos grupos estudiados (50% en GE vs 37,04% en GC) (z = 0,23; p = 0,401). (Figura 4).
DISCUSIÓN
Tal y como queda reflejado en los Criterios ASEBIR, (Ardoy et al., 2008) existe disparidad respecto a las características de la morfología ovocitaria cuya influencia sea relevante en relación a los criterios de selección embrionaria. No obstante, la valoración previa a la ICSI de parámetros ovocitarios de fácil evaluación y la recopilación de los resultados obtenidos en los ciclos realizados, ofrecen datos de interés que podrían ser usados como marcadores de calidad o viabilidad embrionaria y capacidad de implantación (Balaban et al., 1998).
El tamaño del espacio perivitelino, así como la presencia de exudado, son características fácilmente valorables, y en este trabajo nos propusimos determinar su relación con diferentes variables de calidad embrionaria e implantación.
El estudio se ha realizado exclusivamente en ovocitos de donante para minimizar un posible efecto de la infertilidad femenina sobre los ovocitos. No obstante, nos sorprende la incidencia observada de alteraciones extracitoplasmáticas (20,17%). Este hecho, podría hacer pensar que estas alteraciones sean consideradas como variables de la normalidad y deberse a factores intrínsecos de los ovocitos (Balaban et al., 1998). De todas formas,no hay que olvidar que estos ovocitos se encuentran in vitro y habría que considerar si factores extrínsecos como la estimulación ovárica, la aspiración folicular, el cultivo y manipulación in vitro o la decumulación, pueden afectar estos parámetros (Balaban et al., 1998). Para profundizar en el posible efecto de la estimulación ovárica, sería interesante poder ampliar estos estudios relacionando la presencia de alteraciones extracitoplasmáticas según la media de ovocitos obtenidos por ciclo y la concentración de estradiol el día de la hCG, pudiendo así establecer una relación entre la presencia de alteraciones y la respuesta a la estimulación ovárica.
Algunos autores, con modelos animales (Suppinyopong et al., 2000; Talbot and dandekar, 2003), postulan que el tamaño del espacio perivitelino puede afectar al mecanismo de aproximación del espermatozoide a la membrana del ovocito, influyendo en la fusión de las membranas y en la tasa de fecundación. En nuestro estudio, las tasas de fecundación obtenidas son similares para ambos grupos de ovocitos (GE y GC), aunque por la naturaleza de la ICSI no podemos valorar la posible interferencia de las anomalías del espacio perivitelino sobre el proceso de fusión de membranas.
De esta forma, debemos ser conscientes de que la conclusión de este estudio sólo es aplicable a los ovocitos que han sido microinyectados, ya que en el estudio no se contabilizan los ovocitos de FIV convencional y por tanto no podemos asegurar que éstos tengan el mismo comportamiento.
Asimismo, los resultados indican que las anomalías observadas en el espacio perivitelino no afectan negativamente a la compactación de los embriones, ni tampoco a la formación del blastocisto. Por tanto, el establecimiento de los sistemas de adhesión celular y comunicación intercelular, necesarios para la formación de la mórula, no parecen verse afectados por el tamaño del espacio perivitelino. Dicho tamaño puede condicionar indirectamente el establecimiento de contactos interblastoméricos según la teoría clásica de determinación y diferenciación celular. De la misma manera, a partir de los resultados de nuestro trabajo y de la tasa de obtención de blastocistos en los dos grupos, se evidencia que la polarización y la determinación de las estirpes celulares tampoco se ven influidas por las anomalías extracitoplasmáticas ovocitarias.
El diseño experimental de nuestro estudio presenta una limitación respecto a la valoración de las tasas de implantación, ya que si en una transferencia los embriones proceden de los dos grupos (GE y GC), no han podido ser contabilizados por no saber con certeza qué embrión es el que ha implantado (a no ser que obtengamos un 0 o 100% de implantación). Sería necesario ampliar la serie de estudio y realizar transferencias homogéneas para poder confirmar los resultados obtenidos. No obstante, los resultados preliminares derivados del estudio realizado indican que el proceso de contracción y dilatación del embrión necesario para la eclosión no se ve alterado por la presencia de anomalías en el espacio perivitelino.
En conclusión, los resultados derivados de nuestro estudio coinciden con los reportados previamente por diferentes autores (Sutter et al., 1996; Balaban et al., 1998) y confirman que no se observa correlación entre la morfología alterada del espacio perivitelino y la capacidad del ovocito para desarrollar embriones de buena calidad y con un buen potencial de implantación.
Referencias
Ardoy m, Calderon G, Cuadros J, Figueroa mJ, Herrer R, moreno Jm, et al. Cuadernos de embriología Clínica.. II Criterios A seBIR de valoración morfológica de oocitos, embriones temprano y blastocistos humanos. 2nda ed.edita: Asociación para el estudio de la Biología de la Reproducción (AseBIR). 2008. p.9-16.
Balaban B,urman B,sertac A, Alatas C,Aksoys,mercan R. Oocyte morphology does not affect fertilization rate, embryo quality and implantation rate after intracytoplasmic sperm injection.Hum Reprod. 1998; 13:3431-3433
Chamayou s, Ragolia C, Alecci C,storaciG,maglia e, Russo e, et al.meiotic spindle presence and oocyte morphology do not predict clinical ICsI outcomes: a study of 967 transferred embryos. Reprod Biomed Online. 2006; 13:661-667
Lasiene K, Vitkus A, Valanci ūte A, Lasys V.morphological criteria of oocyte quality. medicina (Kaunas). 2009;45:509-515.
Rienzi L,ubaldi Fm, Iacobellim,minasi mG, Romanos, Ferreros, et al.significance of metaphase II human oocyte morphology on ICsI outcome. Fertil Steril
Rienzi L, Vajta G,ubaldi F. Predictive value of oocyte morphology in human IVF: a systematic review of the literature. Hum Reprod update. 2011; 17:34-45. 2008; 90:1692-1700
serhal PF, Ranieri Dm, Kinis A,marchants,Davies m, Khadum Im. Oocyte morphology predicts outcome of intracytoplasmic sperm
injection. Hum Reprod. 1997; 12:1267-1270
suppinyopongs, Choavaratana R, Karavakul C. Correlation of oocyte morphology with fertilization rate and embryo quality after intracytoplasmic sperm injection. J Med Assoc Thai. 2000; 83:(6)627-632
sutter P, Dozortsev D, Qian C, Dhont m. Oocyte morphology does not correlate with fertilization rate and embryo quality after intracytoplasmic sperm injection. Hum Reprod. 1996; 11:595-597
Talbot P, Dandekar P. Perivitelline space: does it play a role in blocking polyspermy in mammals? microsc Res Tech. 2003;61(4):349-357
Ten J,mendiola J, Vioque J, de Juan J, Bernabeu R. Donor oocyte dysmorphisms and their influence on fertilization and embryo quality. Reprod Biomed Online 2007; 14:40–48.
Xia P. Intracytoplasmic sperm injection: correlation of oocyte grade based on polar body, perivitelline space and cytoplasmic inclusions with fertilization rate and embryo quality. Hum Reprod. 1997; 12:1750-1755