LA DOBLE CARA DE LA ZONA PELÚCIDA
Ana Guerrero Mayo. Nuria Soler Balaguer.
Centro de formación "IVI Learning Center" Calle Guillem de Castro, 9, 46007 Valencia
anaguerreromayo@gmail.com
La Zona Pelúcida (ZP) es una matriz glicoproteica translúcida que rodea al ovocito de los mamíferos y que se mantiene en el embrión preimplantacional hasta el estadio de blastocisto, observándose variaciones tanto en la estructura como en la funcionalidad comparada con la ZP ovocitaria. En humanos, está compuesta por 4 glicoproteínas designadas como ZP1, ZP2, ZP3 y ZP4 y presentan un patrón de glicosilación especie-específico que se considera fundamental para el reconocimiento gamético, la inducción de la reacción acrosómica y el bloqueo de la polispermia. Además, durante el desarrollo embrionario preimplantacional esta capa es esencial en la protección del embrión, la comunicación materno-cigótica, la prevención de la gemelaridad monocigótica mediante la unión de los blastómeros y la diferenciación de los blastómeros a trofoblasto (hipótesis de polarización). También juega un papel importante en la eclosión o hacthing embrionario, cuyo proceso depende tanto de la acción mecánica y enzimática del blastocisto como la actividad lítica uterina. La disposición de los filamentos de la ZP permite el análisis de ésta por microscopia de polarización (PolScope) ya que le confiere una propiedad óptica denominada birrefringencia, permitiendo definir la estructura trilaminar que presenta. Debido a que la formación de la ZP depende del desarrollo folicular, las propiedades de la ZP humana podrían estimar la calidad del ovocito/embrión y, por tanto, la tecnología de PolScope se podría utilizar como herramienta clínica no invasiva para seleccionar los ovocitos/ embriones de mayor calidad en una cohorte dada. También se ha propuesto la inmunización contra la ZP como método anticonceptivo, aunque siguen siendo necesarias más investigaciones para esclarecer los posibles efectos secundarios no deseados. Así, la ZP se convierte en un objeto de estudio de gran interés debido al doble papel que puede jugar en el panorama reproductivo actual.
INTRODUCCIÓN
La Zona Pelúcida (ZP) es una matriz glicoproteica extracelular que rodea al ovocito y se mantiene durante todo el desarrollo embrionario hasta la implantación en el endometrio. Se encarga de múltiples funciones tanto en el ovocito (previamente a la fecundación) como en el embrión hasta el estadio de blastocisto.
El análisis estructural de la ZP es posible gracias a la microscopia de polarización que se basa en la birrefringencia, una propiedad óptica única de moléculas altamente ordenadas como las fibras de la ZP, siendo indicativo de la densidad, la alineación de las moléculas y su grosor (Oldenbourg, 1999). Actualmente, uno de los campos de investigación en auge en reproducción asistida es la identificación de marcadores no invasivos que nos permitan identificar los mejores gametos y/o embriones para mejorar las tasas de implantación y embarazo. Así, el análisis de la ZP mediante el PolScope puede ser una herramienta clínica muy útil.
Por otro lado, completamente opuesto, también es de gran interés la búsqueda de nuevos tratamientos anticonceptivos que puedan mejorar los ya existentes para evitar los efectos secundarios que producen los mismos. Debido a que la ZP es un elemento clave en la fecundación, se ha propuesto la inmunización contra sus proteínas para bloquear la interacción con el espermatozoide y así evitar el embarazo.
El objetivo de este trabajo es describir los aspectos estructurales y funcionales de la ZP tanto en el ovocito como en el embrión pre-implantacional y relacionar estas características con sus posibles aplicaciones en la clínica.
ESTRUCTURA DE LA ZP
En el ovocito
Las glicoproteínas de la ZP parecen ser secretadas coordinadamente por el ovocito durante la foliculogénesis, como se observa en el ratón (Soyal et al., 2000), mientras que hay evidencias en otras especies, incluida la humana, de que las células de la granulosa también contribuyen a la producción de dichas proteínas (Sinowatz et al., 2001). En los humanos la ZP tiene un espesor de aproximadamente 16 μm, rodea a un ovocito de un diámetro considerable (120 μm) y está compuesta por cuatro glicoproteínas: ZP1 (528 aa, 100 kD), ZP2 (602 aa, 75 kD), ZP3 (328 aa, 55kD) y ZP4 (444 aa, 65 kD) (Lefievre et al, 2004).
A nivel molecular, en el modelo murino, bastante aceptado para la mayoría de los mamíferos superiores, dos de las glicoproteínas, ZP2 y ZP3, interactúan entre sí formando unidades heterodiméricas que se disponen periódicamente en filamentos largos. Estos filamentos parecen estar interconectados por ZP1, la proteína más voluminosa de la ZP del ratón (Wassarman and Mortillo, 1991). Así, se constituye una capa que separa el oolema de la región más interna del folículo, la corona radiata. Prolongaciones celulares de esas células atraviesan la ZP y forman con la membrana plasmática del ovocito los puentes celulares (gap-junction) esenciales en la comunicación celular.
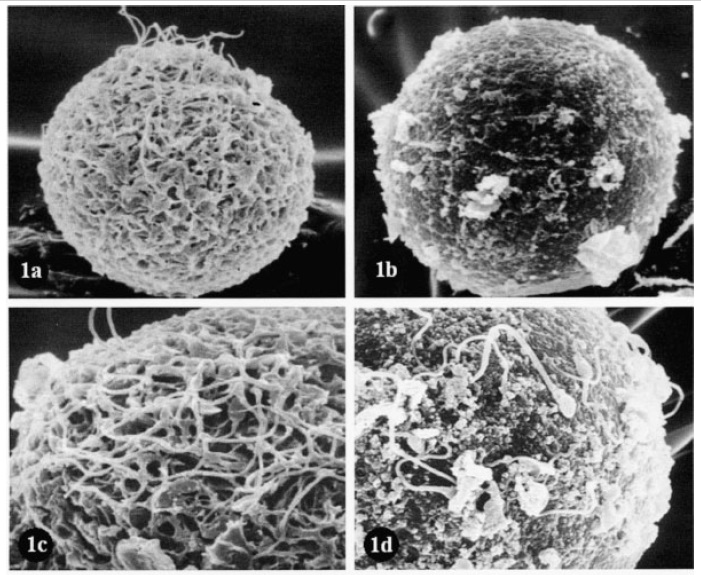
Como podemos observar en la figura 1, existe una marcada asimetría entre las capas externas y las internas de la ZP (Shalgi and Raz, 1997). La superficie externa, de apariencia amorfa y esponjosa, contiene poros de mayor tamaño que las capas internas, lo que facilita la penetración de los espermatozoides, así como de diferentes moléculas.
Tabla 1. Promedio y varianza del grosor y la retardancia medida en ovocitos y embriones individuales. (Adaptada de Pelletier et al, 2004) Nota: Los valores son la media ± DE (one-tailed t-test; P < 0.05). a Diferencia estadísticamente significativa entre ovocitos inmaduros y maduros. b Disminución estadísticamente significativa entre ovocitos maduros y embriones en día 3. c Aumento estadísticamente significativo entre ovocitos maduros y embriones en día 3.
Figura 1. Análisis de la ZP por microscopia electrónica de barrido. (a) Ovocito humano no fecundado. Red porosa de la ZP (x2000). (b) Ovocito humano no fecundado. Superficie compacta y lisa de la ZP (x2000). (c) Mayor aumento de (a). La estructura porosa es evidente (x 4000). (d) Mayor aumento de (b). Se muestra una estructura densa y compacta (x 4000). Adaptada de Familiari et al, 2006.
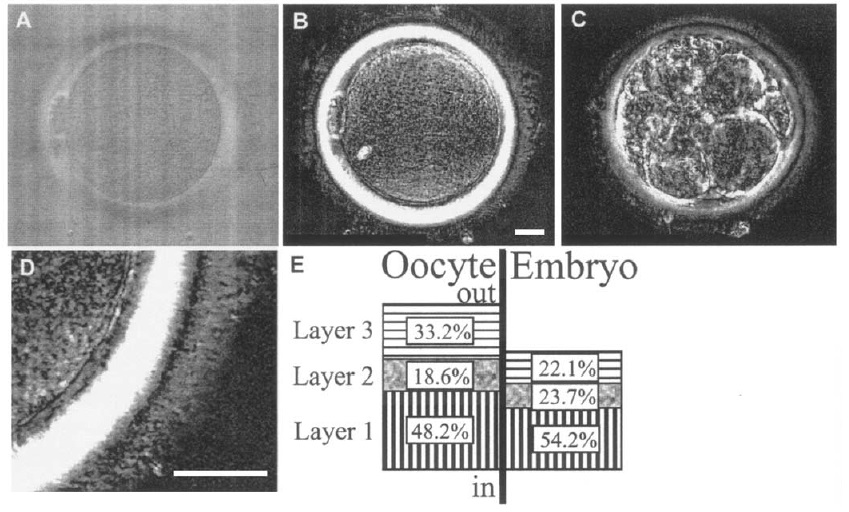
Gracias a la microscopía de polarización, fue posible analizar la ZP a nivel subestructural, mostrando una estructura trilaminar (Pelletier et al, 2004). En el ovocito, los filamentos de la capa interna (capa 1) están orientados radialmente, mientras que los filamentos de la capa externa (capa 3) están orientados tangencialmente. Debido a esta organización bien estructurada, estas capas aparecen muy birrefringentes con el PolScope (Fig. 2). Las capas interna y externa están separadas por una capa intermedia (capa 2) que presenta una birrefringencia mínima, lo que sugiere una orientación aleatoria de los filamentos (Silva et al, 1997). Tanto en el ovocito como en el embrión temprano la capa más interna (capa 1) es la más gruesa y la que mayor retardancia exhibe, mostrando una mayor intensidad de brillo en el PolScope. La capa más externa (capa 3) es más delgada y exhibe menor retardancia que la capa 1, aunque es la capa intermedia (capa 2) la que presenta menor grosor y mínima retardancia.
En el embrión
La ZP de los embriones difiere significativamente tanto en el grosor como en la retardancia de las tres capas individualmente y en general, comparada con la ZP de los ovocitos maduros (Tabla I) (Pelletier et al, 2004).
La disminución del grosor general de la ZP de los embriones se debe sobre todo a la disminución de la capa más externa (capa 3) (Fig. 2E). Es bien conocido que los embriones en estadio de blastocisto tienen una ZP más delgada que los ovocitos (Balaban et al, 2002). Sin embargo, el grupo de Pelletier demostró que esa disminución ya está presente en estadio de segmentación, concretamente en día 3.
Es interesante señalar que se encontraron diferencias entre las capas de la ZP humana entre los ovocitos y los embriones de una cohorte determinada. Gracias al marcado de epítopos de las proteínas de la zona se demostró que las capas de la zona se establecen en secuencia temporal, con la capa interna colocada en último lugar (Qi et al, 2002). Las diferencias regionales o espaciales en la producción enzimática o proteica dentro del ooplasma y el grado de unión de las células de la granulosa al ovocito podrían alterar la deposición de las proteínas de la zona, dando como resultado la variabilidad en los parámetros analizados de la ZP entre los ovocitos individuales (Pelletier et al, 2004).
FUNCIONES DE LA ZP
En el ovocito
Reconocimiento gamético, activación del ovocito y bloqueo espermático.
Pese a no existir un único modelo de reconocimiento gamético, el modelo más ampliamente aceptado es el de reconocimiento de glicanos unidos a ZP3 (Avella et al, 2013).
Figura 2. La estructura multilaminar de la ZP se puede cuantificar con PolScope. (A) Ovocito humano, fotografiado con óptica diferencial de contraste de interferencia y (B) con el PolScope. (C) Embrión en día 3 con microscopía PolScope. (D) El grosor y la retardancia de la ZP y cada una de sus capas se midieron con un sistema computarizado de análisis de imágenes (Spindle View 3.9 (E) Contribuciones de las capas individuales al grosor total de la ZP de los ovocitos y los embriones en día 3. Barras de escala = 20 μm. Adaptada de Pelletier et al, 2004.
Este modelo indica que los espermatozoides se unen a los O-glicanos ligados a las serinas (Ser332 y Ser334) de la proteína ZP3 (Figura 3, panel izquierdo). Así, esta unión induciría la reacción acrosómica en el gameto masculino permitiendo la fecundación, tras la cual los glicanos de la ZP3 serían eliminados por una glicosidasa liberada por los gránulos corticales del oocito evitándose la unión de un nuevo espermatozoide y, por tanto, la polispermia. Sin embargo, posteriores estudios realizados el pasado 2010 por Gahlay y colaboradores indicaron que los residuos Ser332 y Ser334, aunque participen en el proceso, no juegan un papel limitante en la interacción espermatozoide-ovocito.
Recientemente, se ha reportado que, si ZP2 se mantiene intacta, los espermatozoides se unen a la ZP independientemente de la fecundación y exocitosis de los gránulos corticales (Rankin et al., 2003; Baibakov et al., 2007; Gahlay et al., 2010; Burkart et al., 2012).
Así, en la búsqueda de nuevos modelos de unión espermatozoide-ovocito se generaron diferentes líneas de ratones transgénicos que expresaban las glicoproteínas humanas ZP1, ZP2, ZP3 y ZP4. Los resultados mostraron que los espermatozoides humanos fueron capaces de unirse a la ZP únicamente en presencia de ZP2 (Yauger et al, 2011; Baibakov et al., 2012). En estos oocitos, el esperma humano penetraba la ZP y se acumulaba en el espacio perivitelino, siendo sin embargo, incapaz de fecundar a los ovocitos de ratón (Baibakov et al., 2012). Estos resultados dieron pie a un nuevo modelo de reconocimiento de gametos, el modelo de escisión de ZP2, en el cual se propone que el ligando de los espermatozoides humanos a la ZP es un dominio N-terminal de ZP2. Así, tras la fecundación, ZP2 se escinde, evitando la unión de nuevos espermatozoides a la superficie de la ZP (Figura 3, panel derecho).
Si bien podríamos pensar que la funcionalidad de ambos modelos es contradictoria, existen posibles explicaciones que apuntan a la complementariedad (no exclusión) de ambos modelos. Una posibilidad es que ZP2 y ZP3 formen un heterodímero de forma que el espermatozoide de ratón en primer lugar se uniría a ZP3 mediante los glicanos y esta unión induciría la reacción acrosómica del gameto masculino. Solamente los espermatozoides acrosoma reaccionados se unirían a ZP2. Además, la correcta escisión de ZP2 es imprescindible para conseguir un bloqueo eficiente de la polispermia.
En el embrión
Comunicación materno-cigótica
Como el embrión está revestido por la ZP hasta poco antes de la implantación, todas las señales materno-embrionarias tienen que atravesarla: mientras continúa el desarrollo embrionario las proteínas segregadas por el oviducto y por el útero, así como aquéllas embrionarias, se incorporan a la zona pelúcida cambiando sus propiedades morfológicas y bioquímicas. Así se han reportado en la literatura diversas moléculas que actúan durante la implantación, de entre las cuales, la familia del factor de crecimiento epidérmico (EGF) es de especial interés ya que hay evidencias de un incremento muy local de dicha ruta de señalización durante la ventana de implantación (Das et al., 1994, 1997, Bush et al., 1998). También han recibido especial atención los datos que sugieren que la implantación puede ser bloqueada en ratones por un antagonista de IL-1 (Simón et al., 1994; Karagouni et al., 1998). Curiosamente, numerosos hallazgos sugieren que los recubrimientos embrionarios pueden desempeñar un papel en este contexto de manera que la ZP actuaría como un buzón en la señalización cruzada entre la madre y el embrión.
Estas señales se acumularían en la capa glicoproteica pudiendo sufrir diversas modificaciones como ya se ha demostrado para otras especies (conejo y caballo). Así, Herrler et al. (1998a-b) publicaron la presencia de la proteína 3 de unión al factor de crecimiento similar a la insulina (IGFBP 3) y del factor de crecimiento epidérmico de unión a la heparina (HB-EGF) en la ZP de embriones de conejo y caballo. Es concebible que, por ejemplo, IGFBP 3 podría actuar en este caso regulando el transporte y la disponibilidad de IGF, favoreciendo el crecimiento y el desarrollo del embrión (Herrler et al., 2000).
Función morfogenética
Hace tiempo que se sabe que la ZP actúa como un andamio físico que mantiene unidos a los blastómeros evitando la gemelaridad monocigótica, mientras los complejos de adhesión célula-célula no están todavía bien desarrollados (Denker, 2000). Los embriones exentos de zonas se desarrollan bien en condiciones in vitro desde estadios de escisión hasta blastocistos mientras que el desarrollo es muy pobre después de la transferencia de tales embriones al tracto genital femenino (Bronson and McLaren, 1970; Modlinski, 1970). Deben haber alcanzado la etapa tardía de mórula o blastocito para desarrollarse bien después de la transferencia libre de zona (Denker, 2000). Una explicación para este fenómeno se encuentra fácilmente en el contexto de la hipótesis de polarización (Johnson et al., 1981, 1986a, b; Fleming, 1992). Esta hipótesis establece que la diferenciación a trofoblasto, el primer epitelio en la embriogénesis, depende de señales posicionales, es decir, interacciones adhesivas célula-célula que deben dominar en un polo (el polo basolateral prospectivo) de la célula; mientras que también debe existir una superficie libre donde tales interacciones no ocurren. Esta superficie libre adquirirá entonces las propiedades de un dominio de membrana plasmática apical, de modo que se logre la organización polar típica de un epitelio simple. Por lo tanto, para la diferenciación del trofoblasto es esencial proporcionar un entorno no adhesivo a los blastómeros externos. Esto parece ser fisiológicamente la ZP, que puede ser reemplazada, in vitro, por el medio de cultivo tisular.
Proceso de eclosión/hatching embrionario
En condiciones de cultivo, la eclosión de los blastocistos tardíos es debida a su acción mecánica mediante series de contracciones y reexpansiones (Cohen, 1991), provocando el estiramiento y adelgazamiento de la ZP, aunque la principal responsable es una dilatación local producida por algunas células del trofoblasto que se hunden en la ZP en el curso de la expansión. Perona y Wassarman (1986) propusieron que además de la fuerza mecánica, una proteinasa tipo tripsina (74 kDa) derivada del trofoectodermo, denominada Strypsin, está directamente involucrada en el adelgazamiento de la ZP. De la misma manera, se ha estudiado el papel de las catepsinas en la eclosión embrionaria en modelos animales (Sireesha et al., 2008), reportándose la expresión de genes de catepsina tanto en células del trofoectodermo como de la masa celular interna (Adjaye, 2005); sin embargo, el papel de las catepsinas en la eclosión de blastocitos humanos no se observó hasta 2017, cuando Syrkasheva y colaboradores reportaron un aumento significativo en la expresión de ARNm de la catepsina V (CTSV) en los blastocistos en eclosión (Syrkasheva et al, 2017). No obstante, al menos para el hámster, Gonzales y Bavister (1995) demostraron que el escape de la zona pelúcida in vivo es diferente del proceso de eclosión observado in vitro ya que existe una contribución uterina al escape de la ZP mediante la producción de unas lisinas uterinas que ayudan a la disolución de la matriz glicoproteica (Orsini y McLaren, 1967; Rosenfeld y Joshi, 1981). Montag y colaboradores (2000) observaron que la eclosión in vitro en ratones se inicia tan pronto como esté disponible un número suficiente de células embrionarias para vencer la resistencia de la zona, por lo que dicho proceso depende a su vez de la estructura de la ZP en sí misma, mientras que con la utilización de láser la eclosión ya puede iniciarse con menos células (Montag et al., 2000). En este caso, el menor número de células embrionarias detectadas en blastocistos libres de zona in vivo indica que el mecanismo subyacente de escape de la ZP es diferente, no depende exclusivamente de la expansión del blastocisto y presumiblemente involucra factores líticos del útero, tal y como también lo apoyan Lin y colaboradores (Lin et al., 2001). Centrándonos en los humanos, recientemente se ha realizado un estudio prospectivo de casos y controles para identificar predictores celulares y genéticos del éxito de eclosión de blastocitos humanos en programas de reproducción asistida (Syrkasheva et al., 2017). En dicho estudio observaron que el 75% de los blastocistos humanos morfológicamente normales no pueden abandonar la ZP espontáneamente (Practice Committee et al., 2014). Sin embargo, no se ha reportado una asociación entre la tasa de fallo de eclosión y el grosor de la ZP, lo que sugiere que la eclosión es una etapa caracterizada por un determinismo cronológico y, en gran medida, cronogenético. Así, concluyeron que la eficacia de la eclosión espontánea de los blastocistos humanos in vivo no está determinada por la calidad de la ZP y los gametos, sino por la calidad de los blastocistos en sí.
Figura 2. Modelos de reconocimiento de gametos. El modelo específico de liberación de glicanos (panel izquierdo) propone que los O-glicanos de Ser332 y Ser334 en ZP3 actúen como ligandos para un receptor de superficie de esperma. Después de la fertilización, los gránulos corticales liberarían una glicosidasa que eliminaría los O-glicanos y explicaría la incapacidad de los espermatozoides de unirse a los embriones de 2 células. El modelo de escisión ZP2 (panel derecho) propone que los espermatozoides se unen a un dominio N-terminal de ZP2. Después de la fecundación, la ovastacina (codificada por Astl), liberada por los gránulos corticales, eliminaría por proteólisis el sitio de acoplamiento de ZP2 lo que impide que los espermatozoides se unan a los embriones de 2 células. Cada modelo ha sido probado usando la transgénesis del ratón. La zona pelúcida del ratón que contiene ZP3 humana en lugar de la de ratón no es compatible con la unión del esperma humano y los ratones mutantes Zp3S332A; S334A tienen fertilidad normal. Estos resultados no son consistentes con el modelo ZP3 de liberación de glicanos, tal como se articula actualmente. Por el contrario, la zona pelúcida de ratón que contiene ZP2 humana en lugar de ratón soporta la unión / penetración de esperma humano y los ratones Zp2Mut y AstlNull en los que ZP2 permanece sin escindir en embriones de 2 células apoyan la unión de esperma de novo a pesar de la fecundación y exocitosis de gránulos corticales. Estos resultados apoyan el modelo de escisión ZP2 del reconocimiento de gametos (Gahlay et al., 2010; Baibakov et al., 2012; Burkart et al., 2012)
APLICACIONES
En el ovocito: inmunocontracepción
Como ya sabemos la ZP se encarga del reconocimiento gamético específico de especie y la inducción de la reacción acrosómica. Así, la inmunización contra la ZP de las hembras conduce a un bloqueo de la fertilidad en varios modelos animales (Gupta et al., 1997), observándose, en la inmunización pasiva con anticuerpos contra las proteínas ZP, que los anticuerpos séricos pueden pasar al fluido folicular y bloquear las interacciones entre los oocitos y las células de la granulosa (Skinner et al., 1996). Esto sugiere que los anticuerpos contra las proteínas ZP pueden interferir con el desarrollo folicular normal (Dunbar, 1990). Además, la inmunización activa con ciertos componentes de la ZP, que induce un bloqueo de la fertilidad que puede ser reversible o no (Jewgenow and Finkel, 1999), puede provocar una respuesta inmune que altere el desarrollo normal de los folículos ováricos (Prasad et al., 1996, 1997). Recientemente, se ha documentado que la inmunocontracepción activa con componentes de la ZP porcina (pZP) provocó una supresión profunda y temporal de la hormona antimülleriana (AMH) en las yeguas tratadas (Joone et al., 2018). Clínicamente, seis de siete yeguas tratadas con pZP demostraron un anestro intermitente persistente durante este tiempo, caracterizado por ovarios bilaterales pequeños, concentraciones de progesterona sérica basales y un recuento de folículos antrales bajo (Joone et al., 2017). La disminución de la AMH durante la inmunocontracepción con pZP puede deberse a una disminución del número de folículos antrales y/o a la regulación a la baja de la expresión de AMH por las células de la granulosa. Preferentemente, se sugiere que la supresión ovárica posterior a la vacunación pZP en la yegua se debe a una destrucción inmunitaria de los folículos en desarrollo, así como a una inhibición de la foliculogénesis debido a la interferencia de los anticuerpos en la comunicación de los ovocitos con las células de la granulosa (Bechert et al., 2013).
Pero sigue siendo necesaria una mayor experimentación para determinar qué proteínas de la ZP no influyen de forma irreversible en el desarrollo folicular normal, pero provocan anticuerpos que interfieren con la unión gamética.
En el embrión: Polscope (herramienta clínica no invasiva) para predecir la implantación
Shen y colaboradores (2005) fueron los primeros en correlacionar la magnitud de la retardancia de la ZP, en particular la de la capa interna, con la probabilidad de concepción.
El estudio se realizó en 166 oocitos seleccionados, según la puntuación pronuclear en día 1, para la transferencia después de ICSI (63 pacientes, 32’8 ± 4’4 años). Los datos se compararon entre dos grupos: oocitos de ciclos de concepción (CC; 65 ovocitos / 23 pacientes) y oocitos de ciclos sin concepción (NCC; 101 ovocitos / 40 pacientes) y siempre teniendo en cuenta la edad materna. Finalmente, concluyeron que la magnitud de la retardancia en la capa interna de la zona fue un 30% mayor (p < 0’001) en los oocitos del CC en comparación con el grupo NCC antes del ICSI. En concreto, si la magnitud de la retardancia de la capa interna de la ZP es superior a 3 nm es predictiva del grupo CC; mientras que la retardancia inferior a 2 nm parece estar asociada a un menor potencial de desarrollo y tasa de embarazo. Además, los oocitos del grupo CC presentaban una morfología de la ZP más homogénea en comparación con los oocitos del grupo NCC. Estos datos indican que los embriones de buena calidad provienen de ovocitos que muestran una retardancia significativamente mayor en la capa más interna de la zona (Shen et al, 2005). En concreto, los ovocitos que tienen una ZP cuya capa interna cuenta con un grosor aproximado de 10-12 μm exhiben la mejor progresión a blastocisto (Shen et al, 2005; Raju et al, 2007).
CONCLUSIONES
La ZP es una capa fundamental tanto para el gameto femenino como para el embrión preimplantacional hasta el estadio de blastocisto. Variaciones en la estructura de la misma puede influir en la consecución de sus funciones. Así, una correcta ZP implica un correcto desarrollo folicular y una completa maduración del ovocito. La expresión de las proteínas de la zona puede contribuir al establecimiento de gradientes de polaridad y a mejorar la señalización entre los ovocitos y las células somáticas mediante proyecciones transzonales. La acumulación de factores autocrinos y paracrinos en la zona podría potenciar el desarrollo de ovocitos/embriones. Una ZP gruesa y sólida también podría ser una ventaja en el ICSI, ya que protege particularmente bien al ovocito del estrés mecánico durante el procedimiento de microinyección. Todo ello determina dos posibles aplicaciones que tienen gran interés en el campo de la reproducción asistida, convirtiendo a la ZP en una moneda de doble cara.
Por un lado, las propiedades de la ZP humana podrían estimar la calidad del ovocito/embrión de una cohorte dada permitiendo, gracias a la tecnología del PolScope, seleccionar los de mejor calidad aumentando así las probabilidades de éxito del ciclo de forma inmediata y sin efectos adversos sobre los ovocitos ni embriones (no invasivo). Asímismo, cobran gran interés las variaciones que se producen en la ZP en el desarrollo de ovocitos a embriones ya que juega un papel esencial en el desarrollo preimplantacional y su mejor comprensión facilitaría el desarrollo de nuevos procedimientos que aumenten las tasas de implantación en las técnicas de reproducción humana asistida.
Por otro lado, se ha documentado una disminución de AMH durante la inmunocontracepción activa con ZP que puede deberse a una disminución del número de folículos antrales provocada por la interferencia de los anticuerpos anti-ZP en el desarrollo folicular normal convirtiendo a la ZP en un objetivo muy atractivo para la vacunación anticonceptiva. Sin embargo, siguen siendo necesarias nuevas investigaciones centradas en esclarecer las bases moleculares del reconocimiento de gametos que aporten terapias novedosas para mejorar el panorama de infertilidad actual y proporcionen métodos anticonceptivos basados en la inmunización contra la ZP, sin influir en el desarrollo folicular.
Referencias
Adjaye J. Whole-genome approaches for large-scale gene identification and expression analysis in mammalian preimplantation embryos. Reprod Fertil Dev. 2005;17(1-2): 37-45.
Avella MA, Xiong B, Dean J. The molecular basis of gamete recognition in mice and humans. Molecular Human Reproduction. 2013;19:279-89.
Baibakov B, Gauthier L, Talbot P, Rankin TL, Dean J. Sperm binding to the zona pellu-cida is not sufficient to induce acrosome exocytosis. Development 2007; 134:933- 943.
Baibakov B1, Boggs NA, Yauger B, Baibakov G, Dean J. Human sperm bind to the N-terminal domain of ZP2 in humanized zonae pellucidae in transgenic mice. Journal of Cell Biology. 2012;197:897-905.
Balaban B, Urman B, Alatas C, Mercan R, Mumcu A, Isiklar A. A comparison of four different techniques of assisted hatching. Hum Reprod 2002;17:1239–43.
Bechert U, Bartell J, Kutzler M, Menino A, Bildfell R, Anderson M, et al. Effects of two porcine zona pellucida immunocontraceptive vaccines on ovarian activity in horses. J Wildl Manage 2013;77:1386e400.
Bronson, R.A., A. McLaren. Transfer to the mouse oviduct of eggs with and without the zona pellucida. J Reprod Fertil 1970;22: 129–137.
Burkart AD, Xiong B, Baibakov B, Jimenez- Movilla M, Dean J. Ovastacin, a cortical granule protease, cleaves ZP2 in the zona pellucida to prevent polyspermy. Journal of Cell Biology 2012;197:37–44.
Bush, M.R., J.M. Mele, G.M. Couchman, D.K. Walmer. Evidence of juxtacrine signal- ing for transforming growth factor • in human endometrium. Biol Reprod 1998;59: 1522– 1529.
Cohen J. Assisted hatching of human embryos. J In Vitro Fertil Embryo Transfer 1991; 8:179–191.
Das, S.K., X.-N. Wang, B.C. Paria, D. Damm, J.A. Abraham, M. Klagsbrun, G.K. An- drews, S.K. Dey. Heparin-binding EGF-like growth factor gene is induced in the mouse uterus temporally by the blastocyst solely at the site of its apposition: A possible ligand for interaction with blastocyst EGF-receptor in implantation. Development 1994; 20: 1071–1083.
Denker H. Structural Dynamics and Function of Early Embryonic Coats. Cells Tissues Organs 2000;166:180-207.
Dunbar, B. S. Ovarian antigens and infertility. American Journal of Reproductive Im- munology. 1990;21, 28- 31.
Familiari G, Relucenti M, Heyn R, Micara G, Correr. Threedimensional structure of the zona pellucida at ovulation. Microsc Res Tech 2006;69:415–426.
Fleming, T.P. Trophectoderm biogenesis in the preimplantation mouse embryo; in Flem- ing T.P. (ed): Epithelial Organization and Development. London, Chapman & Hall, 1992;pp 111–136.
Gahlay G, Gauthier L, Baibakov B, Epifano O, Dean J. Gamete recognition in mice de- pends on the cleavage status of an egg’s zona pellucida protein. Science 2010;329:216– 219.
Gonzales DS, Bavister BD. Zona pellucida escape by hamster blastocysts in vitro is d delayed and morphologically different compared with zona escape in vivo. Biol Reprod 1995; 52:470–480.
Gupta S. Prospects of zona pellucida glycoproteins as immunogens for contraceptive vaccine. Human Reproduction Update 1997;3:311-324.
Herrler, A., H.M. Beier. Early embryonic coats: Morphology, function, practical ap- plications – An overview. Cells Tissues Organs 2000;166: 233–246.
Herrler, A., F. Stewart, B. Crosset, J.M. Pell,P.D. Ellis, K.D. Brown, W.R. Allen, H.M. Beier. Proteins in the coats of preimplantation rabbit and horse embryos. Zygote 1998a; 6(suppl): 47–48.
Herrler, A., F. Stewart, B. Crosset, J.M. Pell, P.D. Ellis, K.D. Brown, H.M. Beier, W.R. Allen. Embryonic coats – A mailbox in early embryo-maternal signalling (abstract). J Reprod Fertil, Abstr. 1998b;Series 21: 22.
Jewgenow K, Fickel J. Sequential Expression of Zona Pellucida Protein Genes during the Oogenesis of Domestic Cats. Biology of Reproduction 1999;60:522-526.
Johnson, M.H., J.C. Chisholm, T.P. Fleming, E. Houliston. A role for cytoplasmic de-terminants in the development of the early mouse embryo? J Embryol Exp Morphol 1986a;97(suppl):97–121.
Johnson, M.H., B. Maro, M. Takeichi. The role of cell adhesion in the synchronization and orientation of polarization in 8-cell mouse blastomeres. J Embryol Exp Morphol 1986b; 93: 239– 255.
Johnson, M.H., H.P.M. Pratt, A.H. Handyside. The generation and recognition of posi-tional information in the preimplantation mouse embryo; in Glasser S.R., D.W. Bullock (eds): Cellular and Molecular Aspects of Implantation. New York, Plenum Press, 1981;pp 55–74.
Joone CJ, Bertschinger HJ, Gupta SK, Fosgate GT, Arukha AP, Minhas V, Dieterman E, Schulman ML. Ovarian function and pregnancy outcome in pony mares following im- munocontraception with native and recombinant porcine zona pellucida vaccines. Equine Vet J 2017:2; 189-195.
Joone CJ, Schulman ML, Fosgate GT, Claes ANJ, Gupta SK, Botha AE, Human A, Ber- tschinger HJ. Serum anti- Mullerian hormone dynamics in mares following immunocon- traception with anti-zona pellucida or -GnRH vaccines. Theriogenology 2018; 214-220.
Karagouni, E.E., A. Chryssikopoulos, T. Mantzavinos, N. Kanakas, E.N. Dotsika. Inter- leukin-1ß and interleukin-1• may affect the implantation rate of patients undergoing in vitro fertilization-embryo transfer. Fertil Steril 1998;70:553–559.
Lefievre L, Conner SJ, Salpekar A, Olufowobi O, Ashton P, Pavlovic B, Lenton W, Af- nan M, Brewis IA, Monk M et al. Four zona pellucida glycoproteins are expressed in the human. Human Reproduction 2004; 19:1580–1586.
Lin S, Lee R, Tsai Y. In Vivo Hatching Phenomenon of Mouse Blastocysts During Im- plantation. Journal of Assisted Reproduction and Genetics 2001;18:341- 345.
Modlinski, J.A. The role of the zona pellucida in the development of mouse eggs in vivo. J Embryol Exp Morphol 1970;23: 539–547.