LAVADO SEMINAL EN VARONES SEROPOSITIVOS PARA EL VIH. ¿ESTÁ TODO RESUELTO?
Ma Carmen Galbis1, José Remohí1, Antonio Pellicer1,2, Nicolás Garrido1*
1 Instituto Universitario IVI, Valencia
2 Hospital Universitario y Politécnico La Fé
e-mail: nicolas.garrido@ivi.es
Fecha recepción: 10 Octubre 2011
Fecha aceptación: 16 Diciembre 2011
La prevalencia del VIH en pacientes en edad fértil junto con el aumento de la expectativa y calidad de vida derivadas de la introducción de los tratamientos antirretrovirales de gran actividad ha hecho que cada vez más parejas en las que sólo uno de sus miembros es seropositivo (parejas serodiscordantes) se planteen tener hijos. El lavado de semen se presenta como la opción de elección en estas parejas en las que el hombre es positivo al virus y quieren tener hijos biológicos. La técnica consiste en una selección astringente de los espermatozoides móviles y se apoya en la hipótesis de que los espermatozoides no son el principal reservorio del VIH y que éste se encuentra principalmente en el plasma seminal y en las células no espermáticas.
El objetivo del trabajo es analizar la evidencia científica disponible en relación con la eficacia, efectividad y seguridad del lavado de semen en hombres VIH positivos para su uso en técnicas de reproducción humana asistida. Rev Asoc Est Biol Rep 2012; 17(1):28-38
INTRODUCCIÓN
El virus de la inmunodeficiencia humana (VIH) es un retrovirus que se transmite por vía sanguínea, sexual o vertical (de madre a hijo), que afecta sobre todo a los linfocitos T, a los macrófagos y a las células del sistema nervioso central que tienen en común el receptor vírico (la molécula CD4) (Oliva y Pons, 2004).
El SIDA (síndrome de la inmunodeficiencia humana) es la manifestación más grave de una gama de trastornos relacionados con el VIH. Los Centros de Control y Prevención de Enfermedades (Centers for Disease Control and Prevention (CDC)) de los Estados Unidos definieron la enfermedad en el año 1982 y desde entonces se han desarrollado diversas definiciones de SIDA y diversas clasificaciones de la infección basadas en la evidencia de la infección por el VIH y confirmación por el laboratorio. Actualmente, el sistema de clasificación se basa en características clínicas, inmunológicas y de diagnóstico de la infección por el VIH (Oliva y Pons, 2004).
En la actualidad existen más de 33 millones de personas infectadas, 20 millones de muertes y más del 80% de estos casos son por transmisión sexual (Halfon et al., 2010).
El objetivo de esta revisión es analizar la evidencia científica actualmente disponible en relación con la eficacia, efectividad y seguridad del lavado de semen en hombres VIH positivos para su uso en técnicas de reproducción humana asistida.
EL VIRUS DEL VIH Y SU TRANSMISIÓN POR VÍA SEXUAL
Desde hace décadas, el VIH ha sido identificado en forma de virión (ARN) en el plasma seminal y en forma de provirus (ADN) en la fracción celular del eyaculado, conociéndose que los varones seropositivos para el VIH, pueden tener elevados niveles del retrovirus, ya sea en plasma seminal o en células no germinales (Semprini et al., 1992; Marina et al., 1998a).
Además, en relación a la carga viral y su comparación entre plasma sanguíneo y plasma seminal, los estudios sugieren que éstos se comportarían como compartimentos diferentes, por lo que el VIH puede seguir estando presente y con capacidad infectiva en semen aunque haya niveles indetectables en sangre (Ruibal y Larcher, 2009).
Los tratamientos con antirretrovirales reducen los niveles en sangre y plasma, pero aun así se pueden detectar niveles de ARN en el plasma seminal y de células infectadas no espermáticas, debido a que la difusión de los antirretrovirales a los compartimentos genitales es bastante variable ya que puede que no consigan penetrar porque las células germinales se encuentran protegidas mediante la barrera hemato-testicular que evita la entrada de ciertas sustancias, incluyendo numerosos fármacos (Williams et al., 2003).
La mayoría de las infecciones resultan de la exposición genital al semen de varones seropositivos, y el riesgo de infección depende del número de viriones y células infectadas, del número de veces que se entra en contacto con el semen, la presencia de infecciones y lesiones genitales, la capacidad de infección del VIH, la susceptibilidad del hospedador y el tipo de práctica sexual (Marina et al., 1998b).
La transmisión horizontal en parejas estables es relativamente baja, resultando ser mucho más elevada en relaciones esporádicas con diferentes parejas sexuales. Sin embargo el riesgo de transmisión vertical de la madre al feto es mucho más elevado: un varón seropositivo puede infectar a su hijo a través de la madre pero no existe ninguna evidencia de transmisión del VIH de una madre no infectada a un hijo. El riesgo cuando ambos miembros son seropositivos es la reinfección con cepas distintas, que puede empeorar el estado de la enfermedad (Englert et al., 2001; Mencaglia et al., 2005).
En ausencia de precauciones en relaciones sexuales con parejas seropositivas, hombre seropositivo y mujer seronegativa, la transmisión del virus del hombre a la mujer se estima de 1 a 3 actos sexuales por cada 1.000 (Baker et el., 2003; Garrido et al., 2004; Mencaglia et al., 2005).
Existe mucha controversia acerca de la presencia o no de partículas víricas en los espermatozoides móviles, sobre todo fundamentada en datos ya obsoletos, que sembraron la duda acerca del uso de estos espermatozoides con fines reproductivos.
La presencia intracitoplasmática de VIH en varones seropositivos fue sugerida por Baccetti et al., (1990, 1991,1994, 1998), Bagasra y Freund, (1990) y Bagasra et al., (1994) con la identificación de un receptor de VIH, diferente del CD4 de los linfocitos, presente en la membrana de los espermatozoides (Tabla I).
La presencia del VIH en el espermatozoide fue detectada también en el semen de varones seronegativos tras ser cultivado in vitro con el virus (Dussaix et al., 1993), aunque en 1998 el grupo de Kuji et al. no corroboró la presencia intraespermática del virus tras cultivo de espermatozoides in vitro con VIH (Tabla I).
TABLA I.
¿Infecta el VIH-1 al espermatozoide humano? MET: Microscopia electrónica de transmisión; HIS: Hibridación in situ; a Cultivo in vitro de muestras de semen de hombre seronegativo al VIH. Marina et al., 2002.
Se demostró la presencia del virus en espermatogonias, espermatocitos e incluso en espermátidas (Nuovo et al., 1994). Sin embargo, este estudio se realizó en testículos atrofiados de hombres que habían fallecido a causa del VIH, siendo ésta una situación que no puede ser extrapolable a casos de hombres con bajos recuentos virales y recuento espermático normal (Marina et al., 1998a).
Otros autores únicamente han detectado la presencia de VIH en el plasma seminal y/o en células no espermáticas presentes en el semen (linfocitos y macrófagos), pero no en gametos (Quayle et al., 1997). Defienden la ausencia total de partículas virales y ácidos nucleicos en el espermatozoide demostrando que la separación del fluido seminal y de células no espermáticas con la técnica de lavado propuesta por Semprini en 1992, reduce los niveles virales, mediante detección por PCR y nested-PCR (Semprini et al., 1992; Lasheeb et al., 1997; Quayle et al., 1997; Garrido et al., 2006; Garrido et al., 2009) (Tabla I).
Aunque no se ha podido demostrar que el VIH no se adhiere fuertemente al espermatozoide o lo infecte, la experiencia mostrada indica que, con la metodología descrita, el riesgo de transmitir el VIH con espermatozoides lavados es inferior (concretamente y hasta el momento, es un riesgo nulo) al observado en parejas serodiscordantes que efectúan coito no protegido (Marina et al., 2002).
En la actualidad no hay información convincente que señale que el espermatozoide pueda transmitir el retrovirus, pero los casos clínicos llevados a cabo mediante lavado seminal, nested-PCR e ICSI, muestran la efectividad del procedimiento sin que se haya producido ninguna seroconversión en madres ni en recién nacidos, en más de 3.000 ciclos de Inseminación Artificial e ICSI llevados a cabo por diferentes grupos de investigación.
TÉCNICAS DE REPRODUCCIÓN ASISTIDA EN VARONES SEROPOSITIVOS AL VIH
A los varones seropositivos para el VIH con parejas seronegativas, se les plantea la duda de la paternidad aunque sean fértiles y quieran ser padres, debido a que corren el riesgo de transmitir el virus a la mujer a través del semen en la relación sexual sin protección con objeto de engendrar. El método natural de conseguir embarazo, conlleva este riesgo (Marina et al., 1998a; Chrystie et al., 1998; Marina et al., 2002).
Además, otro aspecto importante a resaltar es que no todas estas parejas puede que sean fértiles, y uno de los motivos, puede ser la edad. En la actualidad, todos los varones contagiados por vía parenteral a causa de toxicomanías, tendrían una edad cercana o superior a la cuarentena, y es probable que sus parejas en la actualidad también la tengan (Garrido et al, 2004). La repetición de coitos no protegidos, si es la elección, incrementa el riesgo de transmisión viral y el resultado es que la mujer se contagia del VIH y no queda embarazada (Marina et al., 2002), aunque sigue siendo un tema muy controvertido (Barreiro et al., 2007), y hay autores que defienden que en ciertas circunstancias y con la enfermedad controlada y el paciente infectado exhibiendo ciertas características clínicas, no hay que desestimar los métodos naturales.
En este caso, lo que hay que valorar es si las consecuencias derivadas de estos actos (mantener relaciones sexuales sin protección para lograr la paternidad), pudiéndose evitar mediante las técnicas de reproducción asistida con una seguridad prácticamente total, merecen querer evitar este tipo de tratamientos para lograr la paternidad.
En el comienzo de la epidemia, la presencia de virus en el semen y fluidos vaginales, la posibilidad de transmisión horizontal y vertical, la alta morbimortalidad de los futuros padres e hijos y el riesgo de transmisión al personal médico motivaron la negativa de los especialistas en reproducción asistida a realizar tratamientos de infertilidad en esta población (Ruibal y Larcher, 2009).
La introducción de los tratamientos antirretrovirales de gran actividad, TARGA, ha retrasado e incluso evitado la progresión del SIDA, consiguiendo alargar la supervivencia y la calidad de vida de las personas afectadas por el VIH (Englert et al., 2001; Baker et al., 2003; Oliva y Pons, 2004). Estos avances han hecho modificar el concepto de una enfermedad asociada a un rápido desenlace por el de una enfermedad de desarrollo crónico, con una expectativa de vida parecida a la de otras patologías crónicas; por lo que muchos individuos seropositivos se plantean la posibilidad de tener descendencia (Mencaglia et al., 2005).
La consecuencia inmediata de esta situación es la necesidad de un consejo reproductivo positivo que no plantee, como antes, evitar a ultranza el embarazo en aquellas parejas en las que uno o ambos miembros sean seropositivos.
Hasta hace algunos años, a estas parejas se les recomendaba acogerse a los programas de fertilidad mediante donación de semen, adopción o incluso abandonar la idea de tener niños (Englert et al., 2001). Los avances en el conocimiento de la enfermedad y en el campo de la reproducción asistida, permiten desde hace décadas a las parejas en estas circunstancias formar familias y disminuir los riesgos al máximo (Ruibal y Larcher, 2009).
Las opciones que tienen las parejas serodiscordantes en las que el hombre es VIH positivo y la mujer es VIH negativo para poder tener descendencia están vinculadas al lavado de semen y posterior técnica de reproducción asistida con inseminación artificial o fecundación in vitro (FIV) para reducir el riesgo de transmisión con el uso de sus propios gametos (Baker et al., 2003).
Lo que permiten las técnicas de reproducción asistida es controlar las diferentes etapas del proceso reproductivo para que se disminuya al mínimo la posibilidad de exposición al virus y transmisión de éste entre ambos miembros de la pareja.
LAVADO SEMINAL
El lavado de semen es una técnica que se realiza en algunos centros de reproducción asistida para separar los espermatozoides móviles del resto del semen y así eliminar o reducir al mínimo el riesgo de transmisión a la madre y al bebé. A continuación, estos espermatozoides se utilizan para la inseminación de la mujer mediante inseminación artificial (IA) o fecundación in vitro (FIV). Es necesario disponer, antes de emplear este semen de manera segura, de pruebas moleculares diagnósticas fiables que confirmen la ausencia del virus en la muestra tratada.
Augusto E. Semprini fue el precursor de la técnica de lavado de semen y publicó en el año 1992 los primeros 29 casos de parejas serodiscordantes en las que se había realizado técnicas de reproducción asistida después del tratamiento del semen con lavado seminal, de las cuales 15 mujeres consiguieron llevar a término su embarazo sin ninguna seroconversión. Este procedimiento causó un gran interés y aumentó las esperanzas de muchas parejas que querían tener hijos sin el riesgo de que la mujer se infectara (Semprini et al., 1992; Garrido et al., 2006; Garrido et al., 2009)
Este tipo de tratamientos en la actualidad, gracias a los estudios realizados, son un programa totalmente establecido en diferentes clínicas de reproducción y países, y en el que se han alcanzado cotas de seguridad prácticamente definitivas, con unas probabilidades de éxito en la consecución de una gestación muy elevadas (Marina et al., 1998a).
La base que permitió este desarrollo, se sentó al localizar los reservorios del virus en el plasma seminal y en células no espermáticas, y por ello existe una enorme reducción en el riesgo de transmisión con el uso de espermatozoides lavados y seleccionados antes de inseminarlos en la mujer (Baker et al., 2003).
Los partidarios de esta técnica se apoyan en la hipótesis de que el virus no esté presente en los espermatozoides, pero sí en el plasma seminal y en las células no espermáticas con receptores CD4 (linfocitos T y macrófagos) (Oliva y Pons, 2004).
La gran cantidad de nacimientos libres del VIH reportados hasta la actualidad son la demostración de esta teoría.
PROCEDIMIENTO DE PREPARACIÓN DEL SEMEN
Aunque con diferentes variantes utilizadas en diferentes centros, la técnica de eliminación del VIH consiste en aplicar a la muestra de semen un doble proceso de lavado: el gradiente de densidad y el swim up.
Estas dos técnicas se utilizan habitualmente en reproducción humana para separar y seleccionar los espermatozoides móviles aptos para fecundación. La diferencia con el lavado de semen de pacientes VIH positivos es que se utilizan las dos técnicas de forma conjunta reduciendo así el riesgo de infección de manera considerable si lo comparamos con el de una pareja que intente concebir de manera natural (Oliva y Pons, 2004).
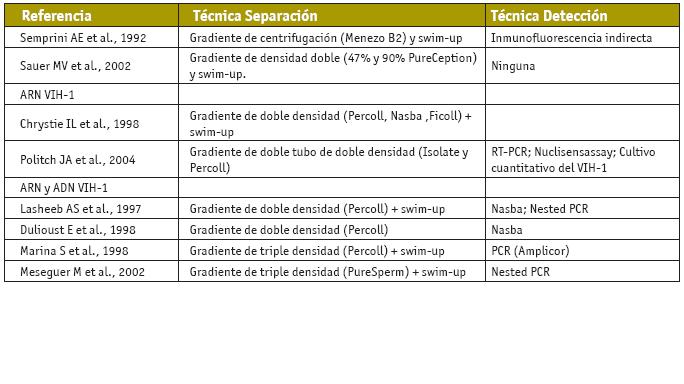
Las principales variaciones observadas entre los estudios son los diferentes porcentajes de gradientes de densidad, el tiempo y la fuerza de centrifugación, y la utilización de diferentes métodos de detección del VIH, aunque el espíritu del concepto parece homogéneo (Tabla II).
Algunos estudios identificados realizan diferentes gradientes discontinuos (Chrystie et al., 1998; Dulioust et al., 1998; Marina et al., 1998a; Meseguer et al., 2002), otros utilizan doble tubo de gradiente (Politch et al., 2004), otros no realizan swim-up (Dulioust et al., 1998) y la mayoría realizan la combinación de ambos métodos, gradientes de densidad y swim-up (Chrystie et al., 1998; Marina et al., 1998a; Meseguer et al., 2002). (Tabla II)
TABLA II.
Técnicas de separación y detección del VIH en las muestras obtenidas por lavado de semen. PCR: polymerase chain reaction; RT-PCR: reverse transcription-polymerase chain reaction; Nasba: Nucleic acid sequence-based amplification. Oliva y Pons, 2004.
Prácticamente, todos los autores aplican la técnica con pequeñas variaciones, siguiendo al modelo propuesto por Semprini en 1992.
Técnicamente, guardando las precauciones necesarias en el laboratorio, los pasos a llevar a cabo incluirían:
• Un primer lavado añadiendo medio de cultivo al semen fresco en proporción 2:1. Se centrifuga y se extrae el sobrenadante. El sedimento se resuspende en medio de cultivo.
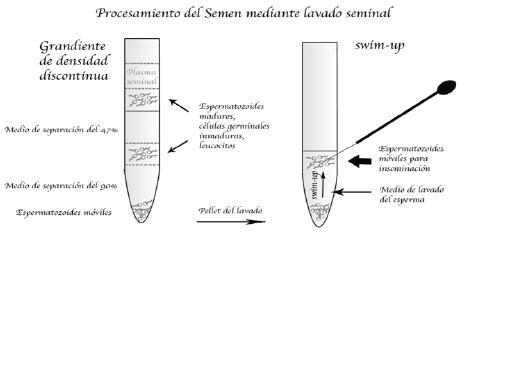
• Centrifugación con gradientes de densidad: la técnica consiste en formar diversas capas de diferentes densidades. Para realizar los gradientes de densidad se utiliza una solución isotónica (Percoll®, PureSperm®, SpermFilter®, Ficoll®) y, en general (en el lavado estándar), se hacen tres capas de concentraciones al 50%, 70%, y 90% para separar las diferentes fracciones celulares del semen. A continuación, se pone la muestra de semen en la parte de arriba del tubo que contiene la preparación de gradientes y se centrifuga. Cada componente del semen empieza a bajar por el gradiente hasta que llega a la zona en que la densidad de la solución es igual a su densidad.
La velocidad a la que sedimenta cada uno de los componentes depende fundamentalmente del tamaño y de su forma. Los componentes más pequeños necesitan más fuerza de centrifugación y más tiempo para llegar a la capa de la misma densidad. Después de la centrifugación los espermatozoides móviles se localizan en la capa de más densidad, es decir, en el fondo del tubo. Para recuperarlos, se pueden ir sacando las capas superiores hasta llegar a la del 90% con la ayuda de diferentes pipetas o bien perforar el fondo del tubo para retirar el pellet por debajo (Figura 1).
• Técnica de swim-up: la técnica se basa en una selección de los espermatozoides móviles. El pellet recuperado con la centrifugación por gradiente de densidad se deposita en un tubo estéril con un medio de preparación del semen (por ejemplo human tubal fluid, o HTF), después se pone inclinado a 45° en la incubadora, con una temperatura de 37°C y una atmósfera de CO2 del 5% durante una hora. Pasado este tiempo se recoge el sobrenadante donde se encontrarán los espermatozoides móviles que habrán nadado desde el pellet. Del sobrenadante se recoge la parte superior y se deja en el tubo la parte en contacto con el pellet (Figura 1).
Figura 1
La muestra obtenida de espermatozoides se divide en varias partes. Una de ellas para valorarla mediante recuento de espermatozoides y movilidad, otra parte para determinar la presencia/ausencia del VIH con técnicas de biología molecular, y el resto para congelarla (si se le va a dar un uso posterior), o para realizar la técnica de reproducción asistida pertinente, siempre tras la confirmación de la ausencia del virus en la muestra lavada.
La utilización del 50% de los espermatozoides móviles recuperados con el lavado seminal para la detección con nested PCR permite extrapolar los resultados obtenidos a la otra fracción de la muestra que se utilizará para RHA, y así tener la seguridad de su uso evitando la transmisión.
Incluso en las últimas publicaciones de nuestro grupo, se ha descrito una modificación al método habitual para muestras con una ínfima cantidad de espermatozoides móviles, e incluso en muestras de biopsia testicular (Semprini et al., 1992; Garrido et al., 2006; Garrido et al., 2009).
DETECCIÓN DE VIH
El VIH pertenece a la familia de los retrovirus y tiene la capacidad de sintetizar la enzima Transcriptasa Reversa y convertir el ARN en ADN para introducirse en el genoma y así en la célula hospedadora. De manera general, los métodos de detección del VIH están basados en la amplificación de secuencias bien definidas de ácidos nucleicos virales.
A lo largo del tiempo se han utilizado diferentes técnicas con el fin de determinar la presencia o ausencia del virus (Tabla II). Los primeros informes de mujeres y recién nacidos no infectados tras la realización del protocolo de lavado seminal e Inseminación Artificial, que fueron publicados en Italia, realizaban la detección del VIH mediante inmunofluorescencia para el antígeno p24 (Semprini et al., 1992).
Existen varios métodos comerciales para la determinación de la carga viral; HIV RNA PCR (Amplicor HIV-1 Monitor, Roche Molecular Systems), branched chain DNA o bDNA (Quantiplex HIV RNA Assay, Chiron), Nucleic acid sequence based amplification o NASBA (Nuclisense, Organon Teknika).
Las técnicas disponibles inicialmente (primera generación) detectaban sólo a partir de 10.000 copias/ml.. Las técnicas más utilizadas (segunda generación) tienen un límite inferior de detección de 200 a 400 copias (Oliva y Pons, 2004). El método de detección NASBA (Nucleic acid sequence-based amplification) es un método comercial (tercera generación) que incorpora una secuencia como sistema de control para demostrar la eficacia de la amplificación para cada muestra evaluada. Presenta una sensibilidad de 50 copias por reacción (Lasheeb et al., 1997). Aunque este método presenta un bajo límite de detección, el hecho de que una muestra procesada sea negativa, todavía no significa que esté libre de carga viral (Chrystie et al., 1998).
El método de detección más empleado es la PCR estándar. Consiste en la amplificación enzimática de secuencias específicas del material genético, y permite la cuantificación del ADN y del ARN del HIV de los espermatozoides móviles obtenidos del semen lavado (carga proviral y viral).
Los procedimientos de PCR estándar, como los empleados para la cuantificación de los niveles virales en sangre, cuando se utilizan para determinar los niveles virales en muestras de plasma seminal puede que no sean suficientes ya que existe un límite en el número de copias que puede detectar. La sensibilidad de la técnica es de 200 copias/ml de ARN y al menos 10 células infectadas. Es posible que unos pocos espermatozoides contengan VIH y no sean detectados, pero es imposible estar seguro al 100% ya que la PCR se aplica a una fracción de la muestra de espermatozoides y será la otra fracción la que se usará para la IA o FIV (Marina et al., 1998a).
El empleo de esta técnica puede dar lugar a la aparición de falsos negativos debido a la presencia de inhibidores de la polimerasa, presentes en el semen, que bloqueen la reacción o a que el número de células o viriones esté por debajo de los niveles de sensibilidad de la técnica (Garrido et al., 2004).
En 2002, Sauer y colaboradores, publicaron un trabajo en el que afirmaban el incremento de seguridad que se conseguía mediante el uso de ICSI en los protocolos de reproducción asistida en parejas serodiscordantes para el VIH. En la metodología de su protocolo, no estaba incluida la detección de partículas víricas del VIH en las muestras de semen tras el lavado, debido a que aseguraban que las técnicas de detección empleadas en los laboratorios presentaban una baja sensibilidad. Por este motivo, afirmaban que aunque se realizara una detección antes de la inseminación artificial, el procedimiento no estaba exento de riesgo ya que un pequeño número de partículas víricas podía haber quedado sin ser detectadas.
Este trabajo ha recibido varias críticas, que aseguraban que aunque las técnicas de detección no eran extremadamente sensibles, la solución no era dejar de realizarlas (Garrido et al., 2002). Aunque se reduzca la posibilidad de transmisión mediante el uso del ICSI, se debe realizar el método más seguro que dispongamos ya que está en juego la salud de las personas. En todos los casos se deben realizar pruebas para la detección del virus en las muestras de semen lavado y nunca deben utilizarse aquellas en las que aparezcan resultados positivos.
En la actualidad, la técnica que ha demostrado tener mayor sensibilidad para determinar la presencia/ausencia de ácidos nucleicos de VIH en espermatozoides lavados es la nested–PCR. Este método permite la detección de una única copia viral de ARN o ADN. Con la aplicación de este método de detección, se ha demostrado que muchas muestras que se consideraban negativas mediante el uso de métodos comerciales de detección, no estaban completamente libres de partículas virales (Garrido et al., 2002; Meseguer et al., 2002).
Sin embargo, no se ha publicado ninguna infección utilizando la PCR estándar a pesar de no ser el método más sensible existente, y este hecho podría estar asociado a que realmente, tan bajos niveles, y tan pocas exposiciones, podrían ser inocuos.
Se debe tener en cuenta que este tipo de procedimientos para ajustarse a las recomendaciones estándar para el tratamiento de muestras infecciosas, precisan además de un laboratorio específico con componentes exclusivos para este tipo de muestras con objeto de evitar la aparición de nuevos casos de contaminación nosocomial durante los tratamientos de reproducción, así como el riesgo ocupacional para el personal sanitario expuesto.
CALIDAD DEL SEMEN EN VARONES SEROPOSITIVOS
La calidad del semen puede estar afectada por la propia infección del VIH (Dondero et al., 1996; Dulioust et al., 2002; Garrido et al., 2005), también por los tratamientos antirretrovirales utilizados (Dulioust et al., 2002; Garrido et al., 2005), y en caso de utilizar técnicas de RHA para prevenir la transmisión horizontal, por el mismo proceso de lavado de semen (Oliva y Pons, 2004; Garrido et al., 2005).
El hecho de realizar el doble lavado para asegurar al máximo la eliminación del virus influye negativamente en la cantidad de espermatozoides disponibles para inseminar o para realizar la FIV. Es necesario que estos pacientes tengan una calidad seminal inicialmente alta ya que después del doble lavado se recupera un porcentaje bajo de los espermatozoides móviles que se encuentran en la muestra eyaculada, que puede rondar el 5% (Oliva y Pons, 2004; Garrido et al., 2005).
Las características seminales de varones seropositivos han sido objeto de muchos estudios a lo largo de los años. Diversos grupos han comparado muestras de semen procedentes de hombres seropositivos para el VIH con muestras de semen de hombres sanos o no infectados con el virus (Dondero et al., 1996; Dulioust et al., 2002; Garrido et al., 2005).
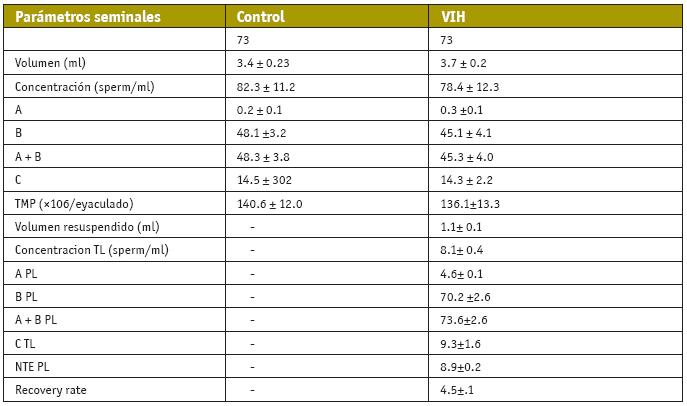
Algunos autores constataron cambios en el patrón de movilidad, volumen de eyaculado y en el número total de espermatozoides (Dondero et al., 1996; Lasheeb et al., 1997; Dulioust et al., 2002). Sin embargo, en un trabajo publicado en 2005 por nuestro grupo (Garrido et al, 2005), no se hallaron diferencias significativas entre los grupos, pudiéndose comparar todos los parámetros entre ellos y demostraron que estas variaciones no eran suficientemente marcadas para alterar gravemente la fertilidad (Tabla III).
TABLA III.
Comparación de características seminales entre un grupo infectado por VIH y un grupo control. Los resultados están expresados como la media ± desviación estándar. A, B, C, D= tipo A, B, C y D de movilidad; NTE =número total de espermatozoides progresivos; PL= tras lavado. Garrido et al., 2005.
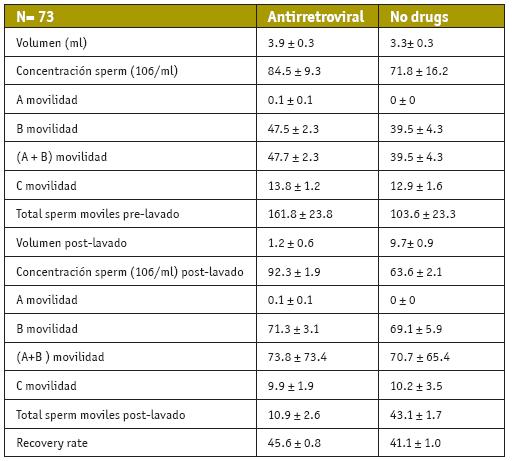
Los tratamientos con antirretrovirales, también han sido objeto de diversos estudios que comparan la calidad espermática, en varones con diferentes tratamientos de antirretrovirales (bi, tri o cuatriterapia) y varones que no hacen uso de ellos, que han demostrado que el uso o no de éstos no influye en la calidad, pudiéndose comparar los diferentes parámetros entre ambos grupos (Dulioust et al., 2002; Garrido et al., 2005) (Tabla IV).
TABLA IV.
Resultados entre pacientes con VIH que reciben o no tratamiento antirretroviral. Los resultados están expresados como la media ± desviación estándar. A, B, C, D= tipo A, B, C y D de movilidad; TM; PL= tras lavado. Garrido et al., 2005.
Cada vez más, existe información acerca de que la calidad del semen no solo puede valorarse con el recuento espermático y la valoración de la movilidad. En este sentido, diversos factores moleculares en el espermatozoide han sido relacionados con la infertilidad masculina (Garrido et al., 2008).
Además, una forma indirecta de valorar la calidad del semen es mediante la evaluación de los embriones de él obtenidos, su calidad y su capacidad de llegar a formar blastocistos óptimos para su posterior implantación y desarrollo. Esta metodología para valorar el semen fue llevada a cabo por Melo et al. (2009) en la que comparaban embriones procedentes de parejas serodiscordantes al VIH con el hombre infectado y embriones procedentes de parejas con infertilidad asociada la mayoría a factor tubárico, mediante la realización de ICSI en ambos grupos. Los principales resultados que obtuvieron fueron que las tasas de fecundación, división y las características embrionarias eran similares entre los 2 grupos, no hallando diferencias en el número medio de embriones óptimos en día 3. Cuando estos embriones se cultivaban hasta día 5 ó 6 se observó un aumento significativo en el bloqueo embrionario del grupo de embriones procedentes de parejas serodiscordantes, sin embargo el número de blastocistos óptimos en día 6 era comparable en ambos grupos. Además, no se encontraron diferencias en cuanto al número de embriones criopreservados y transferidos, la implantación, embarazo, embarazos múltiples o en las tasas de abortos involuntarios entre los grupos. Gracias a todos estos resultados concluyeron que la infección de VIH en parejas serodiscordantes con el hombre infectado no genera un impacto significativamente negativo en el desarrollo del embrión o en el resultado del ICSI (Melo et al., 2009).
PREDICCIÓN DEL RESULTADO DEL LAVADO SEMINAL
En la actualidad no existen suficientes datos que demuestren que determinados parámetros son capaces de pronosticar el éxito o fracaso del lavado seminal, ni de explicar el pequeño % de casos en los que este procedimiento da resultados positivos, obligando a repetir la técnica para conseguir obtener muestras de espermatozoides limpios de virus.
La aparición de resultados positivos puede ser debido a una incorrecta manipulación de la muestra durante el procedimiento de lavado dejando presente en la muestra células no espermáticas susceptibles de infección como son linfocitos y/o macrófagos (Marina et al., 2002).
La única información que en la actualidad se puede dar a los pacientes es la propia experiencia de los diferentes grupos de investigación, y parece ser, acumulando las diferentes evidencias, que la tasa de lavados positivos puede rondar, según grupos, entre el 1-5%. La influencia de las diferentes densidades de gradientes y volúmenes utilizados en el swim-up, tampoco tiene relevancia en los resultados de las pruebas de detección vírica del VIH (Garrido et al 2005).
PARÁMETROS SEMINALES E INFECCIÓN DE VIH
Los niveles de CD4 y el recuento viral en sangre son dos de los parámetros más relevantes en la descripción del estado de la enfermedad. La disminución de los niveles CD4 en sangre está relacionada de manera negativa con el tiempo de evolución de la enfermedad (Oliva y Pons, 2004).
Muchos grupos de investigación hallaron cambios en la concentración espermática en muestras de semen de varones infectados (Dondero et al., 1996; Lasheeb et al., 1997) en los que el volumen total del eyaculado disminuía a medida que aumentaba el tiempo de evolución de la enfermedad, incrementándose así la concentración total de espermatozoides hasta el punto de mantener ese número estable (Dulioust et al., 2002).
En 2005, nuestro grupo (Garrido et al., 2005) no observó cambios en las concentraciones espermáticas de las muestras procedentes de pacientes infectados, y además demostró que, a medida que evolucionaba la enfermedad, la movilidad espermática no se veía afectada.
Bajos recuentos de CD4 en sangre, junto a un tiempo largo de evolución de la enfermedad, son factores relevantes para la muestra, pero son insignificantes para el proceso completo de lavado seminal (Garrido et al., 2005).
EL USO DE INSEMINACIÓN ARTIFICIAL VS. INYECCIÓN INTRACITOPLASMÁTICA
La inseminación artificial ha sido el método a elegir en los tratamientos de reproducción asistida en parejas serodiscordantes desde hace varias décadas, si las pruebas ginecológicas de la mujer lo han permitido, y el recuento de espermatozoides móviles es suficiente (Semprini et al., 1992; Marina et al., 1998b; Garrido et al., 2004).
Sin embargo, existen diversos casos en los que no está indicado el uso de la inseminación artificial, como por ejemplo, mujeres seronegativas con obstrucción de trompas de Falopio, casos de baja calidad seminal o con un bajo número de espermatozoides totales tras el lavado seminal que haga prever un muy bajo número de posibilidades con inseminación, o incluso en fallos repetidos en las inseminaciones artificiales realizadas.
En estos casos estaría recomendado el uso de ICSI o FIV (Marina et al., 1998b; Loutradis et al., 2001).
Aun así, es ampliamente debatida la pertinencia del ICSI incluso en casos no incluidos en los supuestos anteriores, aunque la realización de un ICSI sea económicamente más costosa que una inseminación artificial, tales como razones de seguridad y la relación efectividad-coste que compensan su utilización (Garrido et al., 2004), en lugar de realizar IAs.
Entre las ventajas que se argumentan para el uso de ICSI en lugar de IAs en pacientes serodiscordantes para el VIH como primera opción encontramos:
1. Disminuir el riesgo de infección con el uso de un único espermatozoide por ovocito, frente a los millones que recibe la mujer en un ciclo de inseminación artificial (Marina et al., 1998b; Loutradis et al., 2001; Sauer y Chang, 2002; Ruibal y Larcher, 2009).
2. No se cancelan ciclos si los lavados resultan positivos. Los espermatozoides pueden mantenerse congelados tras el lavado, haciendo posible la repetición de las pruebas de detección las veces que sea necesario hasta la obtención de resultados adecuados, debido a que la muestra se procesa antes de iniciar el ciclo.
3. Las tasas de embarazo son mucho más elevadas en ICSI, incluso tres veces más que con IA, reduciendo así el tiempo necesario para la concepción, con la consiguiente disminución de la ansiedad y estrés de la pareja sometida a este tipo de tratamientos y con ello la exposición viral con ciclos repetidos, sin tener en cuenta la capacidad de fecundación de la pareja a tratar (Mencaglia et al., 2005; Ruibal y Larcher, 2009).
4. Rentabilización de todo el lavado. Los espermatozoides lavados que resulten negativos, pueden ser utilizados en tantos ciclos como sean necesarios, sin la necesidad de realizar nuevos lavados que incrementan el coste de todo el proceso.
5. No se necesita recuperar un número importante de espermatozoides para conseguir índices adecuados de embarazo post-lavado (Ruibal y Larcher, 2009).
Por estos motivos, la Inyección intracitoplasmática (ICSI) es el procedimiento más recomendado y más seguro utilizado hasta el momento, debido a que se disminuyen mucho las posibilidades de transmisión del VIH y se maximizan las tasas de embarazo en parejas serodiscordantes.
La evidente desventaja del ICSI frente a la inseminación en estos casos es, por supuesto, los efectos secundarios asociados a este tipo de procedimientos en las mujeres. Ni siquiera los aspectos económicos son aquí favorables a las inseminaciones: si bien es cierto que el coste del ICSI es muy superior, la razón coste/efectividad, medida como el coste de lograr un niño sano en casa, es muy comparable, atendiendo a que se necesitan aproximadamente 3 ciclos de inseminación para lograr unas tasas de gestación acumuladas semejantes a las de ICSI.
ASPECTOS ÉTICOS Y SOCIALES
El lavado de semen, como técnica añadida a las propias de Reproducción Humana Asistida (RHA), y con la finalidad de reducir al máximo el riesgo de transmisión o contagio horizontal a la pareja genera, como otras tecnologías médicas, dilemas éticos y sociales de distinta forma.
Hechos como que los pacientes infectados con el VIH han pasado a tener un curso crónico de la enfermedad y que buena parte de estos enfermos están en la edad propia de la reproducción, han originado un aumento del afán reproductivo y la necesidad de tecnologías que eviten el contagio (lógicamente, el preservativo, a la vez que ayuda a prevenir el contagio, anula cualquier probabilidad de embarazo) y, por lo tanto, se tiene que recurrir al lavado de semen y a alguna de las diferentes técnicas de RHA (Oliva y Pons, 2004).
Las tecnologías de RHA, en esta situación de parejas serodiscordantes que quieren tener un hijo biológico, responden a la necesidad de prevenir el contagio y no tanto a problemas de infertilidad.
Las razones esgrimidas para negar las técnicas de reproducción asistida a estas parejas son en síntesis dos: riesgo de que el niño quede huérfano y de contagiar a la mujer y, por ende, al hijo. Pero el periodo de supervivencia, es decir, el tiempo entre la aparición de síntomas de SIDA y la muerte, se ha alargado debido al mejor control de las infecciones oportunistas y a la mayor eficacia de la terapia antirretroviral.
Actualmente no se puede afirmar que toda persona infectada de VIH morirá de SIDA. Y el contagio de hombre infectado a mujer seronegativa se puede reducir mediante técnicas de lavados de semen y reproducción asistida (Englert et al., 2001).
En el año 2001 aparece un editorial titulado “VIH e infertilidad: tiempo de tratar” (Gilling-Smith et al.) en el cual se esgrimen argumentos que dan lugar al debate y a la concienciación del problema. En dicho editorial se sostiene que no existe justificación para negar tratamiento a padres que son VIH positivos: el uso juicioso de la terapia antirretroviral en el embarazo y parto, el nacimiento por cesárea y el evitar la lactancia son medidas probadas que disminuyen el riesgo de transmisión vertical a menos del 2%.
El riesgo de malformaciones congénitas de un recién nacido de madre VIH negativa es de un 2.5% y éste se incrementa 4 veces si la madre es diabética insulinodependiente y 10 veces si tiene una malformación congénita significativa.
Desde la mirada actual de la enfermedad como un padecimiento crónico en el cual la expectativa de vida desde el momento del diagnóstico, en pacientes que reciben tratamiento, supera los 20 años, se pone de relieve la necesidad de buscar opciones reproductivas para estos pacientes. El potencial de las personas VIH positivas de tener hijos no afectados y de no transmitir la enfermedad a sus parejas ha mejorado sustancialmente, aunque el éxito no está garantizado.
Los autores concluyen que las parejas en que uno o ambos miembros estén infectados deberían tener acceso a los mismos consejos y tratamientos que pacientes no infectados para permitirles concebir con un riesgo mínimo de contagio.
No se debe olvidar que pueden discutirse otras alternativas con las parejas como la adopción, no tener hijos o la donación de semen (Ethics Committee of the American Society for Reproductive Medicine, 2002; Ruibal y Larcher, 2009).
Respecto del VIH y el personal de salud, si se toman las medidas estándar universales para prevenir la transmisión de enfermedades infecciosas, el riesgo para la transmisión de VIH al personal es muy pequeño, y no es en sí mismo razón suficiente para negar servicios reproductivos a los infectados y sus parejas (Chrystie et al., 1998; Ethics Committee of the American Society for Reproductive Medicine, 2002; Ruibal y Larcher, 2009).
CONCLUSIONES
En la actualidad, podemos afirmar que el semen es un vehículo de transmisión de la infección por el VIH, aunque su presencia dentro del espermatozoide o en las células germinales es un tema muy controvertido que todavía está por resolver. El lavado seminal, nested-PCR e ICSI, son los procedimientos más adecuados para reducir el riesgo de transmisión del VIH en parejas serodiscordantes con el hombre infectado, que quieren tener hijos, independientemente de su fertilidad y por ello la mayoría de los autores revisados indican la necesidad de utilizar sólo para RHA las muestras con resultado de la PCR negativo (tanto del ADN como del ARN).
Aunque no podemos demostrar que el VIH no se adhiera fuertemente al espermatozoide o lo infecte, la experiencia mostrada comienza a indicar que, con la metodología descrita, el riesgo de transmitir el VIH a través de espermatozoides lavados es inferior (cero por el momento) al observado en parejas serodiscordantes que efectúan coito no protegido. Además, los resultados de esta revisión muestran que la técnica del lavado de semen en hombres seropositivos al VIH para su uso en técnicas de reproducción asistida no ha producido ninguna seroconversión horizontal (a la mujer) ni vertical (al hijo) al virus.
Por tanto, a la pregunta formulada en el título de esta revisión, la respuesta es: para los varones infectados con VIH, que pretenden tener hijos, desde el punto de vista reproductivo, está todo resuelto: se conoce la vía de transmisión, se dispone de técnicas seguras para evitarla, la calidad del semen no resulta perjudicada por la infección, y el uso de sus espermatozoides en técnicas de reproducción asistida presenta una altísima probabilidad de éxito con riesgos despreciables.
Referencias
Baccetti B, Benedetto A, Burrini AG. Spermatozoa of patients with AIDS contain HIV particles. In: Melica F, editor. AIDS and human reproduction. New York: Karger, 1990:47–54.
Baccetti, B., Benedetto, A., Burrini, A.G et al. HIV particles detected in spermatozoa of patients with AIDS. J. Submicr. Cytol. Pathol 1991; 23, 339–345.
Baccetti B, Benedetto A, Burrini AG et al. HIV-particles in spermatozoa of patients with AIDS and their transfer into the oocyte. J Cell Biol 1994; 127; 903–914.
Baccetti B, Benedetto A, Collodel G, et al. The debate on the presence of HIV-1 in human gametes. J Reprod Immunol. 1998; 41(1-2):41-67.
Bagasra O, Freund M. In vivo and in vitro studies of HIV-1 and human sperm. In: Alexander NJ, Gebelnick HL, Spieler JM. Heterosexual Transmission of AIDS. New York: Wiley-Liss, 1990; 155-66.
Bagasra O, Farzadegan H, Seshamma T, et al. Detection of HIV-1 proviral DNA in sperm from HIV-1 infected men. AIDS 1994; 8:1669-74.
Baker H, Mijch A, Garland S, et al. Use of assisted reproductive technology to reduce the risk of transmission of HIV in discordant couples wishing to have their own children where the male partner is seropositive with an undetectable viral load. Journal of Medical Ethics 2003; 29:315–320.
Barreiro P, Castilla JA, Labarga P, Soriano V. Is natural conception a valid option for HIV-serodiscordant couples? Hum Reprod. 2007 Sep;22(9):2353-8. Epub 2007 Jul 19
Chrystie IL, Mullen JE, Braude PR, et al. Assisted conception in HIV discordant couples: evaluation of semen processing techniques in reducing HIV viral load. Journal of Reproductive Immunology 1998; 41,301–306.
Dondero F, Rossi T, D’Offizi G, et al. Semen analysis in HIV seropositive men and in subjects at high risk for HIV infection. Hum Reprod 1996; 11,765–768.
Dulioust E, Tachet A, De Almeida M, et al. Detection of HIV-1 in seminal plasma and seminal cells of HIV-1 seropositive men. Journal of Reproductive Immunology. 1998; 41, 27–40.
Dulioust E, Du AL, Costagliola D, et al. Semen alterations in HIV-1 infected men. Hum Reprod 2002; 17, 2112–2118.
Dussaix E, Guetard D, Dauguet C, et al. Spermatozoa as potential carriers of HIV. Res Virol 1993; 144,187–195.
Englert Y, Van Vooren JP, Place I, et al. ART in HIV-infected couples. Hum Reprod 2001; 16, 1309–1315.
Ethics Committee of the American Society for Reproductive Medicine. Human immunodeficiency virus and infertility treatment. Fertil Steril 2002; 77,218–222.
Garrido N, Meseguer M, Bellver J. In vitro fertilization with intracytoplasmic sperm injection for human immunodeficiency virus-1serodiscortant couples. Am J Obstet Gynecol 2002; 187, 4
Garrido N, Meseguer M, Bellver J, et al. Report of the results of a 2 year programme of sperm wash and ICSI treatment for human immunodeficiency virus and hepatitis C virus serodiscordant couples. Hum Reprod 2004; 19, 2581–2586.
Garrido N, Meseguer M, Remohí J, et al. Semen characteristics in human immunodeficiency virus (HIV) and hepatitis C (HCV) seropositive males: predictors of the success of viral removal after sperm washing. Hum Reprod 2005; 20, 1028–1034.
Garrido N, Remohí J, Pellicer A, et al. The effectiveness of modified sperm washes in severely oligoasthenozoospermic men infected with human immunodeficiency and hepatitis C viruses. Fertil Steril. 2006 ;86(5), 1544-6. .
Garrido N, Remohí J, Martínez-Conejero JA, García-Herrero S, Pellicer A, Meseguer M. Contribution of sperm molecular features to embryo quality and assisted reproduction success. Reprod Biomed Online. 2008 Dec;17(6):855-65.
Garrido N, Gil-Salom M, Martínez-Jabaloyas JM et al., First report of the absence of viral load in testicular sperm samples obtained from men with hepatitis C and HIV after washing and their subsequent use. Fertil Steril, 2009: 92(3), 1012-5.
Gilling-Smith C, Smith JR, Semprini, AE. HIV and infertility: time to treat. BMJ 2001; 322:566-567
Halfon P, Giorgetti C, Khiri H, et al. Semen May Harbor HIV Despite Effective HAART: Another Piece in the Puzzle. PLoS ONE 2010; 5(5): e10569.
Kuji N, Tanaka H, Takahashi J, et al. Elimination efficiency of HIV from semen by Percoll continuous density gradient-swim-up. Hum Reprod 1998; 13 (Abstract book): 131.
Lasheeb AS, King J, Ball JK, et al. Semen characteristics in HIV-1 positive men and the effect of semen washing. Genitourin Med 1997; 73, 303–305.
Loutradis D, Drakakis P, Kallianidis K, et al. Birth of two infants who were seronegative for human immunodeficiency virus type 1 (HIV-1) after intracytoplasmatic injection of sperm from HIV-1 seropositive men. Fertil Steril 2001; 75,210–212.
Marina S, Marina F, Alcolea R, et al. Human immunodeficiency virus type 1-serodiscordant couples can bear healthy children after undergoing intrauterine insemination. Fertil Steril 1998a; 70, 35–39.
Marina S, Marina F, Alcolea R, et al. Pregnancy following intracytoplasmic sperm injection from an HIV-1-seropositive man. Hum Reprod 1998b; 13, 3247–3249.
Marina S, Marina F, Expósito R, et al. HIV y reproducción asistida. Reproducción Asistida en parejas serodiscordantes (hombre seropositivo) al VIH-1: experiencia de 118 niños nacidos sanos. Ginecología y Obstetricia Clínica 2002; 3 (3):146-150
Mencaglia L, Falcone P, Lentini G.M, et al. ICSI for treatment of human immunodeficiency virus and hepatitis C virus-serodiscordant couples with infected male partner. Hum Reprod 2005; 20, (8): 2242–2246, 2005
Melo MA, Meseguer M, Bellver J, et al. Human immunodeficiency type-1 virus (HIV-1) infection in serodiscordant couples (SDCs) does not have an impact on embryo quality or intracytoplasmic sperm injection (ICSI) outcome. Fertility and Sterility, 2009; 89, (1)
Meseguer M, Garrido N, Gimeno C, et al. Comparison of polymerase chain reaction-dependent methods for determining the presence of human immunodeficiency virus and hepatitis C virus in washed sperm. Fertil Steril 2002; 78, 1199–1202.
Nuovo GJ, Becker J, Simsir A, et al. HIV-1 nucleic acids localize to the spermatogonia and their progeny. A study by polymerase chain reaction in situ hybridization. Am J Pathol 1994; 144:1142-8.
Oliva G, Pons JMV. Lavado de semen en parejas VIH serodiscordantes para su uso en técnicas de reproducción humana asistida. Barcelona: Agència d’Avaluació de Tecnologia i Recerca Mèdiques. CatSalut. Departament de Salut. Generalitat de Cataluña. Septiembre de 2004.
Politch JA, Xu C, Tucker L, et al. Separation of human immunodeficiency virus type 1 from motile sperm by the double tube gradient method versus other methods. Fertil Steril. 2004; 81(2):440-7.
Quayle AJ, Xu C, Mayer KH, Anderson DJ. T lymphocytes and macrophages, but not motile spermatozoa, are a significant source of human immunodeficiency virus in semen. J Infect Dis 1997; 176:960–8.
Quayle AJ, Xu Ch, Tucker L, et al. The case against an association between HIV-1 and sperm: molecular evidence. J Reprod Immunol 1998; 41: 127-36.
Ruibal M, Larcher JS .Riesgo de transmisión del HIV en parejas serodiscordantes en tratamiento de fertilidad. Reproducción 2009; 24: 115-127
Sauer MV, Chang PL. Establishing a clinical program for human immunodeficiency virus 1- seropositive men to father seronegative children by means of in vitro fertilization with intracytoplasmic sperm injection. Am J Obstet Gynecol 2002; 186: 627- 33.
Semprini AE, Levi-Setti P, Bozzo M, et al. Insemination of HIV-negative women with processed semen of HIV-positive partners. Lancet 1992; 340, 1317–1319.
Williams CD, Finnerty JJ, MD, et al. Reproduction in couples who are affected by human immunodeficiency virus: Medical, ethical and legal considerations. Am J Obstet Gynecol 2003; 189(2):333-341.