¿PODEMOS USAR EL COLAPSO DEL BLASTOCISTO COMO MARCADOR DE LA TASA DE IMPLANTACIÓN?
Alicia Navarro, Susana Royo, Lorenzo Abad, Carla Olmedo, Miguel Barea, Irene Cuevas.
Hospital General, Unidad de Medicina Reproductiva, Valencia, España.
E-mail primer autor : ali.nasan0820 @gmail.com
RESUMEN
Las técnicas de reproducción asistida ofrecen una solución a los problemas de infertilidad en la población. El método habitual para evaluar la calidad embrionaria con la finalidad de seleccionar el mejor embrión es la visualización de sus parámetros por morfología clásica. Mediante tecnología time-lapse se ha podido llevar a cabo un estudio sobre la influencia de los colapsos embrionarios, cuyo objetivo es averiguar si éstos podrían considerarse un parámetro más en la valoración embrionaria. Dichos colapsos surgen de manera habitual y azarosa en los blastocistos y parece ser que están relacionados negativamente con la tasa de implantación. Además, se ha confirmado que contribuyen a un desarrollo levemente retardado en el embrión lo que podría estar relacionado con en el fallo de implantación. Finalmente, a pesar de que este parámetro no está incluido en los criterios ASEBIR de clasificación embrionaria, el estudio apoya que podría considerarse como criterio relevante durante la selección del embrión para incrementar el éxito en las tasas de implantación y recién nacido vivo.
Palabras clave: Blastocisto, selección, colapso, tecnología time-lapse.
ABSTRACT
Assisted reproduction techniques offer a solution to infertility problems in the population. The usual method to evaluate mbryo quality in order to select the best embryo is the visualization of its morphological parameters. Through time-lapse technology, it has been possible to carry out a study about the influence of embryo collapses, whose objective is to find out if it could be considered as another parameter in embryo assessment. Such collapses arise normal and randomly in the blastocysts and appear to be negatively related to implantation. In addition, it has been confirmed that they contribute to a slightly delayed development in the embryo, which could be related to implantation failure. Finally, although this parameter is not included in ASEBIR criteria for embryo classification, the study supports that it could be considered as a relevant criterion during embryo selection to increase success in implantation rates and live new-born.
Keywords: Blastocyst, selection, collapse, time-lapse technology.
- INTRODUCCIÓN
La salud reproductiva es esencial para las personas, las parejas y las familias, así como para el desarrollo social y económico de las comunidades y naciones. En este campo, destacan dos conceptos: la esterilidad, la cual produce la incapacidad de lograr un embarazo clínico tras 12 meses de relaciones sexuales no protegidas y, por otro lado, la infertilidad, cuyo resultado es la incapacidad de lograr un embarazo a término (Zegers-Hochschild et al., 2010). La infertilidad afecta aproximadamente al 15% de las parejas en edad reproductiva y va aumentando debido a que cada vez se pospone más la edad para la maternidad, entre otras causas. Gracias a la reproducción asistida se recogen una serie de procedimientos y técnicas que permiten afrontar los problemas de infertilidad de las parejas.
En 2017, nacieron en España casi 35.700 niños gracias a las técnicas de reproducción asistida (TRA), los cuales representaron aproximadamente el 9,07% del total de individuos nacidos en España en dicho año (Registro Nacional de Actividad 2017 – Registro SEF).
Para asegurar el éxito de las TRA en humanos es importante hacer una selección adecuada de embriones de buena calidad para obtener altas tasas de implantación y de recién nacido vivo (RNV). Actualmente, la tendencia es la transferencia de un único embrión (Single Embryo Transfer, SET) en estadio de blastocisto para prevenir embarazos múltiples y sus riesgos asociados (Ergin et al., 2014).
Generalmente, el método utilizado para evaluar la calidad de los embriones y predecir el potencial de desarrollo es la valoración morfológica basada en los consensos de la Asociación para el Estudio de la Biología de la Reproducción (ASEBIR) o de la Sociedad Europea de Reproducción Humana y Embriología (ESHRE-ALPHA, 2011).
La valoración embrionaria por microscopía se ha limitado a una breve evaluación, generalmente una vez al día, debido a los efectos nocivos para el embrión provocados por la exposición a la temperatura ambiente y a las variaciones de pH fuera del incubador, entre otros, método que conlleva a una pérdida de información debido a la falta de visualización de eventos durante su desarrollo (Goodman et al., 2016).
Sin embargo, la introducción de la tecnología time-lapse a los incubadores de cultivo, ha permitido monitorizar de manera constante el desarrollo de los embriones. Ésta consiste en la toma de fotografías en periodos cortos de tiempo y en diferentes planos focales, las cuales permiten generar una película del embrión durante todo su desarrollo sin necesidad de extraerlo del incubador y manteniendo así unas condiciones de cultivo estables. Su uso, ha permitido evaluar el desarrollo dinámico de los embriones (velocidad y tipo de división celular, simetría, mutinucleación o colapsos entre otros) y además nos permite obtener sus datos morfocinéticos ofreciendo más información a la hora de la selección embrionaria.
La evaluación del embrión en estadio de blastocisto, se basa en una combinación del grado de expansión, la calidad del TE y la del MCI clasificándolos así en categorías A, B C y D, de mejor a peor calidad respectivamente (Cuevas et al., 2018).
Respecto al grado de expansión, es un parámetro que está relacionado con una adecuada maduración trofoblástica y una buena tasa de implantación (Shoukir et al., 1998). La expansión del blastocele depende de las bombas Na+/K+-ATPasa, las cuales adoptan una polarización hacia el interior del blastocele, formando un gradiente de iones sodio que se compensa por el paso de agua mediante las acuoporinas de las células del trofoblasto. Esto se considera un factor favorable para la implantación puesto que algunos autores consideran que la expansión del blastocele provoca un adelgazamiento de la zona pelúcida (ZP) alcanzando un grosor mínimo que facilita la eclosión para la posterior implantación (Racowsky et al., 2003).
Asociado a esto, se estudia si los colapsos de blastocistos, descritos como contracciones causadas por un reflujo de fluído blastocélico en la unión de células sueltas del TE (Marcos et al., 2015), podrían ser incluidos como una herramienta para la selección embrionaria.
Algunos grupos han demostrado que los colapsos débiles ayudan a la eclosión posterior del embrión puesto que ayudan a romper la ZP, sin embargo, los colapsos fuertes podrían afectar a la capacidad de implantación (Esbert et al., 2015).
Los estudios en blastocistos de ratón también han demostrado que el colapso está asociado con dicha bomba Na+ / K+ -ATPasa, lo que implica un gasto de energía adicional cuando el colapso es mayor. Esto sugiere que los colapsos fuertes repetidos en los blastocistos humanos, podrían conducir a una falta de energía y el posterior bloqueo del embrión, ya que, además, el tiempo de reexpansión es mayor que en los colapsos débiles (Niimura, 2003).
- MATERIAL Y MÉTODOS
Este estudio retrospectivo ha sido realizado en la Unidad de Medicina Reproductiva del Hospital General de Valencia. Se analizaron embriones transferidos en fresco (TE), en estado de blastocisto, desde enero del 2015 hasta diciembre del 2018. Del estudio se excluyeron las pacientes con transferencia doble que tenían una implantación parcial, ya que no era posible conocer cuál de los dos embriones había conseguido implantar, por lo que, finalmente, se obtuvo un total de 94 pacientes y 112 embriones. Todos ellos cultivados en incubador dotado de tecnología time-lapse donde se buscaba específicamente la presencia de colapsos en los blastocistos.
Los complejos obtenidos en la punción folicular fueron aspirados de forma manual con pipetas Pasteur estériles. Se colocaron en placa con medio tamponado (Multipurpose® Irvine Scientific) a 37ºC para lavarlos y así eliminar restos de sangre y líquido folicular. Una vez revisados todos los tubos obtenidos y lavados todos los complejos, se colocaron en placa de 5 pocillos (Vitrolife®) que contiene medio de cultivo Fertilization media® (Cook Medical) pre-gaseado y cubierto de aceite mineral (Irvine Scientific) hasta su inseminación.
La elección de la técnica de inseminación, FIV convencional (FIVc) o ICSI, se eligió en función de la indicación de los pacientes. Para el procesamiento de la muestra seminal, se realizaron gradientes de densidad para FIVc y swim-up para la ICSI. La FIVc se realizó utilizando una dilución de la muestra con medio Fertilization Media® a 37ºC y gaseado con CO2 ajustada a una concentración de 1 mill/ml y una coincubación corta (2-3h) de ovocitos y espermatozoides, unas 4 horas tras la captación. Para la ICSI, la decumulación de los ovocitos se realizó 2 horas tras la captación y la ICSI 4 horas tras la captación. Consideramos t0 el tiempo en el que se inseminan los ovocitos por FIVc y la mitad del proceso de microinyección para ICSI. Todos los ovocitos fueron cultivados en microgotas de 20 µl de medio cultivo único (CSCC©, Irvine Scientific) cubiertas con aceite mineral (Irvine Scientific) en el incubador MIRI-TL (ESCO-Medical ©) dotado de tecnología time – lapse.
Los embriones incluídos en el estudio fueron transferidos en día 5 o 6 de cultivo embrionario y la selección de los mismos se realizó basada en los criterios ASEBIR y complementada por parámetros morfocinéticos.
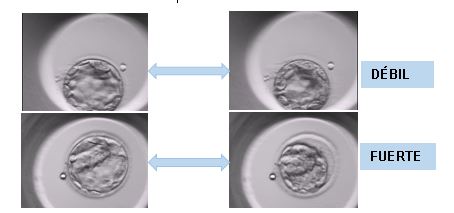
Los colapsos observados en los blastocistos estudiados se clasificaron en dos tipos: el primero se trataba de un colapso débil en el cual las células del TE se separaban <50% de la ZP, y el segundo lo denominamos colapso fuerte ya que la separación del TE de la ZP era >50%, e incluso a veces el blastocele llegaba a desaparecer por completo (Figura 1). Otros blastocistos, sin embargo, no realizaban ningún tipo de colapso durante su desarrollo. En base a esto, se clasificaron los embriones en varios grupos basados en: presencia (SI) o ausencia (NO) de colapso, en tipos de colapsos: fuertes (FUERTE), débiles (DÉBIL) y la combinación de ambos (MIXTOS), y por último dependiendo del número con rango de 0 a 4. Se recopilaron, además, los datos morfocinéticos de cada embrión, observando así el tiempo de división entre células (t2, t3, t4, t5, t6, t7 y t8), la duración de los ciclos celulares (cc2 y cc3) y la sincronía entre divisiones (s2 y s3).
En paralelo, se recopilaron los datos del estatus implantatorio de cada uno de los embriones: si dichos embriones llegaban a implantar o no y la evolución de la gestación.
Para completar la recopilación de datos, se incluyó de cada paciente información acerca de la edad, el tipo de técnica utilizada (FIV o ICSI) y el sexo del bebé.
Finalmente, se realizó un análisis estadístico que fue llevado a cabo mediante el programa SPSS (V22.0, IBM Statistics), Realizando la prueba t-student o chi-cuadrado en función del tipo de variable a analizar.
- RESULTADOS
Del total de blastocistos analizados en el estudio (n=112), un 55’4% presentaron algún tipo de colapso.
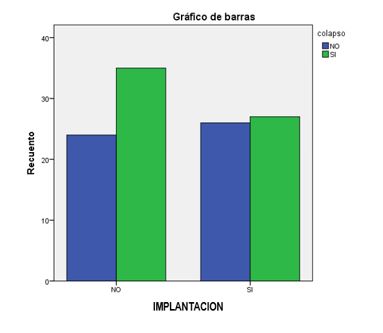
Cuando se relacionó la presencia o no de colapsos con la implantación, no se obtuvieron diferencias estadísticamente significativas, aunque la cantidad de embriones que mostraban colapso era ligeramente mayor cuando no había implantación (Figura 2).
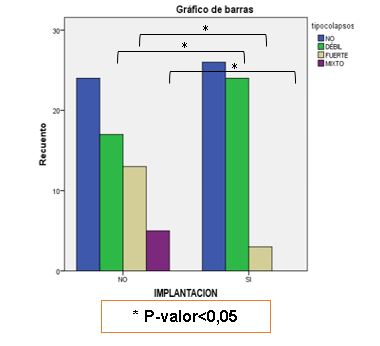
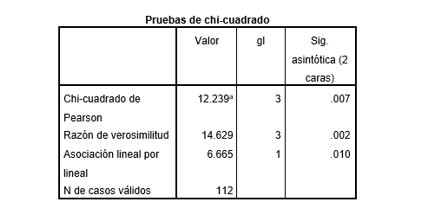
Se encontraron diferencias estadísticamente significativas (p-valor<0,05) cuando se comparó la presencia de implantación con el tipo de colapso (fuerte/débil) (Tabla I) (Figura 3).
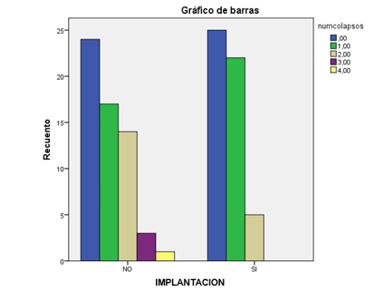
En cuanto al número de colapsos, no se encontraron diferencias estadísticamente significativas. No obstante, se encontraba cerca de la significatividad, ya que se puede observar que, a mayor número de colapsos, menor era la tasa de implantación (Figura 4).
Respecto a los datos morfocinéticos, el tiempo de división celular de los embriones que no presentaban colapsos era mayor que en los que sí presentaban, la duración de los ciclos celulares también era mayor y la sincronía menor. Sin embargo, no se encontraron diferencias significativas entre ambos, excepto en algunas divisiones (t4, t6 y t8) y en s3.
En cuanto al tipo de colapso, se observa que los que tenían colapsos fuertes presentaban un tiempo de división celular más corto durante su desarrollo, una menor sincronía entre divisiones y una duración de los ciclos celulares inferior, lo contrario a lo que ocurre cuando se producen colapsos débiles. Aunque solamente se encontró significatividad en la sincronía (s2 y s3) y la duración del segundo ciclo celular (cc2).
Finalmente, no se encontraron diferencias estadísticamente significativas según la técnica de inseminación empleada, ni entre los colapsos y su influencia en el sexo del recién nacido o la edad de las pacientes.
- DISCUSIÓN
Los colapsos embrionarios son un fenómeno frecuente en embriones de la especie humana y todavía están poco estudiados, sobre todo, la manera en la que influyen en el desarrollo del embrión. Según sugieren nuestros resultados, la presencia o ausencia de colapsos en el blastocisto no resulta significativa, pero sí observamos que cuando no se produce la implantación, hay un mayor porcentaje de embriones que presentan colapsos. Esto podría ser debido al gasto de energía que realiza el embrión al reexpandirse después de un colapso. Este hecho concuerda con el estudio de Frank et al. (2019), en el que al inhibir la bomba Na+/K+-ATPasa en blastocistos de ratones previamente vitrificados, la tasa de reexpansión en la desvitrificación fuera más baja.
Respecto al tipo de colapso, nuestros resultados coinciden con el de algunos estudios como el que realizó Shimoda et al. (2016). Sus resultados mostraban que los colapsos fuertes eran mucho más comunes en los embriones que no habían eclosionado que en los que lo habían hecho. Aunque, a veces los colapsos débiles podrían ayudar al embrión a salir de su ZP, los colapsos fuertes, sin embargo, provocan lo contrario, un gasto de energía que dificulta la eclosión y, por consecuente, también la implantación.
En cuanto a la cantidad de colapsos realizados, vemos que nuestros resultados se acercan a la significatividad, pero no la alcanzan probablemente debido al tamaño muestral. En la gráfica de barras (Figura 2) se observa que cuando no se produce implantación el número de colapsos es más alto. En el estudio de Bodri et al. (2016), se comparó la tasa de recién nacido vivo con el número de colapsos, viendo que era significativamente más baja cuando aumentaba el número de colapsos. Sin embargo, en nuestro estudio, en ausencia de colapsos la mitad de embriones se implantaba y la otra mitad no. Esto sugiere que la presencia de algún colapso débil podría ser beneficioso para la eclosión del blasto, por lo que a veces la ausencia de estos colapsos también podría ser perjudicial.
En cuanto a los datos morfocinéticos, en los colapsos fuertes el tiempo de división celular era más corto, había una menor sincronía entre blastómeras hermanas y la duración de los ciclos celulares es inferior, lo contrario a lo que ocurre cuando se producen colapsos débiles. Sólo fueron significativos la sincronía y la duración del segundo ciclo celular. Probablemente, los colapsos fuertes no sólo son peores para implantar por su mayor gasto energético, sino también debido a la peor calidad del embrión respecto a su desarrollo cinético.
Existe cierta discrepancia respecto a la representación de estos datos puesto que, aunque un tiempo de división largo se ve favorecido respecto a uno corto para que el material genético pueda replicarse completamente antes de iniciar la citocinesis, un tiempo demasiado largo también puede ser indicativo de fenómenos de reparación en el embrión y potencialmente perjudicial. Según un estudio de Huang et al. (2016), los embriones aneuploides o con otras anomalías cromosómicas se han visto asociados con un desarrollo celular más prolongado y asincrónico. También se esperaría un tiempo de expansión del blastocisto relativamente más lento, lo que dificultaría la eclosión de la ZP, así pues, según este estudio la calidad embrionaria estaría relacionada con la expansión del blastocisto tras un colapso.
Factores como la edad materna, la técnica utilizada para inseminar los ovocitos o el sexo de los embriones, no parecen influir en los colapsos embrionarios, lo que nos lleva a pensar en factores intrínsecos del embrión como causantes de los mismos.
Según los resultados obtenidos en nuestro estudio, la valoración de los colapsos en los blastocistos, puede resultar una herramienta útil en la selección del embrión a transferir. Seguiremos ampliando el tamaño muestral de nuestro estudio para confirmar estos datos preliminares e intentar predecir un punto de corte en cuanto a número de colapsos.
- AGRADECIMIENTOS
Este estudio ha sido posible gracias al apoyo y colaboración de la embrióloga Irene Cuevas. Gracias por la atención y la ayuda que me has proporcionado.
Agradecer, también, a mis compañeras de laboratorio por los ánimos y la confianza puesta en mí durante el proceso.
Sobre todo, gracias a mi familia y pareja por escuchar y atender mis progresos y, principalmente, recordarme diariamente que no hay nada imposible si realmente quieres conseguirlo.
Y finalmente, gracias a la Biología por ser mi constante meta e ilusión cada día.
Figura 1. Imágenes de dos blastos, antes (izq.) y durante (dcha.) el colapso.
Figura 2. Tasa de implantación frente al número de embriones con presencia y ausencia de colapsos.
Figura 3. Tasa de implantación frente al número de embriones con colapsos fuertes, débiles o mixtos.
* Resultados significativos.
Figura 4. Tasa de implantación frente al número de embriones con 0, 1, 2, 3 o 4 colapsos
Tabla I. Relación entre tipo de colapsos (fuerte, debil y mixtos) y tasa de implantación.
P-valor significativo.
Referencias
Bodri D, Sugimoto T, Yao Serna J, Kawachiya S, Kato R, Matsumoto T. Blastocyst collapse is not an independent predictor of reduced live birth: a time-lapse study. Fertil Steril 2016 ; 105: 1476-1483.e3.
Cuevas I, Pons M, Vargas M, Delgado A, Rives N, Moragas M, Carrasco B, Teruel J, Busquets A, Hurtado M. The Embryology Interest Group: updating ASEBIR's morphological scoring system for early embryos, morulae and blastocysts. Medicina Reproductiva y Embriología Clínica 2018 ; 5: 42-54.
Ergin E, Çalişkan E, Yalçinkaya E, Öztel Z, Çökelez K, Özay A, et al. Frequency of embryo multinucleation detected by time-lapse system and its impact on pregnancy outcome. Fertil Steril 2014 ; 102: 1029-1033.e1.
Esbert M, Marconetto A, Soares S, Quera M, Molina J, Florensa M, et al. Does the blastocyst collapse respond to a biological need? The analysis of 1,952 embryos by time-lapse can give an answer. Fertil Steril 2017 ; 108: e157.
Frank L, Rose R, Anastasi M, Tan T, Barry M, Thompson J, et al. Artificial blastocyst collapse prior to vitrification significantly improves Na+/K+-ATPase-dependent post-warming blastocoel re-expansion kinetics without inducing endoplasmic reticulum stress gene expression in the mouse. Reprod Fertil Dev 2019 ; 31: 294.
Goodman L, Goldberg J, Falcone T, Austin C, Desai N. Does the addition of time-lapse morphokinetics in the selection of embryos for transfer improve pregnancy rates? A randomized controlled trial. Fertil Steril 2016 ; 105: 275-285.e10.
Huang T, Chinn K, Kosasa T, Ahn H, Kessel B. Morphokinetics of human blastocyst expansion in vitro. Reprod Biomed Online 2016 ; 33: 659-667.
Marcos J, Pérez-Albalá S, Mifsud A, Molla M, Landeras J, Meseguer M. Collapse of blastocysts is strongly related to lower implantation success: a time-lapse study. Hum Reprod 2015 ; 30: 2501-2508.
Niimura S. Time-Lapse Videomicrographic Analyses of Contractions in Mouse Blastocysts. J Reprod Develop 2003 ; 49: 413-423.
Qi S, Liang L, Xian Y, Liu J, Wang W. Arrested human embryos are more likely to have abnormal chromosomes than developing embryos from women of advanced maternal age. J Ovarian Res 2014 ; 7: 65.
Racowsky C, Combelles C, Nureddin A, Pan Y, Finn A, Miles L, et al. Day 3 and day 5 morphological predictors of embryo viability. Reprod Biomed Online 2003 ; 6: 323-331.
Registro Nacional de Actividad 2017-Registro SEF: Informe estadístico de Técnicas de Reproducción Asistida 2017 [Internet]. Registrosef.com2017 --[fecha de acceso: 28 Sep 2019] Disponible en: https://www.registrosef.com/public/docs/sef2017_IAFIVm.pdf
Shimoda Y, Kumagai J, Anzai M, Kabashima K, Togashi K, Miura Y, Shirasawa H, Sato W, Kumazawa Y, Terada Y. Time-lapse monitoring reveals that vitrification increases the frequency of contraction during the pre-hatching stage in mouse embryos. J Reprod Develop 2016 ; 62: 187-193.
Zegers-Hochschild F, Adamson GD, de Mouzon J, Ishihara O, Mansour R, Nygren K, et al. Glosario de terminología en técnicas de reproducción asistida (TRA): versión revisada y preparada por el International Committee for Monitoring Assisted Reproductive Technology (ICMART) y la Organización Mundial de la Salud (OMS). Organ Mund la Salud [Internet]. 2010 [fecha acceso 25 Marzo 2019]; 11: 11. Disponible en: http://www.who.int/reproductivehealth/publications/infertility/art_terminology_es.pdf