RELACIÓN ENTRE LOS PATRONES PRONUCLEARES Y LA CALIDAD EMBRIONARIA SEGÚN CRITERIOS ASEBIR
Marta Brossa, Xènia Blanch, Marta Antich
FertiLAB – Institut Català de Fertilitat · Alta Gironella 58, Bajos. 08017 Barcelona.
email:laboratorifertilab@hotmail.com · Fecha recepción: 23 abril 2010 · Fecha aceptación: 26 abril 2010
Resumen: La observación del patrón pronuclear en estadio de zigoto se ha propuesto en varios estudios como una de las características predictivas del desarrollo embrionario y la capacidad implantatoria. En este estudio hemos observado de forma retrospectiva 3424 embriones procedentes de 619 ciclos de FIV-ICSI realizados en nuestro centro entre 2008 y 2009, para establecer si existía alguna relación entre el patrón pronuclear observado el día de la fecundación, a partir de cuatro grupos de clasificación (patrones GI, GII, GIII y GIV) y la calidad embrionaria observada en estadio celular (día 2, día 3) según los criterios propuestos por ASEBIR. Hemos comprobado con significancia estadística que, en nuestro estudio, la distribución de calidades en función del patrón pronuclear no se da de forma aleatoria, apreciándose diferencias sobre todo en el desarrollo de los embriones procedentes de zigotos GI (mayor porcentaje de embriones con desarrollo de calidad A: 35,6% vs. el 31,1% general) y en embriones procedentes de zigotos GIII (mayor probabilidad de desarrollo de embriones de calidad D: 47,1% vs. 38,0% general) para día 3. Dado que la clasificación del patrón pronuclear se realiza simultáneamente a la valoración de la fecundación y con ello, el aumento del estrés al que se somete el embrión en dicha valoración no es significativo, consideramos que merece la pena seguir contando con este dato como uno más de los elementos a tener en cuenta a la hora de decidir cuál o cuáles son los mejores embriones para transferir. Rev Asoc Est Biol Rep 2010; 15(1):25-28.
Palabras clave: patrón pronuclear, calidad embrionaria, criterios ASEBIR.
RELATION BETWEEN PRONUCLEAR PATTERN AND EMBRYO QUALITY IN ACCORDANCE TO ASEBIR CRITERIA
Abstract: The observation of pronuclear pattern of zygote stage has been proposed in several studies as one of the predictive characteristics of embryo development and implantation capacity. In this study, we have observed retrospectively 3424 embryos from 619 IVF-ICSI cycles performed in our centre between 2008 and 2009, to establish whether there was any relationship between pronuclear pattern observed on the day of fertilization, from four groups of classification (pattern GI, GII, GIII and GIV) and embryo quality observed in cell stage (day 2, day 3) according to the criteria proposed by ASEBIR. We checked with statistical significance that, in our study, the distribution of qualities based on pronuclear pattern does not occur randomly, appreciating differences particularly in the development of embryos from zygotes GI (greater percentage of embryos with development of quality A: 35.6% vs. 31.1% overall) and in embryos from zygotes GIII (greater chance of developing embryos of quality D: 47.1% vs. 38.0% overall) for day 3. Since pronuclear pattern classification is performed simultaneously to the assessment of fertilization and thus the increase of stress to the embryo in that evaluation is not significant, we believe that it is worth to continue taking this as one more of all the elements to take into account when deciding what are the best embryos to transfer. Rev Asoc Est Biol Rep 2010; 15(1):25-28.
Key words: nuclear pattern, embryo quality, ASEBIR criteria.
INTRODUCCIÓN
La valoración del desarrollo de un ciclo de fecundación in vitro empieza ya el día de la punción ovocitaria, con la determinación de la calidad de los gametos para predecir el devenir del ciclo y aumentar las probabilidades de éxito. Cada vez se desarrollan nuevos elementos para permitirnos conseguir embriones de mejor calidad y, en consecuencia, con mayor potencial implantatorio. La valoración exhaustiva de dicho potencial en los embriones obtenidos de FIV – ICSI es un tema al que dedicamos mucha atención en los laboratorios, observándolos en todos sus estadios, desde el día de la punción hasta el momento de la transferencia. En la bibliografía podemos encontrar varias características a observar, tanto en gametos como en zigotos y embriones (Senn et al., 2006; Balaban et al., 2001; Wittemer et al., 2000; Tesarik and Greco, 1999; Tesarik et al., 2000; Scott et al., 2000; Gámiz et al., 2003), que se correlacionan con la obtención de embriones de mejor calidad. Toda observación realizada es interesante pero a la vez conlleva un mayor estrés para el embrión, dado que cada determinación se acompaña de un mayor tiempo de observación y, por tanto, generalmente, de exposición fuera de los incubadores. Cada centro debería determinar qué características le permiten una mayor y mejor valoración de la calidad embrionaria en relación a sus resultados, puesto que no todos coinciden en hallar las mismas correlaciones (James et al., 2006).
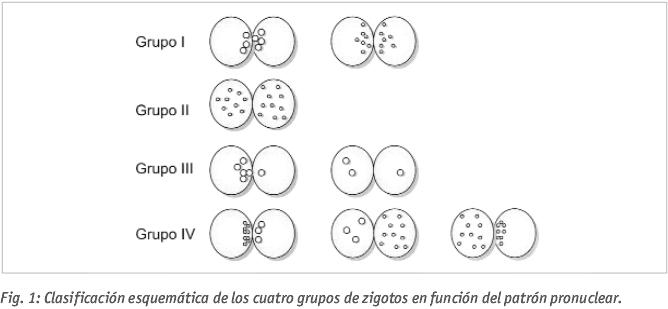
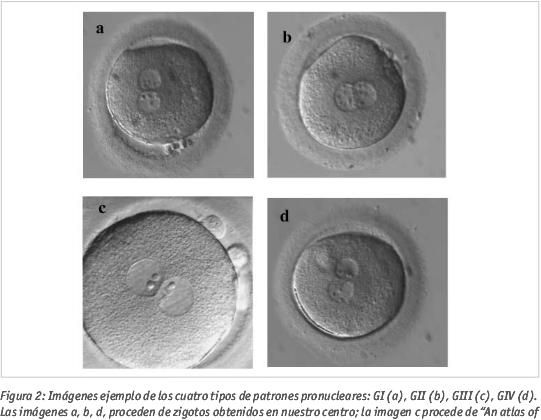
En nuestro laboratorio realizamos un cultivo individualizado de los embriones, observando el patrón de pronúcleos (PN) que presentan en día 1 (Gámiz et al., 2005) (ver Figuras 1 y 2) y su evolución y calidad (según criterios ASEBIR) hasta el día de la transferencia (día 2 o día 3). Dado que, como ya se ha dicho, la determinación del patrón de pronúcleos conlleva un mayor tiempo de observación y, por tanto, de exposición de los zigotos fuera de los incubadores y, teniendo en cuenta que en otros laboratorios se observa la fecundación sin determinar el patrón pronuclear, obteniendo también muy buenos resultados, decidimos estudiar si, en nuestro centro, hallábamos una relación entre el patrón pronuclear y la calidad embrionaria, para decidir si merecía la pena seguir con la valoración de dichos patrones.
MATERIALES Y MÉTODOS
Se ha realizado un estudio retrospectivo, comparando la relación entre los patrones pronucleares y la calidad embrionaria de 3424 zigotos obtenidos en 619 ciclos de FIV-ICSI, tanto propios como de recepción ovocitaria (edad media 32,0 años –edad mínima 19; edad máxima 47–, tomando la edad de la persona a quien se realiza la punción, es decir, la donante en los ciclos de recepción y la paciente en los ciclos propios) realizados en nuestro centro durante los años 2008 – 2009.
Se han excluido del estudio aquellos zigotos en los que, a pesar de observarse la presencia de 2PN, estos aparecían tenues y no quedaba bien definido qué patrón pronuclear les correspondía.
Del total de embriones, 1335 fueron observados hasta día 2 y 2089 hasta día 3.
Los patrones pronucleares de referencia se muestran en la Figura 1, agrupándose en cuatro grupos (GI, GII, GIII, GIV) y la clasificación de calidades sigue la propuesta por ASEBIR (calidades A, B, C y D).
Los ovocitos maduros fueron microinyectados o inseminados. Tras la microinyección, se pasaron a gotas de 20 microlitros de G1 plus v.5 en placas Falcon embriotestadas 60 x 15, para su cultivo individualizado. Los ovocitos inseminados se pasaron a microgotas de G1 a las 3 – 5 horas post-inseminación.
Se valoraron los pronúcleos en microscopio invertido (Nikon Eclipse TE200) a las 18h post ICSI o post inseminación. Seguidamente, los zigotos fueron cambiados a placas de G1 nuevas, manteniendo su posición de cultivo. Se observó su desarrollo hasta día 2 o día 3, anotando las características de cada embrión (número de células, grado de simetría entre ellas, porcentaje de fragmentos, presencia de multinucleación) para poder clasificarlos según la calidad ASEBIR correspondiente (A, B, C o D).
Para estudiar si se hallaba relación entre la observación de un patrón pronuclear determinado y la calidad ASEBIR, se construyeron tablas de contingencia tanto para día 2 como para día 3, y se aplicó un test chi-cuadrado (mediante el paquete estadístico SPSS v. 17.0).
RESULTADOS
La frecuencia general de patrones pronucleares observados en nuestro laboratorio es la siguiente: 28,2% GI; 42,1% GII; 6,0% GIII; 23,8% GIV.
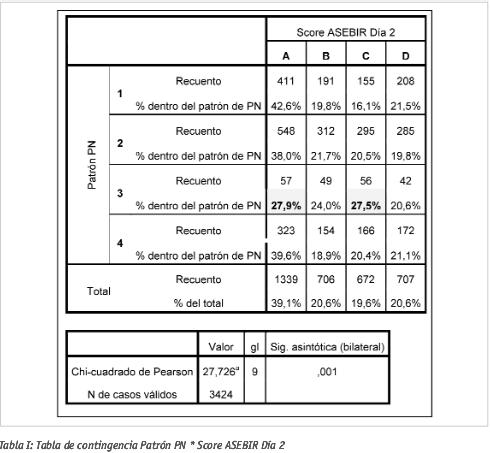
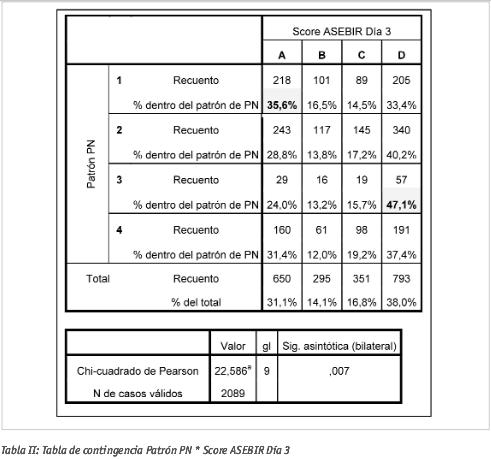
En embriones cultivados hasta día 2, la distribución general de frecuencias de calidades observadas fue la siguiente: 39,1% calidad A; 20,6% calidad B; 19,6% calidad C; 20,6% calidad D. Para día 3, la distribución general observada fue: 31,1% calidad A; 14,1% calidad B; 16,8% calidad C; 38,0% calidad D.
Si no hubiera correlación entre el patrón pronuclear observado en día 1 y la calidad embrionaria durante el cultivo (día 2, día 3), sería de esperar una distribución similar de las frecuencias anteriores cuando se analizara la calidad embrionaria a partir de cada grupo de patrones por separado. Para comprobar si la relación existía se estudiaron las tablas de contingencia para patrón pronuclear vs calidad ASEBIR, las cuales mostraron significación estadística en ambos casos (ver Tablas I y II). Así pues, en nuestro caso, hallamos una relación entre la calidad embrionaria obtenida y el patrón pronuclear.
Del estudio más detallado de las tablas se observa, en los embriones procedentes de zigotos GIII, una tendencia al aumento de la calidad C (27,5% vs. el 19,6% general) en detrimento de la calidad A (27,9% vs. el 39,1% general) para día 2.
Por otro lado, para día 3, se observa mayor proporción de embriones de calidad A (35,6% vs. el 31,1% general), así como de buena calidad (A+B) (52,1% vs. 45,2%), derivados del patrón pronuclear GI, en contraste con el aumento de calidades D derivadas del patrón GIII (47,1% vs. 38,0% general).
De los cuatro grupos de patrones pronucleares, éstos dos son los que muestran una mayor desviación respecto a los valores generales.
DISCUSIÓN
La observación del patrón pronuclear en estadio de zigoto se ha propuesto en varios estudios previos como una de las características predictivas del desarrollo embrionario y de la capacidad implantatoria (Senn et al., 2006; Balaban et al., 2001; Wittemer et al., 2000, Tesarik and Greco, 1999; Tesarik et al., 2000; Scott et al., 2000; Gámiz et al., 2003), a pesar de que no siempre se haya hallado dicha relación (James et al., 2006).
En nuestro centro, los grupos de patrones pronucleares utilizados para clasificar los zigotos nos permiten predecir de manera significativa una distribución distinta de la calidad del embrión celular (día 2, día 3), especialmente en los que derivan de patrones GI (mayor tasa de desarrollo de embriones de calidad óptima) y GIII (mayor probabilidad de desarrollo embrionario de calidad D).
Dado que la valoración del patrón pronuclear en nuestro laboratorio se realiza simultáneamente a la valoración de la fecundación (observación del número de PN y de CP a las 18h postinseminación o ICSI), y por ello no supone un aumento significativo del tiempo de exposición del embrión fuera del incubador, y, ya que nos permite establecer un pronóstico del desarrollo, sobre todo en el caso de los grupos GI y GIII, consideramos interesante seguir manteniendo este criterio de valoración como otro de los utilizados en la elección de los mejores embriones para transferir.
A pesar de todo, y a diferencia de otros estudios publicados, no se ha valorado la capacidad implantatoria de los embriones derivados de cada grupo de patrones pronucleares, por tratarse de un estudio retrospectivo en el que, a la hora de transferir, no se utilizó el patrón pronuclear como criterio de selección. Un estudio más detallado y dirigido a la predicción de la capacidad implantatoria de un embrión a partir del patrón pronuclear observado sería necesario en nuestro caso.
Otra conclusión que se desprende de la observación de los resultados en el análisis realizado, es que en día 2 se observa mayor porcentaje de embriones de buena calidad (A+B) que en día 3. Esto se debe sobre todo a que, en los casos de transferencias en día 2, los mejores embriones se seleccionan ya sea para transferir, ya sea para su criopreservación, pero no siguen el cultivo hasta día 3. De todos modos, hay otro grupo nada menospreciable de embriones que, siendo de calidad óptima en día 2, no dividen o lo hacen en un grado muy bajo (sólo una división) entre día 2 y día 3, pasando a calidad D. Es posible que esto sea consecuencia de una mala activación del genoma embrionario, que empieza a manifestarse en este momento del desarrollo (en las primeras divisiones el embrión depende del material genético del ovocito). Por esta razón, nuestra elección inicial sería la de transferencia en día 3, pues nos permite seleccionar mejor los embriones.
AGRADECIMIENTOS
A todas las compañeras que han colaborado en este estudio y que, con gran esfuerzo, recopilan los datos necesarios para desarrollar proyectos como éste.
A Lluís Bassas, por su ayuda desinteresada en el tratamiento estadístico de los datos.
Referencias
ASEBIR – Asociación para el estudio de la biología de la reproducción. II Cuaderno de Embriología Clínica “Criterios de Valoración Morfológicos de Oocitos, Embriones tempranos y Blastocistos Humanos”. 2ª edición, 2008.
Balaban B; Urman B; Isiklar A; Alatas C; Aksoy S; Mercan R et al. The effect of pronuclear morphology on embryo quality parameters and blastocyst transfer outcome. Hum Reprod 2001; 16: 2357 - 2361
Gámiz P; Romero JL; Zulategui JF; Gadea B; Albert C; de los Santos MJ. Valoración de la fecundación. En: Remohí J., Cobo A., Romero JL., Pellicer A., Simón C. Manual práctico de esterilidad y reproducción humana. 2º edición. McGraw-Hill Interamericana; 2005. p. 392 – 402.
Gámiz P; Rubio C; de los Santos MJ; Mercader A; Simón C; Remohí J et al. The effect of pronuclear morphology on early development and chromosomal abnormalities in cleavage-stage embryos. Hum Reprod 2003; 18: 2413 - 2419.
James, AN; Hennessy S; Reggio B; Wiemer K; Larsen F and Cohen J. The limited importance of pronuclear scoring of human zygotes. Hum Reprod 2006; 21: 1599 - 1604.
Scott L; Alvero R; Leondires M and Miller B. The morphology of human pronuclear embryos is positively related to blastocyst development and implantation. Hum Reprod 2000; 15: 2394 - 2403.
Senn A; Urner F; Chanson A; Primi M-P; Wirthner D and Germond M. Morphological scoring of human pronuclear zygotes for prediction of pregnancy outcome. Hum Reprod 2006; 21: 234 - 239.
Tesarik J and Greco E. The probability of abnormal preimplantation development can be predicted by a single static observation on pronuclear stage morphology.Hum Reprod 1999; 14: 1318 - 1323.
Tesarik J; Junca AM; Hazout A; Aubriot FX; Nathan C; Cohen-Bacrie P et al. Embryos with high implantation potential after intracytoplasmic sperm injection can be recognized by a simple, non-invasive examination of pronuclear morphology. Hum Reprod 2000; 15: 1396 - 1399.
Veeck LL; Zaninovic N. Overview of human preimplantation development in vitro. En: Lucinda L. Veeck, Nikica Zaninovic. An atlas of human blastocysts. The Partenon Publishing group. p. 37.
Wittemer C; Bettahar-Lebugle K; Ohl J; Rongières C; Nisand I and Gerlinger P. Zygote evaluation: an efficient tool for embryo selection. Hum Reprod 2000; 15: 2591 - 2597