TRANSFERENCIA NUCLEAR, ÚLTIMA TECNOLOGÍA PARA PREVENIR LAS ENFERMEDADES MITOCONDRIALES
Autores: Aina Solé Garrigós, Núria Oliveras Cañellas, Luis Carmona Saborido, Adelaida Santana Martin, Vicente Guillén González, Javier Domingo del Pozo.
IVI Las Palmas. Avda. Juan Carlos I, 17, Edificio Corona, 35010 Las Palmas de Gran Canaria, Las Palmas.
Aina Solé Garrigós Email: aina.sole91@gmail.com
Las enfermedades mitocondriales se producen por la alteración en una o más proteínas localizadas en las mitocondrias e involucradas en el metabolismo celular. Estas enfermedades pueden estar causadas por mutaciones en el ADN mitocondrial (ADNmt) o por mutaciones en genes nucleares que codifican para proteínas implicadas en el correcto funcionamiento de la mitocondria.
Dada la gran complejidad y variedad de presentaciones clínicas no existe un tratamiento terapéutico definitivo. Por esta razón, se han propuesto técnicas de transferencia nuclear, con la idea de prevenir la transmisión del ADNmt mutado. Estas técnicas también se denominan de reemplazo mitocondrial y actualmente existen distintas metodologías: transferencia de vesícula germinal, de huso meiótico, pronuclear y de corpúsculo polar. Estás técnicas las veremos en detalle en esta revisión al igual que los resultados actuales en estudios clínicos en humanos.
INTRODUCCIÓN
Las enfermedades mitocondriales son causadas por mutaciones en el ADN mitocondrial (ADNmt) o en genes nucleares involucrados en funciones mitocondriales.
En un individuo sano, todas las copias del genoma mitocondrial de todas las células del individuo son idénticas, esto es lo que se denomina homoplasmia (Brown et al., 2006).
En un individuo enfermo, nos podemos encontrar con dos situaciones. Por una parte, todas las copias del genoma mitocondrial estén mutadas y hablaríamos de mutación homoplásmica. En el caso de una paciente con mutación homoplásmica, ésta transmitirá a toda su descendencia la enfermedad (Brown et al., 2006). Por otra parte, que exista una mezcla en su genoma de ADNmt mutado y ADNmt wild type (WT) y se denominará mutación heteroplásmica (Craven et al., 2010; Amato et al., 2014). En este caso la paciente pasará una mezcla de mitocondrias sanas y enfermas a la descendencia y dependiendo de la proporción de sanas y enfermas, el recién nacido estará afecto o no de la enfermedad o parcialmente afecto (Palacios-González and Medina- Arellano, 2017).
Las manifestaciones clínicas de las enfermedades mitocondriales tienen como diana principal órganos y tejidos con alto requerimiento energético (Tachibana et al., 2013). El grado de afectación depende de la mutación específica que ocurra (Kang et al., 2016) y del porcentaje de heteroplasmia presente. Por lo tanto, la patogenia es proporcional a la ratio ADNmt mutado/WT (Hyslop et al., 2016) y sólo se observará enfermedad clínica en aquellos pacientes donde la carga de ADN mitocondrial mutada sea superior al 60% en los tejidos afectos (Craven et al., 2010).
Hasta la fecha, no existe tratamiento definitivo para estas enfermedades. Ante la falta de tratamientos y las limitaciones del diagnóstico prenatal y preimplantacional, se ha propuesto la transferencia nuclear como técnica para prevenir la transmisión del ADNmt mutado. De manera genérica, a estas técnicas se les denomina de reemplazo mitocondrial (MRT) (Poulton et al., 2009; Hellebrekers et al., 2012; Richardson et al., 2015; Craven et al., 2017).
Las MRT consisten en reemplazar el ADNmt mutado por ADNmt sano procedente de un ovocito o cigoto donado con el fin de obtener descendencia sana para esta patología. Esta técnica permite a una mujer afecta de enfermedad mitocondrial causada por ADNmt mutado tener descendencia sana sin perder la información genética nuclear (Rulli, 2016; Yabuuchi et al., 2012).
El objetivo de esta revisión es observar las diferentes técnicas de realización del trasplante nuclear aplicado a técnicas de FIV en el contexto de enfermedades genéticas, así como beneficios, limitaciones técnicas, últimos progresos y casos clínicos presentados en la literatura científica.
TÉCNICAS DE REEMPLAZO MITOCONDRIAL
En un primer momento, se pensó que la transferencia citoplasmática de un donante sano a un ovocito con ADNmt mutado podría subsanar una enfermedad mitocondrial. Se observó que lo único que se consigue es crear un ovocito heteroplásmico con ambos haplotipos mitocondriales (Amato et al., 2014) diluyendo levemente el efecto del ADNmt mutado (Brown et al., 2006). Esta técnica se utilizó en técnicas de reproducción asistida a finales de la década de los 90 y fundamentalmente en EE. UU (Cohen et al., 1997; Cohen et al., 1998). Esta técnica dio lugar a más de 30 recién nacidos vivos. Sin embargo, después de que se descubriera que tres niños nacidos tenían trastornos del desarrollo (dos casos de síndrome de Turner y un caso de trastorno autista ligado al cromosoma X), la agencia para la administración de alimentos y medicamentos (FDA) de EEUU prohibió el uso de esta técnica hasta que un ensayo clínico pudiera demostrar su seguridad (Barritt et al., 2001; Brenner et al., 2000).
Nuevas técnicas de reemplazo mitocondrial han sido desarrolladas. Ejemplos de estas técnicas son la transferencia de vesícula germinal, de huso meiótico en estadio de maduración ovocitaria MII, transferencia pronuclear o de corpúsculo polar.
Tabla I. Estudios publicados de transferencia de VG en ovocitos humanos
h=humano, r=ratón, C= citoplasma,
CP= corpúsculo polar, VG = vesícula germinal
SD= sin datos
N=normal
TRANSFERENCIA DE VESÍCULA GERMINAL
La transferencia de vesícula germinal consiste en transferir el ADN de un ovocito inmaduro de una paciente con el ADNmt mutado a un ovocito sano enucleado, ambos en el estadio de vesícula germinal (Brown et al., 2006).
El procedimiento de esta técnica consiste en introducir la pipeta de enucleación a través de la zona pelúcida y se extrae el núcleo visible de la vesícula germinal junto con una pequeña porción de citoplasma, denominado karyoplast del ovocito de la paciente. A continuación, el karyoplast se inserta en un ovocito enucleado de una donante. Las membranas del ovocito donante y el karyoplast se unifican por electrofusión y se cultivan in vitro para que maduren y posteriormente proceder a la fecundación (Zhang et al., 1999).
Según los estudios publicados hasta la fecha, los ovocitos humanos resultados de esta fusión son capaces de completar la maduración meiótica de forma normal e incluso fecundarse normalmente después del ICSI (Takeuchi et al., 2001; Zhang et al., 1999). Además, el estudio de Takeuchi et al., 2001, indica que el trasplante de vesícula germinal en sí mismo no aumenta la incidencia de aneuploidías.
Todos los estudios cultivaron los ovocitos en estadío de vesícula germinal en un medio con citocalasina B, antes de la micromanipulación. La exposición a citocalasina B fue beneficiosa para realizar la enucleación, aunque se desconoce su efecto citotóxico en el futuro desarrollo embrionario (Tesarik et al., 2003).
Hallazgos adicionales en ovocitos quiméricos a los que se transfirieron recíprocamente vesículas germinales entre ovocitos humanos y de ratón, sugirieron que, ambos podrían compartir moléculas citoplasmáticas similares, las cuales, controlan la maduración meiótica, la extrusión de corpúsculo polar, el ensamblaje del huso meiótico, el alineamiento y la segregación cromosómica (Zhang and Liu, 2015).
TRANSFERENCIA DE HUSO MEIÓTICO EN ESTADIO MII
Una técnica alternativa es la transferencia del huso meiótico, donde el ADNmt puede ser reemplazado eficientemente con esta técnica sin influir en la fecundación ni en el desarrollo embrionario posterior (Tachibana et al., 2009). La transferencia de huso meiótico consiste en transferir el material genético nuclear (huso meiótico y los cromosomas) de un ovocito MII con mutación en el ADNmt a otro ovocito MII previamente enucleado sano que será inseminado a continuación (Amato et al., 2014).
En los ovocitos maduros MII, las mitocondrias se distribuyen uniformemente por todo el citoplasma y el huso meiótico y los cromosomas no tienen mitocondrias en su interior.
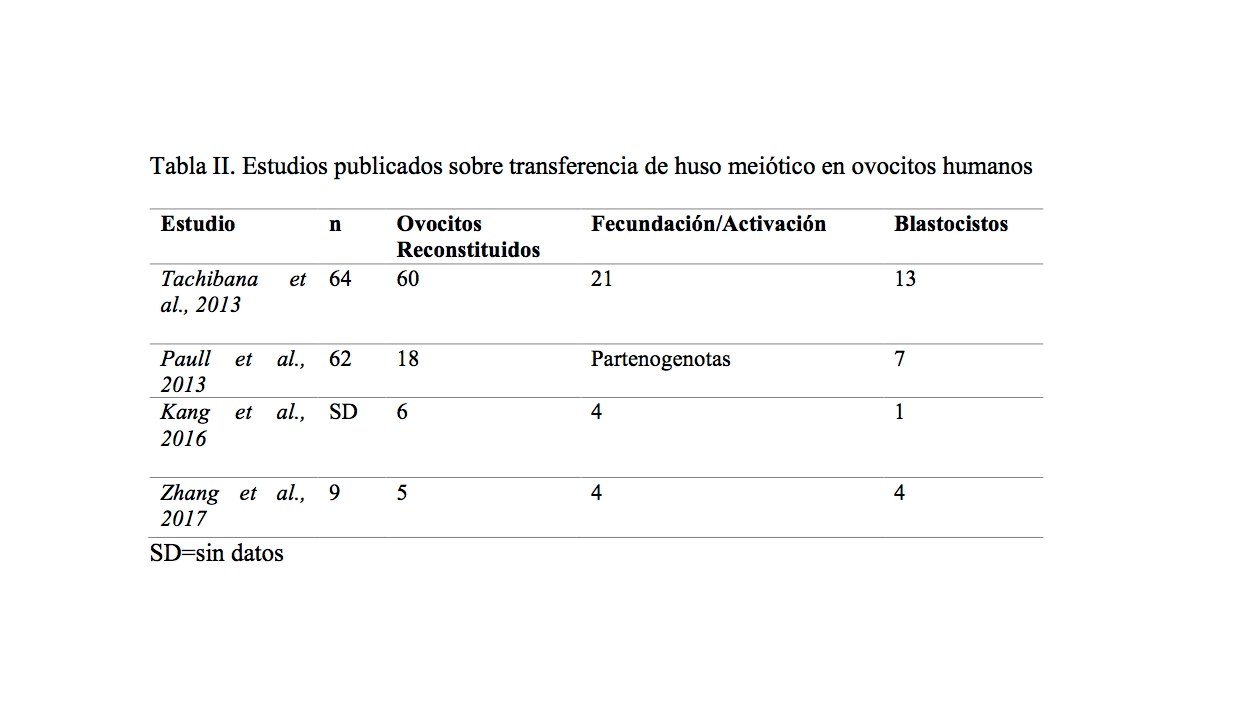
Los dos primeros estudios representados en el cuadro anterior sobre MRT en ovocitos humanos, obtuvieron bajos niveles de heteroplasmia (por debajo del 1%) confirmando la capacidad de la técnica para prevenir la transmisión de mutaciones del ADNmt a la descendencia. Sin embargo, una proporción significativa de cigotos resultantes contenían un número anormal de pronúcleos. Esta anomalía fue atribuida a un fallo en la segregación cromosómica en proceso de la meiosis, producido por una activación ovocitaria prematura durante la manipulación (Tachibana et al., 2013). El estudio realizado por Paull y colaboradores identifican que en células madre embrionarias derivadas de los blastocistos obtenidos, el cariotipo, la expresión de marcadores de pluripotencia, los perfiles metabólicos y la expresión de genes eran normales en comparación con los controles (Paull et al., 2013).
Aunque en el estudio de (Khang et al., 2016), la muestra es pequeña, las tasas de fecundación de los ovocitos generados por la transferencia del huso meiótico fueron comparables a las de los controles. Los protocolos modificados redujeron la tasa de activación anormal de ovocitos y alrededor del 75% de los cigotos se desarrollaron hasta la etapa de blastocito. Las tasas de aneuploidías y la calidad de los blastocistos fueron similares en comparación con los controles.
Con esta técnica, el equipo de Zhang, publicó el nacimiento de un niño sano de una mujer portadora de una enfermedad mitocondrial con una carga de mtDNA materna menor al 10% (Zhang et al., 2017).
Tabla II. Estudios publicados sobre transferencia de huso meiótico en ovocitos humanos
TRANSFERENCIA PRONUCLEAR
La transferencia Pronuclear (PNT) consiste en transferir los pronúcleos de un cigoto con ADNmt mutado al espacio perivitelino de otro cigoto donado previamente enucleado (Amato et al., 2014).
Después de la fecundación se extraen los pronúcleos, para ello, se penetra en la zona pelúcida con la pipeta de enucleación y se aspiran los pronúcleos junto con una pequeña porción del citoplasma conformando un karyoplast pronuclear. A continuación, se aspira el virus Sendai inactivado que actuará como agente que facilitará la fusión de membranas con el cigoto receptor. Por último, se inyecta la suspensión de virus junto con el karyoplast pronuclear en el espacio perivitelino de un cigoto enucleado receptor. Finalmente se incuba para facilitar la fusión de membranas (McGrath et al., 1983). El nuevo cigoto reconstituido contiene el núcleo con el ADN nuclear del cigoto del paciente y el citoplasma junto con el ADNmt del cigoto sano (Amato et al., 2014).
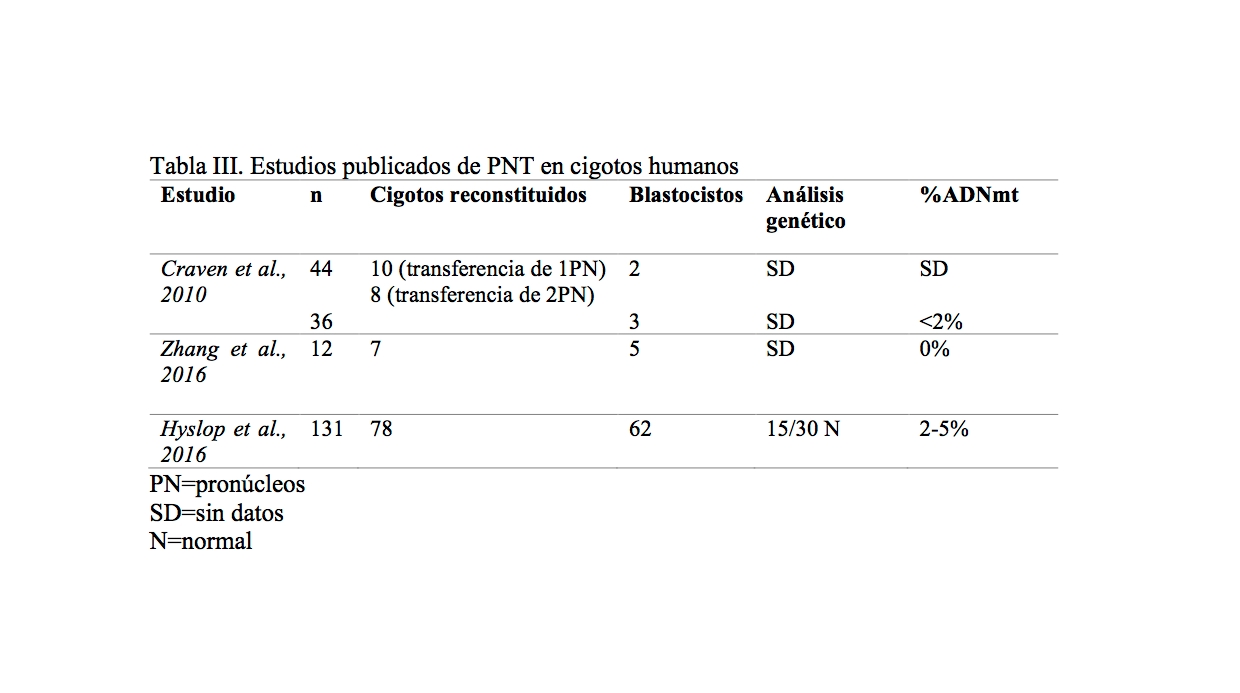
Craven et al., 2010, demostró que la transferencia de pronúcleos era compatible con el desarrollo in vitro de embriones humanos hasta el estadío de blastocisto. Para estudiar la viabilidad de la técnica, transfirió uno o dos pronúcleos entre cigotos anormalmente fecundados (unipronucleares y triplonucleares). En este caso la tasa de llegada a blastocisto fue del 8,3% y se debió fundamentalmente a la dotación cromosómicamente anormal de estos cigotos que limitó su potencial de desarrollo. La optimización del procedimiento minimizó significativamente el arrastre de ADNmt mutado con valores menores al 2%.
El equipo de Zhang en 2016, realizó una transferencia de pronúcleos en una pareja con repetidos bloqueos en el desarrollo embrionario. La paciente gestó en 3 ocasiones con resultado de un aborto espontáneo. Se analizaron los cariotipos de los tejidos embrionarios de los restos fetales y fueron normales cromosómicamente. Además, el perfil del ADNmt fetal indicaba que procedían de la donante sin signos del ADNmt de los pacientes. Por lo tanto, validaron que la transferencia pronuclear se había realizado con éxito.
Hyslop et al., 2016, publicaron un nuevo protocolo de transferencia pronuclear que incluía el trasplante de pronúcleos 8 horas después de la finalización del ICSI. Los autores demostraron que realizar esta técnica en este período de tiempo mejoraba la viabilidad de los embriones reconstituidos. El arrastre de ADNmt mutado en los blastocistos fue menor al 5%. La calidad de los blastocistos reconstituidos y los perfiles de expresión fueron comparables con los controles.
Tabla III. Estudios publicados de PNT en cigotos humanos
N=normal
PN=pronúcleos
SD=sin datos
TRANSFERENCIA CORPÚSCULO POLAR (PBNT)
El procedimiento se inicia con la recuperación del primer CP de un ovocito MII no fecundado de la paciente, seguido de una fusión con el citoplasma ovocitario enucleado de la donante. Los ovocitos MII reconstituidos se fecundan y transfieren a una receptora.
El segundo CP se recupera de cigotos en estadio pronuclear y se fusionan con cigotos receptores en los que se les ha eliminado los pronúcleos femeninos.
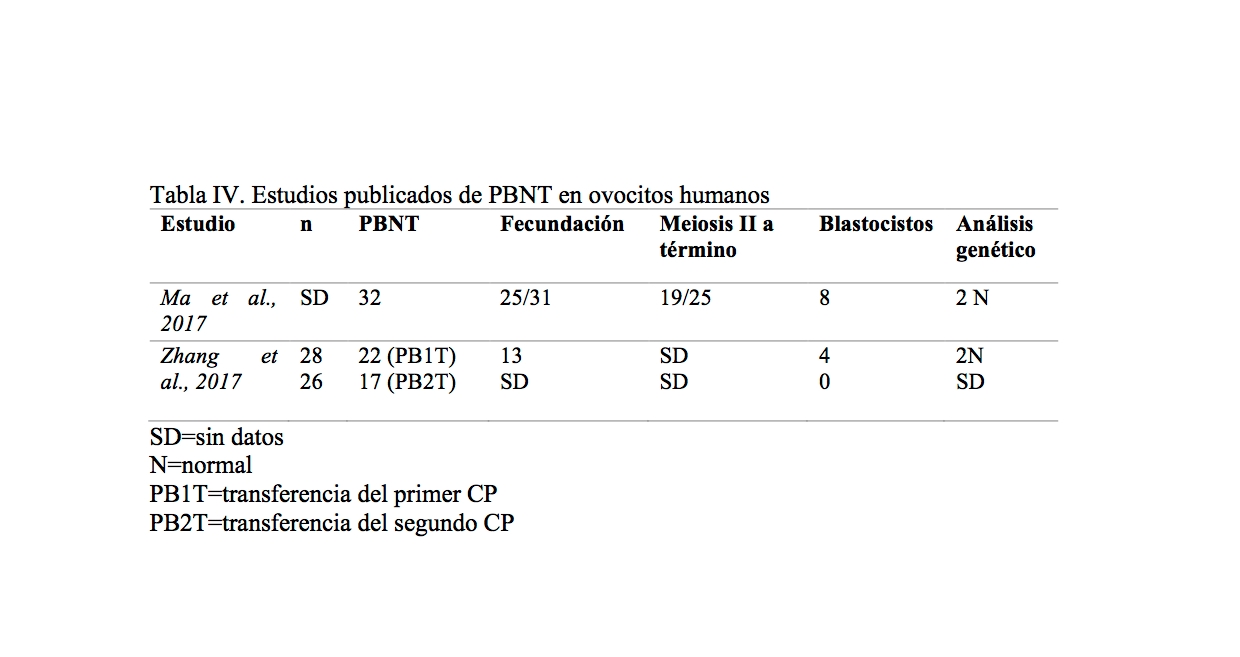
Los estudios previos en ratones demostraron la viabilidad de usar la transferencia de los corpúsculos polares como una herramienta clínica ya que ambos contienen poca cantidad de ADN mitocondrial (Wang et al., 2014; Wakayama et al., 1997,1998). El grupo de Ma et al., 2017 describen la transferencia a través del primer corpúsculo polar (PB1). Mientras que un 76% de los ovocitos fecundaron correctamente y fueron capaces de finalizar la segunda meiosis de forma normal, solamente un 42% de cigotos alcanzaron el desarrollo hasta blastocisto. Pero a pesar de una caída en la tasa de desarrollo embrionario, los análisis genéticos, epigenéticos y transcriptómicos de células madre embrionarias derivadas de los blastocistos indicaron una marcada similitud con los controles.
Los resultados del artículo de Zhang et al., 2017 revelaron que la transferencia del 1r CP, pero no la transferencia del 2n CP, podría generar con éxito cigotos normalmente fecundados con una alta eficiencia en el desarrollo a blastocistos.
Tabla IV. Estudios publicados de PBNT en ovocitos humanos
PB1T= Transferencia del primer CP
PB2T= Transferencia del segundo CP
N=Normal
SD= Sin datos
DISCUSIÓN
La transmisión de enfermedades mitocondriales, puede prevenirse mediante varios enfoques, de los cuales, cada uno de ellos presenta ventajas, desventajas, limitaciones técnicas y éticas asociadas. El trasplante del genoma nuclear puede realizarse una vez el ovocito es fecundado, o antes de este proceso de manera que, el proceso de la meiosis femenina ofrece varias opciones.
El trasplante de vesícula germinal presenta la ventaja que el núcleo en este estadio es grande y visible al microscopio. Sin embargo, esto requeriría la maduración in vitro de los ovocitos desde la etapa de vesícula germinal hasta la etapa MII, paso limitante para el éxito de la técnica. Además, los ovocitos inmaduros son más sensibles a su manipulación, posiblemente debido a la distribución de los microfilamentos en la región cortical y perinuclear, hecho que hace necesario el empleo de disruptores de microfilamentos para la enucleación.
Actualmente, la estrategia más prometedora es transferir el genoma nuclear a partir del huso meiótico que por el contrario a la transferencia de vesícula germinal o de pronúcleos, los cromosomas de los ovocitos MII no están rodeados por una membrana nuclear. Es por eso, que es necesario el uso de tinciones de ADN y de tecnologías de luz UV o luz polarizada para visualizar los cromosomas. Pero su uso no es deseable, ya que puede ocurrir una activación prematura del ovocito. Y, además, sería difícil eliminar la posibilidad de que algunos cromosomas no se alineen correctamente en la placa metafásica, tal y como se ha observado en ovocitos de mujeres en edad materna avanzada. A pesar de las desventajas técnicas, se ha reportado un recién nacido vivo con el mínimo arrastre de ADNmt.
La transferencia pronuclear requiere de la fecundación tanto de los ovocitos proporcionados por la paciente portadora de la enfermedad como de la donante, y por lo tanto su uso plantea complejas implicaciones éticas. Además, el procedimiento supone el tratamiento de los cigotos con fármacos inhibidores de componentes del citoesqueleto, para facilitar la extracción del núcleo.
Los genes en este estadio se encuentran empaquetados en pronúcleos grandes claramente visibles, lo cual representa una ventaja para su extracción. También, la optimización de los procedimientos de enucleación y cultivo de embriones ha facilitado el desarrollo de blastocistos de buena calidad y con el mínimo arrastre de ADNmt.
El uso de los corpúsculos polares podría usarse como fuente de ADN nuclear con un mínimo arrastre de ADN mitocondrial. El 1r CP tiene fácil visualización y manipulación. Asimismo, no genera heteroplasmia en la descendencia y se lleva a cabo a nivel de ovocitos no fecundados. Para la transferencia del 2º CP, se lleva a cabo una vez el ovocito es fecundado, pero el principal inconveniente es que el 2º CP sólo tiene un haplotipo. Ambos nos permiten reducir el número de ovocitos requeridos de mujeres afectadas por mutaciones de mtDNA.
Las estrategias, propuestas anteriormente, han demostrado ser eficientes tanto en modelos animales, como en humanos. Pero su aplicación en la clínica aún sigue siendo un desafío. Similar a la donación de ovocitos, requieren la disponibilidad de suficientes donantes de ovocitos o cigotos, lo que podría ser un obstáculo para su aplicación. Cada vez hay más evidencias que sugieren que el uso de estas innovadoras tecnologías debe adoptarse con precaución y únicamente en pacientes altamente seleccionados. Y parece preferible restringirla en situaciones en el que el diagnóstico preimplantacional no pueda seleccionar embriones libres de estas anomalías genéticas.
A día de hoy son necesarios nuevos estudios de seguridad y eficacia que supervisen el uso de estas nuevas y prometedoras tecnologías que podrían evitar la transmisión de una enfermedad a la descendencia, manteniendo los genes maternos.
Referencias
Amato P, Tachibana M, Sparman M, et al. Three-parent in vitro fertilization: gene replacement for the prevention of inherited mitochondrial diseases. Fertil Steril 2014;101(1):31–5.
Barritt JA, Brenner CA, Malter HE, Cohen J. Mitochondria in human offspring derived from ooplasmic. Human Reproduction 2001;16(3):513-6
Brenner CA, Barritt JA, Willadsen S et al. Mitochondrial DNA heteroplasmy after human ooplasmic transplantation. Fertil Steril 2000; 74(3):573-8.
Brown DT, et al. Transmission of mitochondrial DNA disorders: possibilities for the future. Lancet 2006; 368(9529):87- 9.
Cohen J, Scott R, Alikani M, et al. Ooplasmic transfer in mature human oocytes, Mol. Hum. Reprod 1998;4(3):269-80.
Cohen J, Scott R, Schimmel T, et al. Birth of infant after transfer of anucleate donor oocyte cytoplasm into recipient eggs. Lancet 1997;350(9072):186-7.
Craven L, Tang MX, Gorman GS, De Sutter P, Heindryckx B. Novel reproductive technologies to prevent mitochondrial disease. Hum Reprod Update 2017;23(5):501-519.
Craven, L., Tuppen, H.A., Greggains, G.D., et al. Pronuclear transfer in human embryos to prevent transmission of mitochondrial DNA disease. Nature 2010; 465(7294):82-5.
Hellebrekers DM, Wolfe R, Hendrickx AT, de Coo IF, de Die CE, Geraedts JP, Chinnery PF, Smeets HJ. PGD and heteroplasmic mitochondrial DNA point mutations: a systematic review estimating the chance of healthy offspring. Hum Reprod Update 2012;18(4):341-9.
Hyslop, L.A., Blakeley, P., Craven, L., et al. Towards clinical application of pronuclear transfer to prevent mitochondrial DNA disease. Nature 2016; 534(7607):383-6.
Kang, E., Wu, J., Gutierrez, N.M., Koski, A., et al. Mitochondrial replacement in human oocytes carrying pathogenic mitochondrial DNA mutations. Nature 2016; 540(7632):270-275.
Ma H, O’Neil RC, Marti Gutierrez N et al. Functional Human Oocytes Generated by Transfer of Polar Body Genomes. Cell Stem Cell 2017; 20(1):112-119
McGrath J, Solter D. Nuclear transplantation in the mouse embryo by microsurgery and cell fusion. Science 1983; 220(4603):1300- 2.
Palacios-González, C., & Medina-Arellano, M. D. J. Mitochondrial replacement techniques and Mexico’s rule of law: on the legality of the first maternal spindle transfer case. Journal of Law and the Biosciences, 2017; 4(1):50-69.
Paull D, Emmanuele V, Weiss KA, et al. Nuclear genome transfer in human oocytes eliminates mitochondrial DNA variants. Nature 2013; 493(7434):632-7.
Poulton J, Kennedy S, Oakeshott P, et al. Preventing transmission of maternally inherited mitochondrial DNA diseases. BMJ 2009; 338:b94.
Richardson J, Irving L, Hyslop LA., et al. Concise reviews: Assisted reproductivetechnologies to prevent transmission of mitochondrial DNA disease. Stem Cells 2015;33(3):639-45.
Rulli T. What is the value of three-parent IVF? Hast Cent Rep 2016;46(4):38–47.
Tachibana, M., Sparman, M., Sritanaudomchai, H., et al. Mitochondrial gene replacement in primate offspring and embryonic stem cells. Nature 2009; 461(7262):367-72.
Tachibana, M., Amato, P., Sparman, M., et al. Towards germline gene therapy of inherited mitochondrial diseases. Nature 2013; 493(7434):627-31.
Takeuchi T, Gong J, Veeck LL, Rosenwaks Z, Palermo GD. Preliminary findings in germinal vesicle transplantation of immature human oocytes. Hum Reprod 2001;16(4):730-6.
Tesarik J, Martinez F, Rienzi L, Ubaldi F, Iacobelli M, Mendoza C, Greco E. Microfilament disruption is required for enucleation and nuclear transfer in germinal vesicle but not metaphase II human oocytes. Fertil Steril 2003;79 Suppl 1:677-81.
Wakayama T, Yanagimachi R. The first polar body can be used for the production of normal offspring in mice. Biol Reprod 1998; 59(1):100-4.
Wakayama T, et al. Participation of the female pronucleus derived from the second polar body in full embryonic development of mice. J Reprod Fertil 1997; 110(2):263-6.
Wang T, Sha H, Ji D, et al. Polar body genome transfer for preventing the transmission of inherited mitochondrial diseases. Cell 2014; 157(7):1591-604.
Yabuuchi, A., Beyhan, Z., Kagawa, N., et al. Prevention of mitochondrial disease inheritance by assisted reproductive technologies: prospects and challenges. Biochim. Biophys 2012; 1820(5):637-42.
Zhang, JK., Wang, C. W., Krey, L., et al. In vitro maturation of human preovulatory oocytes reconstructed by germinal vesicle transfer. Fertil. Steril 1999; 71(4):726-31.
Zhang, J., Liu, H. Cytoplasm replacement following germinal vesicle transfer restores meiotic maturation and spindle assembly in meiotically arrested oocytes. Reprod. Biomed. Online 2015; 31(1):71-8.
Zhang, J., Zhuang, G., Zeng, Y., et al. Pregnancy derived from human zygote pronuclear transfer in a patient who had arrested embryos following in vitro fertilization. Reprod. Biomed. Online 2016; 33(4):529-533.
Zhang J, Liu H, Luo S, et al. Live birth derived from oocyte spindle transfer to prevent mitochondrial disease. Reprod BioMed Online 2017;34(4):361–8.
Zhang SP, Lu CF, Gong F et al. Polar body transfer restores the developmental potential of oocytes to blastocyst stage in a case of repeated embryo fragmentation. J Assist Reprod Genet 2017;34(5):563-571.